基于MRI与病理对照的骨肉瘤动态增强MRI定量参数与肿瘤微循环及乏氧性表达的相关性研究*
李佳璐 王瑶 马焕 李梅 李鹍 丁莹莹 陶海波
作者单位:①杭州医学院附属临安人民医院放射科(杭州市310000);②昆明医科大学第三附属医院/云南省肿瘤医院放射科;③昆明医科大学第三附属医院/云南省肿瘤医院病理科
骨肉瘤是最常见的原发性恶性骨肿瘤,是青少年因肿瘤死亡的主要原因之一,好发于长骨干骺端,以股骨远端及胫骨近端为主[1-2]。为准确评估骨肉瘤新辅助化疗疗效,寻求能够提供与术前疗效相关的肿瘤组织学信息的影像评估手段尤为重要。研究表明,肿瘤坏死程度、微血管生成及乏氧状态与肿瘤生长、转移、疗效密切相关[3-4]。目前,病理学上评价肿瘤微血管生成及乏氧情况最常用的方法是检测肿瘤组织微血管密度(microvessel density,MVD)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和乏氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)的表达水平[3-5]。MVD 和VEGF 可反映肿瘤微血管生成情况,是骨肉瘤抗血管生成治疗研究的重要依据;HIF-1α 主要在肿瘤组织中表达,肿瘤乏氧区对化疗药物具有一定的耐药性[3-4]。动态增强磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI)是一种定量灌注成像方法,已广泛应用于胶质瘤[6]、乳腺癌[7]、结直肠癌[8]、软组织肉瘤[9]等恶性肿瘤微血管生成情况的评价,但应用于骨肉瘤的研究相对较少。本研究采用MRI 影像与病理组织对照的方法,探究骨肉瘤DCE-MRI 图像上病灶各感兴趣区(region of interest,ROI)内各定量参数(Ktrans、Kep、Ve、Vp)与相应病理组织标本的TNR、MVD、VEGF 及HIF-1α 表达水平之间的关系,旨在通过定量参数反映骨肉瘤肿瘤微环境中微血管生成及乏氧情况。
1 材料与方法
1.1 临床资料
分析昆明医科大学第三附属医院2019年1月至2020年6月间经手术病理证实的原发于股骨远端、胫骨近端骨肉瘤患者10 例,其中男性9 例,女性1 例;年龄11~32 岁,中位年龄17.5 岁。发病部位为胫骨近端6 例,股骨远端4 例。纳入标准:1)所有患者就诊前未接受任何治疗;2)无MRI、新辅助化疗(NAC)及手术禁忌证,化疗方案为阿霉素+顺铂、甲氨蝶呤+长春新碱、异环磷酰胺序贯化疗;3)按期完成NAC 后行MRI 检查,2 周内行扩大根治手术;4)MRI 影像资料均满足数据测量要求。本研究经本院伦理委员会批准,入选患者及监护人均签署知情同意书。
1.2 方法
1.2.1 MRI 检查及定量参数测量 采用Philips Ingenia 3.0 T MR 仪及膝关节线圈进行检查,依次行常规MRI 平扫、定量DCE-MRI、MRI 常规增强。常规平扫包括多体位T1WI、T2WI 及脂肪抑制T2WI 序列。定量DCE-MRI 采用扰相梯度回波快速3D-DYNAMIC 序列行矢状位T1WI 连续多期动态增强扫描,序列参数:反转角度分别为5°、15°,TE 2.0 ms、TR 4.0 ms、层厚3.5 mm、间距0、FOV 250×250 mm,第5 期结束后高压注射器团注对比剂(Gd-DTPA 0.1 mmoL/kg,2.5 mLs)并生理盐水冲管(20 mL,2.5 mL/s),共扫描80 期,每期采集图像24 幅,扫描时间4.7 s,共采集1 920 幅图像。
使用GE Healthcare 血流动力学软件Omni Kinetics 分析DCE-MRI 图像数据,以股动脉为参考血管并勾画动脉输入函数(AIF),选择Extended Tofts linear 血流动力学模型[10]。在与瘤段病理组织切片对应的正中矢状位影像层面建立坐标系,按照瘤段切片分割的组织块样本定位并等比例勾画1 cm×1 cm 大小ROI,测量各ROI 内定量参数,包括容量转移常数(volume transfer constant,Ktrans)、速率常数(rate constant,Kep)、血管外细胞外间隙容积分数(volume fraction,Ve)、血浆容积分数(plasma volume fraction,Vp)(图1)。同1 个AIF 重复测量3 次,取3 次测量的平均值为最终分析数据。
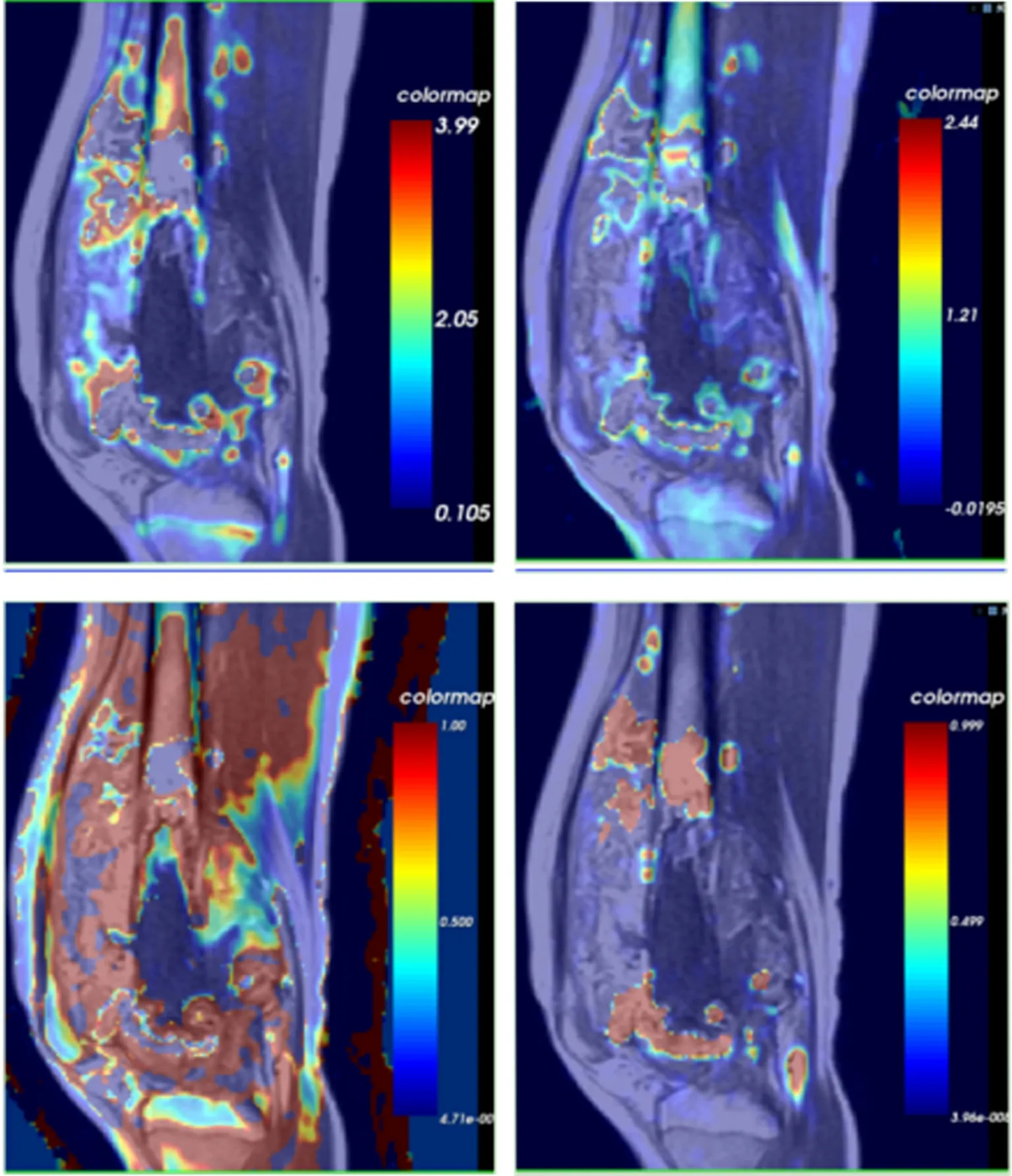
图1 定量DCE-MRI
1.2.2 病理组织定位取材方法及评估标准 MRI 检查后2 周内经手术取得完整瘤段,沿正中矢状面剖开,选择一侧剖面取5 mm 厚度切片,并网格状分割为若干1 cm×1 cm 组织块,依次进行编号、制备蜡块、H&E 染色、CD34、VEGF 及HIF-1α 免疫组织化学染色(图2,3)。由两名分别具有5年和10年以上工作经验的骨肿瘤病理医师判读H&E 及免疫组织化学染色切片,评估TNR、计数MVD,并判断VEGF、HIF-1α表达情况。TNR 根据Huvos 分级标准[11]分级,MVD采用Weinder 计数方法[12],VEGF 及HIF-1α 表达结果判读参考《免疫组织化学反应结果的判断标准》[13]。
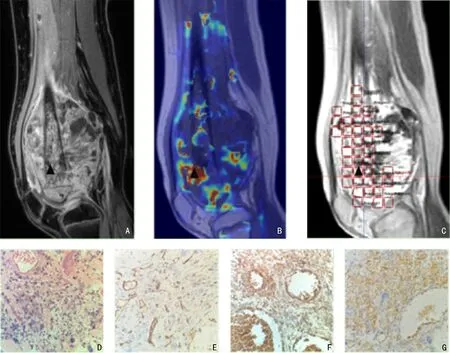
图3 组织样本影像及病理表现
1.3 统计学方法
采用SPSS 25.0 软件进行统计学分析。计量资料采用±s或M(P25%,P75%)表示;计数资料采用绝对值或百分比(%)表示。采用Shapiro-Wilk 和Levene 检验样本的正态性及方差齐性。采用Poisson 回归及Logistic 回归分析DCE-MRI 定量参数与MVD、VEGF、HIF-1α 的关系并绘制受试者工作特征曲线(ROC),计算诊断阈值、敏感度和特异性。以P<0.05 为差异具有统计学意义。
2 结果
2.1 病理样本一般情况及TNR、MVD、VEGF、HIF-1α 表达情况
获取完整瘤段10 例,肿瘤最大径为4.4~20.7 cm,平均11.3 cm;分割组织块共取得病理样本507 个,排除H&E 染色证实非肿瘤组织样本47 个,共460 个有效病理样本纳入分析。根据Huvos 分级标准[11],TNRⅠ级346 个(75.2%),Ⅱ级55 个(12.0%),Ⅲ级32 个(7.0%),Ⅳ级27 个(5.8%)。反应良好组(TNR≥90%)为Ⅲ级和Ⅳ级,共59 个(12.8%),反应差组(TNR<90%)为Ⅰ级和Ⅱ级,共401 个(87.2%)。VEGF 阳性表达311 个(67.6%),阴性149 个(32.4%)。HIF-1α 阳性表达68 个(14.8%),阴性392 个(85.2%)。
2.2 病理样本反应良好组与反应差组间DCE-MRI定量参数、MVD 计数、VEGF 及HIF-1α 表达情况比较
化疗后,反应良好组Ktrans、Kep、Ve、Vp均明显高于反应差组,差异具有统计学意义(P<0.05,表1)。反应良好组MVD 计数明显高于反应差组(Z/χ2=-4.067,P<0.01)。反应良好组VEGF 阳性率高于反应差组,而HIF-1α 阳性率低于反应差组,差异均具有统计学意义(均P<0.05,表2)。
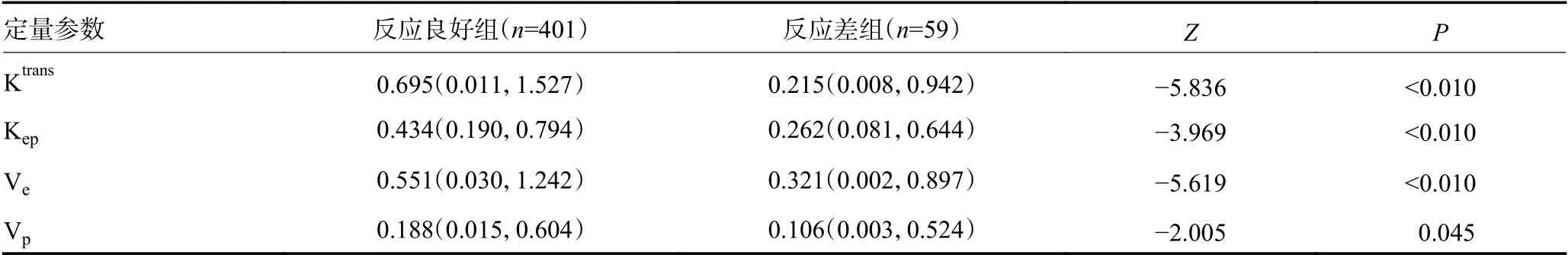
表1 病理样本反应良好组与反应差组间DCE-MRI 定量参数比较
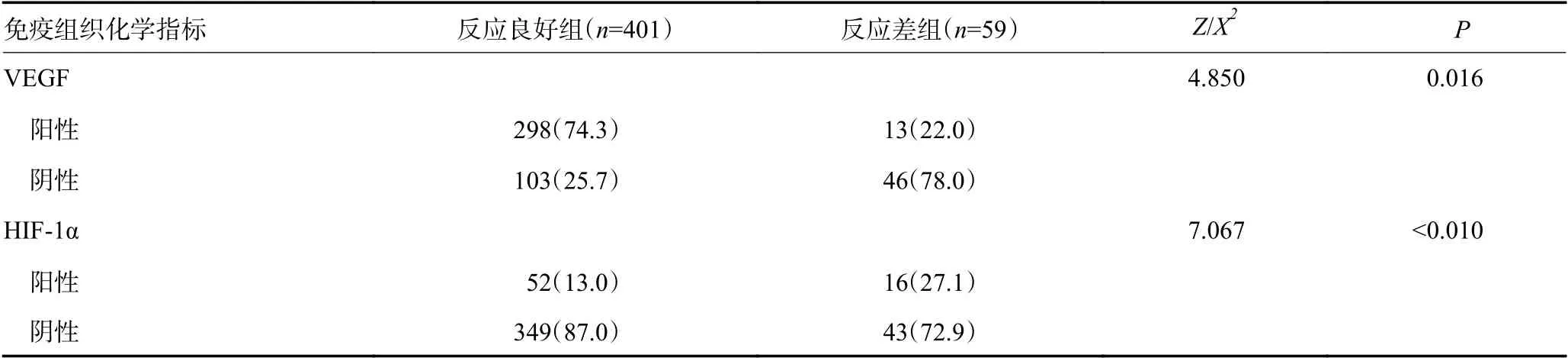
表2 病理样本反应良好组与反应差组间VEGF 及HIF-1a 比较 n(%)
2.3 DCE-MRI 定量参数与MVD 计数之间的关系
MVD 计数符合Poisson 分布,将lg(MVD)与DCE-MRI 定量参数带入Poisson 回归模型,经逐步回归筛选变量后,结果显示Ktrans、Kep、Ve与MVD 具有相关性(均P<0.01),其中Ktrans与MVD 呈负相关,Kep和Ve与MVD 呈正相关,回归系数分别为-0.652、0.525、0.418;Vp与MVD 的相关性差异无统计学意义(P>0.05)。
2.4 DCE-MRI 定量参数与VEGF、HIF-1α 表达之间的关系
利用Logistic 回归模型分析DCR-MRI 定量参数与VEGF、HIF-1α 关系,结果显示Ve预测VEGF、Kep预测HIF-1α 的表达差异均具有统计学意义(均P<0.01)。绘制ROC 曲线发现,当Ve>0.634 时,预测VEGF 表达阳性的AUC 为0.609,敏感性为63.7%,特异性60.0%(图4A);当Kep>0.115 min-1时,预测HIF-1α 表达阳性的AUC 为0.614,敏感性为42.2%,特异性83.3%(图4B)。
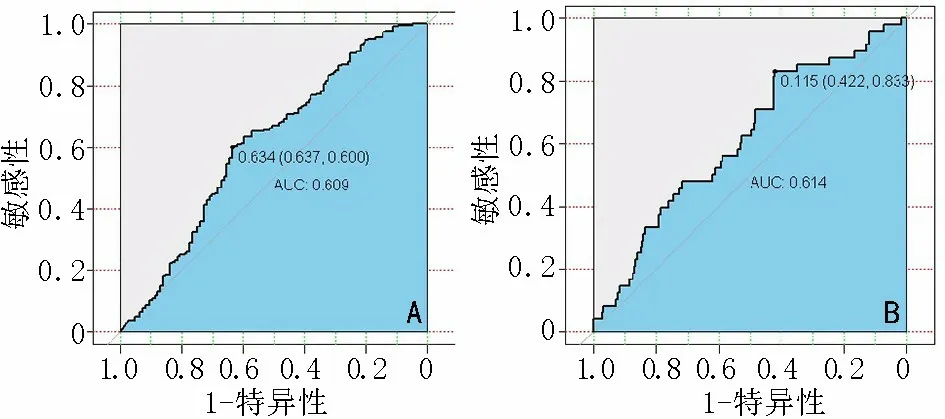
图4 定量DCE-MRI 参数ROC 曲线预测VEGF 和HIF-1α 表达效能
3 讨论
肿瘤组织微循环、新生血管状态、细胞坏死及乏氧性等肿瘤异质性因素与肿瘤生长、转移、疗效等密切相关[3-4]。定量DCE-MRI 技术具有实时、无创、可重复监测的优点,能够有效的反映肿瘤血管的通透性和肿瘤组织的血液灌注并进行定量评估,在肿瘤疗效评价方面应用广泛[6-9]。
TNR 是评估骨肉瘤NAC 疗效的病理学“金标准”[5,11]。增殖活跃的肿瘤组织细胞排列密集,细胞外间隙小,新生血管丰富,不成熟微血管随之增多,均导致微血管渗透性增高。因此,Ktrans、Ve、Vp值较高。随着肿瘤生长、体积增大及化疗药物作用,肿瘤细胞坏死增多,微血管密度减小,血管外细胞外间隙增大,故Ktrans、Ve、Vp值降低,Kep值升高,本研究结果与既往研究一致[6-9,14]。Guo 等[15]对69 例接受NAC 的骨肉瘤患者研究表明,反应良好组(TNR≥90%)DCEMRI 定量参数值随化疗进展明显下降,其中Ktrans、Vp值在化疗反应良好组和反应差组中差异均具有统计学意义(均P<0.05),与本研究结果大致相同。因此,Ktrans和Ve预测骨肉瘤组织坏死情况具有意义。
肿瘤微血管生成及分布状态与肿瘤增殖能力密切相关。MVD 能够评估病灶内微血管生成水平及分布情况。王东等[16]观察70 例长骨成骨肉瘤发现,微血管分布体现了骨肉瘤异质性,在肿瘤外周区,以软组织肿瘤成分为主,细胞增殖活跃,微血管密度高;在肿瘤中央区,以骨性成分为主,微血管密度低,瘤骨细胞增殖受限。随访所有患者生存期绘制生存曲线,结果表明骨肉瘤患者MVD 与生存率相关。本研究中观察样本块切片可见相似情况,在实性成分为主的软组织肿瘤区,MVD 值高,多数微血管形态成熟,畸变率低,而在骨样组织为主的瘤骨及骨化中心区,MVD 值低,微血管分化程度低。Jia 等[6]发现胶质母细胞瘤中Ktrans与MVD 呈正相关(r=0.683,P<0.001)。Liu 等[17]发现宫颈癌肿瘤组织MVD 较正常宫颈组织明显升高,同时宫颈癌Ktrans、Kep、Ve值明显高于正常宫颈组织。上述研究结果表明,定量DCE-MRI 在一定程度上能够反映肿瘤微血管密度和分化程度。本研究中Ktrans与MVD 呈负相关,Kep、Ve与MVD 呈正相关,表明骨肉瘤组织样本块在微血管分布热点区的微血管多高度分化,血管内皮细胞排列整齐,管壁不全、异形的微血管较少,致血管渗透性低。
VEGF 是肿瘤血管生成通路中最重要的启动诱导因子之一,不仅可促进血管生成,而且还能催化肿瘤细胞浸润和转移[4]。HIF-1α 表达升高在肿瘤缺氧的适应过程中起关键作用[3]。朱辉严等[18]研究乳腺癌DCEMRI 表现与VEGF 表达水平的关系,结果发现乳腺癌VEGF 阳性表达率达80%,与乳腺癌MRI 边缘毛刺(r=0.451,P=0.013)和早期边缘强化(r=0.843,P=0.001)呈显著正相关。韩文梅等[19]研究DCE-MRI诊断非小细胞肺癌及评估靶向药物疗效的价值,发现DCE-MRI 诊断NSCLC 准确率、灵敏度、特异度分别高达98.08%、98.67%、83.33%;VEGF 阳性组患者最大强化率(maximum enhancement rate,MER)、强化斜率(slope of increase,Slope)水平均高于阴性患者(P<0.05);有效组患者MER、Slope 水平均高于无效组患者(P<0.05)。谭建儿等[20]报道32 例胶质瘤的HIF-1α 表达与Ktrans、Kep、Ve具有相关性(P<0.05)。
虽然上述研究结果表明DCE-MRI 在肿瘤诊断及疗效评估中均有较高价值,但DCE-MRI 大量的数据测量涉及ROI 的选取,大部分研究在肿瘤最大层面选取整个病灶作为感兴趣区,未能将坏死、囊变、出血等区域剔除,并不能真实反映各区域肿瘤组织信息,这可能会影响测量结果的准确性[6-9,14,18-19]。因此,本研究采用影像—病理位置匹配的方法,严格进行影像感兴趣区与病理样本匹配,能够更准确反映每个病理组织块TNR、MVD、VEGF 及HIF-1α 与定量参数之间的关系。本研究基于影像—病理对照结果提示DCE-MRI定量参数Kep、Ve评价骨肉瘤MVD、VEGF、HIF-1α有一定临床价值,或可为骨肉瘤疗效评估及临床治疗决策提供依据。
综上所述,DCE-MRI 定量参数一定程度上能够反映骨肉瘤肿瘤坏死、微循环血管生成及乏氧性,有望成为术前无创评估疗效的方法。本研究也存在一定的局限性。首先,尽管位置匹配采集的大量组织样本块基本体现了肿瘤异质性,但本研究为单中心研究,入组病例数较少,在反映人群个体化差别方面有所欠缺。其次,骨肉瘤骨化区域和软组织区域在病理学形态和性质方面有较大差别[21],本研究未将二者区分开来,在结果反映上存在局限性。

