采前不同比例LED红蓝光连续光照对生菜光合特性及产量和品质的影响
张玉彬,刘文科,杨其长,邵明杰,查凌雁,周成波,李宝石,王奇
(中国农业科学院农业环境与可持续发展研究所,农业农村部设施农业节能与废弃物处理重点实验室,北京 100081)
抗坏血酸(ascorbic acid,AsA),又称维生素C,是一种抗氧化剂。AsA与其他抗氧化剂共同组成抗氧化系统,可保护植物免受有氧代谢、光合作用和多种污染物等造成的氧化损害[1]。AsA与人类健康关系密切,人类及动物自身无法合成AsA,必须通过饮食获取[2]。AsA可通过参与AsA-GSH循环途径清除人体内过多的活性氧[3]。AsA通过反应底物或酶辅助因子的形式参与人体内胶原合成过程等多种生化反应,胶原蛋白缺乏会导致坏血病的发生[4]。AsA还有降低血脂和抑制致癌物质产生等作用[5]。此外,AsA也是蔬菜中的重要品质物质,由于人体无法合成AsA,蔬菜成为人体AsA的主要来源。
目前,已经探明的AsA合成途径主要是L-半乳糖途径[6]。L-半乳糖酸-1,4-内酯脱氢酶(L-galactono-1,4-lactone dehydrogenase,GalLDH)是植物AsA合成途径中最后一步的酶,它的活性决定了AsA含量的高低。植物体内的AsA主要是通过抗坏血酸过氧化物酶(ascorbate peroxidase,APX)和抗坏血酸氧化酶(ascorbate oxidase,AO)被氧化分解为单脱氢抗坏血酸(monodehydroascorbic acid,MDHA),MDHA可以生成脱氢抗坏血酸(dehydroascorbic acid,DHA),或通过单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDHAR)再次还原为AsA。而氧化形成的DHA可以在脱氢抗坏血酸还原酶(dehydroascorbic acid reductase,DHAR)的作用下被还原为AsA,或者被水解为2,3-二酮古洛糖酸。谷胱甘肽还原酶(glutathione reductase,GR)作为氧化还原酶,可催化氧化型谷胱甘肽(oxidized glutathione,GSSG)还原为还原型谷胱甘肽(glutathione,GSH),进而维持植物体内GSH的含量,DHA还原再生为AsA的过程需要GSH提供电子供体[7]。植物AsA含量的高低是合成、降解、转运各种代谢之间共同作用的结果[3]。AsA的合成代谢受多种环境因子的影响[8-9],如光照、温度等对AsA积累会产生显著的影响,其中光环境对AsA代谢途径的影响尤为重要。光环境的变化可以显著影响植物的生长发育及其叶片的光合作用进程,同时,光合作用所生成的碳水化合物也为植物AsA的合成代谢提供了物质基础。因此,光环境对于植物体内AsA含量有重要影响。
连续光照通常是指改变植物原有的明暗交替的光周期规律,给植物提供连续24 h或超过24 h的光照。研究发现,连续光照可加速植物的生长、增加生物量、提高品质等[10-12]。Ohyama等[13]研究表明,连续光照促使番茄植株鲜重、干重及叶面积等显著提高;周晚来[14]研究发现,在生菜采收前,进行短期连续光照可以显著降低水培生菜的硝酸盐含量并提高可溶性糖、AsA等营养物质的含量;Zha等[15]在生菜幼苗移栽10 d后进行12 d不同光强的连续光照,结果表明,抗坏血酸含量和参与AsA代谢的酶活性与连续光照光强呈正相关关系,且APX和DHAR酶活性对连续光照光强的响应分别最大和最小。光谱组成也是影响连续光照对植物作用效果的重要光环境因子之一,适当的红蓝光质比例可以有效提高植物的的产量和品质。但目前关于采前连续光照光质对于AsA的影响机理尚不清楚。
生菜是一种被广泛食用的叶菜类蔬菜,也是人工光植物工厂广泛种植的代表性蔬菜。在植物工厂内,生菜生产通常以提高氮素投入的方法来提高其产量,但以AsA为代表的营养物质含量却显著降低。解决在提高水培生菜产量的同时,又提升生菜体内AsA等营养物质含量的问题具有重要的现实意义。本研究在水培生菜生长过程中,采用LED红蓝光进行采前72 h连续光照处理提高生菜的产量和品质,同时探究采前连续光照光质对水培生菜体内AsA相关代谢网络影响,更深层次地阐明采前连续光照光质对生菜体内AsA的影响机理,以期为植物工厂中高产优质蔬菜的生产中采前连续光照光质的调控提供理论依据。
1 材料与方法
1.1 试验地概况
试验在中国农业科学院农业环境与可持续发展研究所植物工厂内进行,栽培环境温度为(25±1)℃,相对湿度为65%±5%。生菜前期育苗和试验期间均采用营养液水培,营养液配方为:4 mmol·L-1Ca(NO3)2·4 H2O、0.75 mmol·L-1K2SO4、0.5 mmol·L-1KH2PO4、0.1 mmol·L-1KCl、0.65 mmol·L-1Mg SO4·7 H2O、1.0×10-3mmol·L-1H3BO3、1.0×10-3mmol·L-1MnSO4·H2O、1.0×10-4mmol·L-1CuSO4·5H2O、1.0×10-3mmol·L-1ZnSO4·7 H2O、5×10-6mmol·L-1(NH4)6Mo7O24·4 H2O、0.1 mmol·L-1EDTA-Fe。
1.2 试验设计
试验以“意大利耐抽薹”生菜(LactucasativaL.)为试验材料,先将种子播种于海绵块中育苗,培养15 d后将大小一致的生菜苗随机移栽于长方形塑料栽培槽(长180 cm、宽60 cm、高6 cm)内,并于次日开始光照试验。
试验前期正常光照采用LED红蓝光面板灯进行光照处理,LED灯的光照强度为150 μmol·m-2·s-1,红光与蓝光的组成比例为4∶1,光暗周期设置为16 h/8 h,光期时间段为6:00—22:00。植物工厂生菜因品种不同,生长发育速度也不同,本试验统一连续培养17 d,生菜长到15片叶左右,达到采收标准时,开始进行不同比例红(R)蓝(B)光质的光照集中连续处理72 h,从定植后第18 d的6:00开始,在第21 d的6:00光照结束。连续光照红蓝光质比例设置5个处理,分别为1∶4(1R:4B)、1∶2(1R:2B)、1∶1(1R:1B)、2∶1(2R:1B)和4∶1(4R:1B)。同时以采前72 h连续光照处理前的取样(BCL)作为对照处理。每个处理栽培生菜26株,选用红光波峰为655 nm,蓝光波峰为430 nm的LED红蓝光组合灯板(49 cm×49 cm)进行光照处理。灯板放置在栽培槽上方40 cm处。
1.3 测定指标及方法
在集中连续照射开始和结束时取样,采用叶绿素含量测定仪(SPAD-502,Konica Minolta,日本)测定叶绿素含量 (SPAD)。分别于每个处理中随机选8株生菜作为重复样本,从茎基部切开。其中4株的地上部分将叶片与叶柄分离后,迅速用液氮冷冻,并用高通量组织研磨器在低温下把用液氮冷冻好的植物样品研磨成粉末,放至-80 ℃冰箱中留样备用;另外4株用电子计数天平称取地上部鲜重和根鲜重,用叶面积仪(Li-3100C,Li-Cor,Biosciences,美国)测量整株生菜叶片的叶面积,然后将生菜100 ℃杀青20 min,80 ℃ 烘干至恒重,用分析天平分别称取地上部干重和根干重。采用便携式光合仪(LI-6400XT,NE,美国)分别在采前连续光照前后分2次测定生菜不同处理下叶片的净光合速率(net photosynthetic rate,Pn)、蒸腾速率(transpiration rate,Tr)、胞间CO2浓度(intercellular CO2concentration,Ci)和气孔导度(stomatal conductance,Gs)。
硝酸盐含量采用硫酸-水杨酸法[16]测定,可溶性糖含量采用硫酸-苯酚法[17]测定。APX酶活性参考文献[18]的测定方法测定。DHAR、MDHAR和GR的酶活性参照Ma等[19]方法测定。GalLDH酶活性均采用试剂盒测定。抗坏血酸含量参考Spínola等[20]方法测定。
1.4 数据分析
采用Microsoft Excel 2015进行数据整理,采用SPSS 25.0软件对数据进行差异显著性检验分析(LSD法,α=0.05)。
2 结果与分析
2.1 采前不同比例LED连续光照对生菜生长的影响
2.1.1对生菜生物量的影响 由表1可知,与连续光照前(BCL)相比,采前72 h进行LED连续光照后,地上部鲜重和干重以及根的鲜重和干重均显著增加。其中,地上部鲜重的增幅为38.82%~77.65%,1R:4B处理下的地上部鲜重最小为23.60 g,2R:1B处理下的地上部鲜重最大达到30.23 g;地上部干重的增幅为89.74%~94.87%,各处理间地上部干重无显著差异;根鲜重的增幅为27.43%~73.14%,1R:2B处理下的根鲜重最小为2.23 g,4R:1B处理下的根鲜重最大为3.03 g;根干重的增幅为39.84%~65.38%,各处理间的根干重无显著差异。可见,采前LED连续光照光质的红光比例越低,地上部和根的鲜重越低。采前LED连续光照光质的红蓝光比例对地上部和根的干重无显著影响。
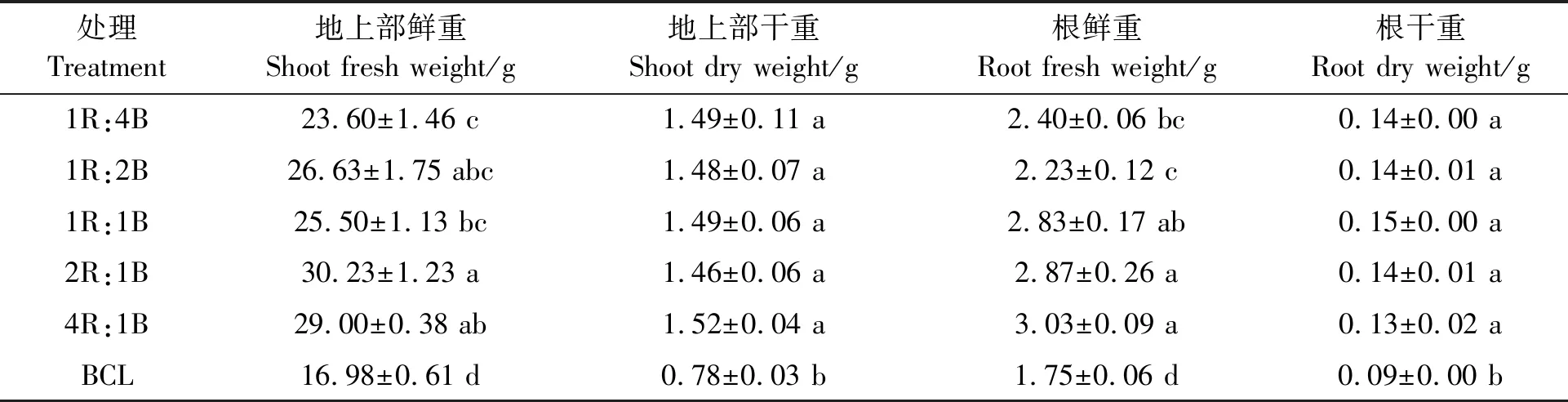
表1 不同处理下的生菜生物量Table 1 Lettuce biomass under different treatments
2.1.2对生菜生长指标的影响 采前LED连续光照光质对生菜的形态指标具有显著影响。由表2可知,与连续光照前(BCL)相比,采前72 h进行LED连续光照处理后,生菜的叶面积、SPAD(叶绿素含量)、干物质含量和比叶重均显著增加。其中,叶面积的增幅为32.43%~68.09%,1R:4B处理下生菜叶面积最小为477.58 cm2,2R:1B处理下生菜叶面积最大达到606.15 cm2。SPAD的增幅为27.42%~70.85%,1R:1B处理下的SPAD最小为23.47,4R:1B处理下的SPAD最大为31.47。干物质含量的增幅为5.62%~37.27%,2R:1B处理下的干物质含量最小为4.86%,1R:4B处理下的干物质含量最大为6.31%。比叶重的增幅为12.80%~44.09%,2R:1B处理下的比叶重最小为2.44 mg·cm-2,1R:4B处理下的比叶重最大为3.11 mg·cm-2。可见,采前LED连续光照光质的红光比例越高,生菜的叶面积和SPAD越高;采前LED连续光照光质的红光比例越低,生菜的干物质含量和比叶重越高。
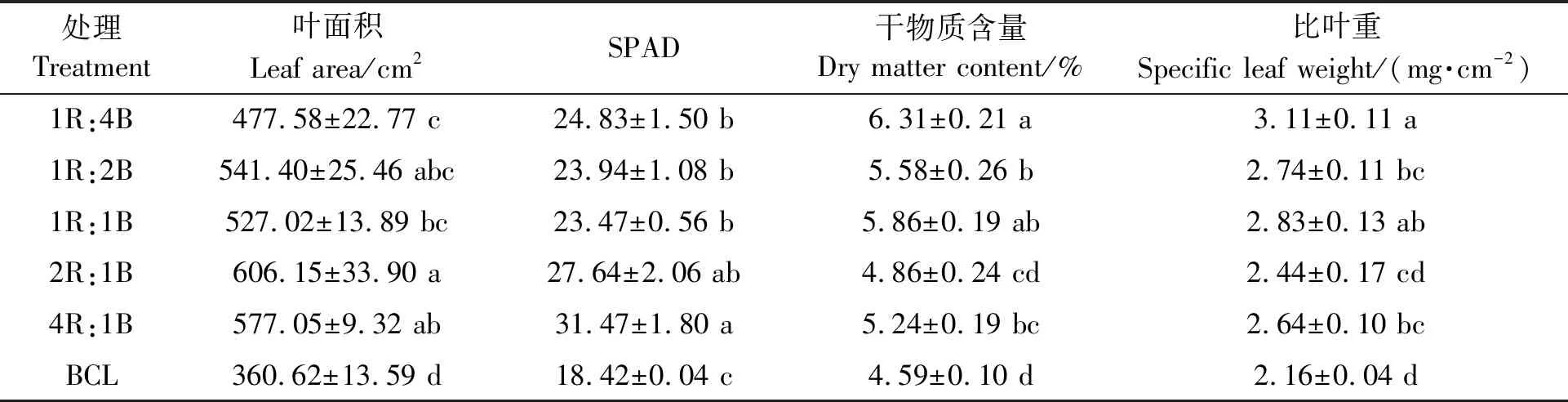
表2 不同处理下的生菜生长指标Table 2 Growth index of lettuce under different treatments
2.2 采前不同比例LED连续光照对生菜光合特性的影响
采前LED连续光照光质对生菜叶片的光合特性具有显著影响。由表3可知,与连续光照前(BCL)相比,生菜叶片的净光合速率(Pn)的变化幅度为-35.11%~62.00%,采前LED连续光照处理后,4R:1B处理下,生菜叶片的Pn有所降低,为7.65 μmol·m-2·s-1,1R:4B处理下生菜叶片的Pn最高达到19.10 μmol·m-2·s-1。生菜叶片的气孔导度(Gs)的降低幅度为26.97%~62.34%,采前LED连续光照处理后,1R:1B处理下生菜叶片的Gs最低为0.148 mol·m-2·s-1,1R:4B处理下生菜叶片的Gs最高达到0.287 mol·m-2·s-1。生菜叶片的胞间CO2浓度(Ci)的降低幅度为9.68%~24.97%,采前LED连续光照处理后,1R:1B处理下生菜叶片的Ci最低为252.69 μmol·mol-1,1R:4B处理下生菜叶片的Ci最高达到304.18 μmol·mol-1。生菜叶片的蒸腾速率(Tr)的降低幅度为34.15%~58.74%,采前LED连续光照处理后,1R:1B处理下生菜叶片的Tr最低为2.03 mmol·m-2·s-1,1R:4B处理下生菜叶片的Tr最高达到3.24 mmol·m-2·s-1。

表3 不同处理下的生菜光合特性Table 3 Photosynthetic characteristics of lettuce under different treatments
2.3 采前不同比例LED连续光照对生菜可溶性糖和硝酸盐含量的影响
由表4可得,与BCL相比,采前72 h进行LED连续光照处理后,生菜的可溶性糖含量不同程度的升高,硝酸盐含量不同程度的降低。叶片的可溶性糖含量增加幅度为1.46%~47.17%,1R:2B处理下叶片的可溶性糖含量最低为17.38 mg·g-1,4R:1B处理下叶片的可溶性糖含量最高达到25.21 mg·g-1。叶柄的可溶性糖含量增加幅度为26.08%~67.36%,1R:2B处理下叶柄的可溶性糖含量最低为32.68 mg·g-1,4R:1B处理下叶柄的可溶性糖含量最高达到43.38 mg·g-1。叶片的硝酸盐含量降低幅度为4.94%~28.24%,4R:1B处理下叶片的硝酸盐含量最低为256.91 mg·kg-1,1R:2B处理下叶片的可溶性糖含量最高为340.34 mg·kg-1。采前LED连续光照处理后,叶柄的硝酸盐含量降低幅度为6.96%~24.71%,2R:1B处理下叶柄的硝酸盐含量最低为371.51 mg·kg-1,1R:1B处理下叶柄的可溶性糖含量最高为459.08 mg·kg-1。可见,采前LED连续光照光质红光比例越高,生菜叶片和叶柄的可溶性糖含量越高,生菜叶片的硝酸盐含量越低。
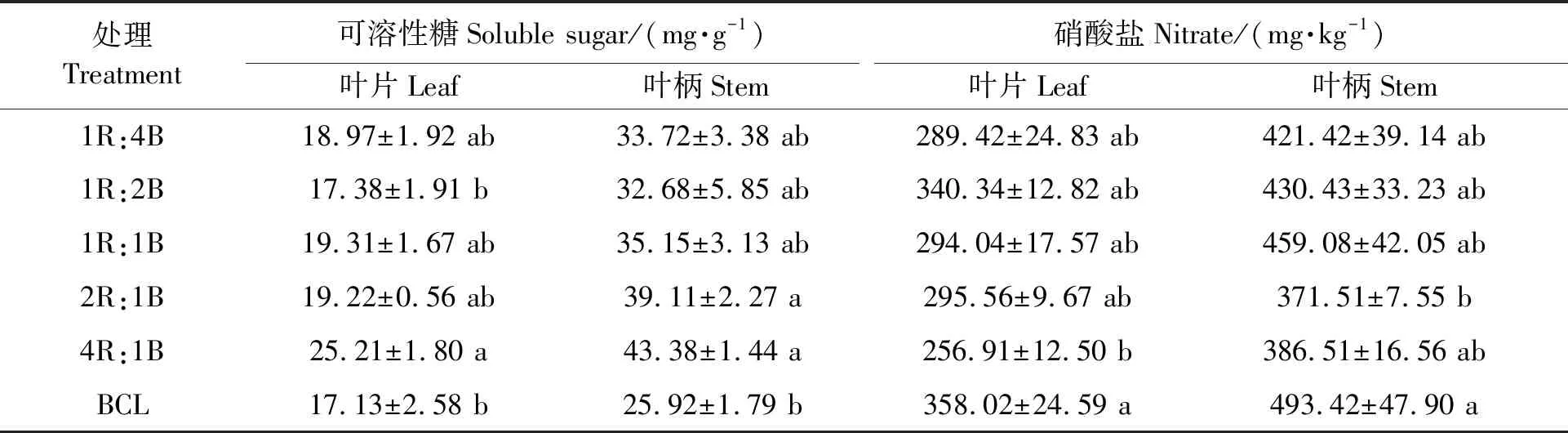
表4 不同处理下的生菜可溶性糖和硝酸盐含量Table 4 Contents of soluble sugar and nitrate in lettuce under different treatments
2.4 采前不同比例LED连续光照对生菜AsA代谢的影响
2.4.1对生菜AsA和DHA含量的影响 由表5可知,与BCL相比,采前72 h进行LED连续光照处理后,生菜的AsA含量有所升高。其中,叶片的AsA含量的增加幅度为25.15%~92.81%,4R:1B处理下叶片的AsA含量最低为2.09 mg·g-1,1R:4B处理下叶片的AsA含量最高达到3.22 mg·g-1。叶柄的AsA含量变化无显著差异。叶片的DHA含量增加幅度为61.90%~204.76%,叶柄的DHA含量降低幅度为47.83%~52.17%,但采前LED连续光照后,各光质处理间叶片和叶柄的DHA含量均无显著差异。可见,采前LED连续光照光质蓝光比例越高,生菜的AsA含量越高,采前LED连续光照光质对叶柄的AsA和DHA含量无显著影响。
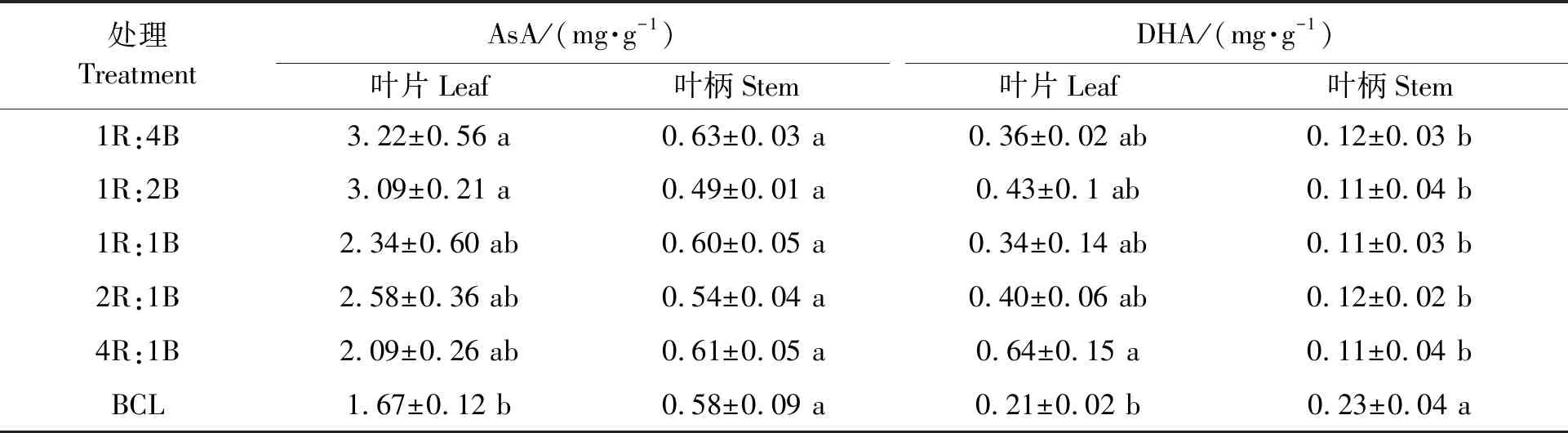
表5 不同处理下的生菜AsA和DHA含量Table 5 Contents of AsA and DHA in lettuce under different treatments
2.4.2对生菜GalLDH酶活性的影响 由表6可得,采前LED连续光照光质对叶片的GalLDH酶活性具有显著影响。与连续光照前(BCL)相比,采前LED连续光照后,叶片的GalLDH酶活性的变化幅度为-65.58%~5.56%,相比于连续光照前,仅有4R:1B处理下的叶片GalLDH酶活性略高于连续光照前的,达到0.281 U·mg-1FW。其他处理下叶片GalLDH酶活性均低于连续光照前的,1R:4B处理下叶片的GalLDH酶活性最低为0.092 U·mg-1FW。采前LED连续光照光质处理对叶柄的GalLDH酶活性无显著影响。采前LED连续光照光质红光比例越高,叶片的GalLDH酶活性越高。
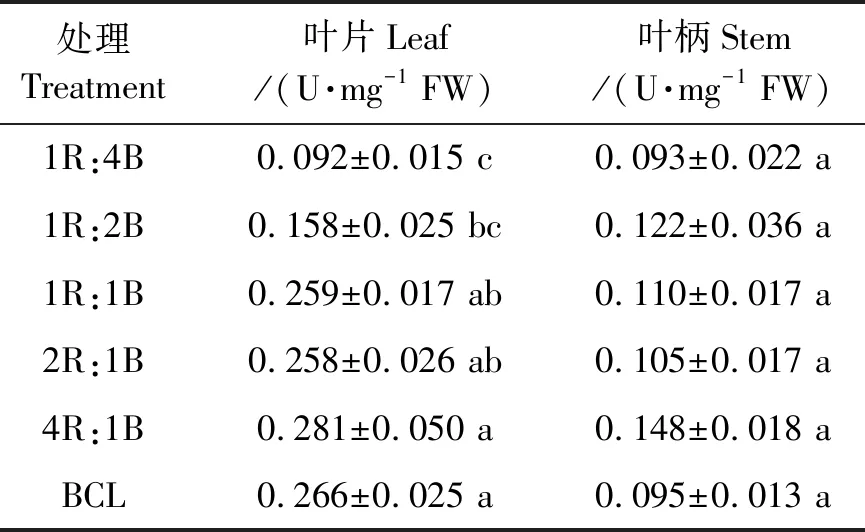
表6 不同处理下的生菜GalLDH酶活性Table 6 Activity of GalLDH in lettuce under different treatments
2.4.3对生菜AsA代谢相关酶活性的影响 由表7可知,采前LED连续光照前(BCL),生菜叶片的APX酶活性为0.28 U·mg-1FW,72 h 连续光照后,1R:4B和1R:2B处理下的生菜叶片APX酶活性显著增加,均增加了0.16 U·mg-1FW。生菜叶片的MDHAR酶活性在采前LED连续光照前为0.11 U·mg-1FW,72 h 连续光照后,1R:4B处理下的生菜叶片MDHAR酶活性显著增加,增加了0.81 U·mg-1FW。相比于采前LED连续光照前,生菜叶片的DHAR和GR酶活性在72 h连续光照后均有所增加,但无显著差异。生菜叶柄中APX、MDHAR、DHAR和GR的酶活性在72 h 连续光照后均无显著差异。可见,采前LED连续光照光质只对生菜叶片的APX和MDHAR具有显著影响。采前LED连续光照光质红光比例越大,对APX和MDHAR的影响越小。各处理间叶柄的AsA代谢相关酶活性均无显著影响。
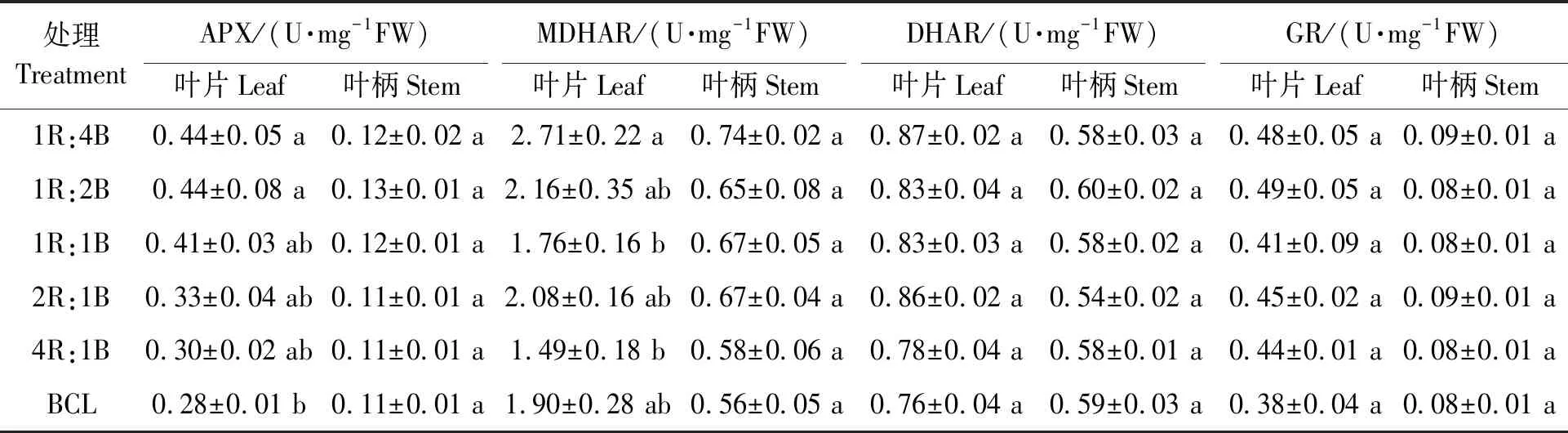
表7 不同处理下的生菜AsA代谢相关酶活性Table 7 Activities of AsA metabolism related enzymes in lettuce under different treatments
3 讨论
本研究结果表明,采前LED连续光照后生菜地上部鲜重和干重均显著增加,连续光照的红光比例越低,产量越低。这是因为红光是被绿色植物吸收最多的光,红光通过光敏色素在调控光形态建成上发挥作用,可以促进茎伸长,促进碳水化合物合成,使得植物生长更快,促进植物产量的增加,采前连续光照红光比例降低导致生菜的产量降低。同时红光有利于糖的合成,抑制氮的同化作用[21]。这也解释了本研究中的结果,随着连续光照红光比例的增大,生菜的可溶性糖含量增加,硝酸盐的含量略微减少。
周晚来[14]研究了光强150 μmol·m-2·s-1下,红蓝光质比例分别为8、4、2和纯红光下的采前连续光照对AsA含量的影响,结果发现,采前连续光照的蓝光比例越高,越有利于AsA含量的增加。本研究继续增加蓝光在采前连续光照时的比例,结果发现,随采前连续光照蓝光比例的升高,叶片AsA含量逐渐增加,叶片DHA含量逐渐降低。GalLDH是催化AsA合成的关键酶,在AsA的合成上起着很大的作用[8]。本研究结果表明,随着连续光照蓝光比例的升高,叶片中GalLDH活性逐渐降低。因此,采前LED连续光照光质对生菜叶片GalLDH活性的影响与抗坏血酸含量变化相反。本研究结果表明,叶片APX酶活性随连续光照蓝光比例的升高而增大,与AsA含量的变化趋势一致,说明连续光照蓝光比例越高,APX酶活性越高,催化分解AsA的量越多。Eltayeb等[22]研究发现,转基因番茄中MDHAR的高效表达提高了转化为AsA的效率,降低MDHAR转化为DHA的比率。叶片MDHAR酶活性随连续光照蓝光比例的升高而增大,与AsA含量的变化趋势一致,说明连续光照蓝光比例越高,MDHAR酶活性越高,催化分解为DHA那部分的MDHA转化合成AsA的量越多。Chen等[5]研究发现,植物体内DHAR基因高效表达会通过加快AsA再生循环来增加AsA的含量,这促进了转化为2,3-二酮古洛糖酸的DHA转化为AsA的比例。这与Matsuda等[23]的研究结果一致。本研究中连续光照光质对叶片DHAR酶活性影响不显著,但叶片DHAR酶活性随连续光照蓝光比例的升高而略微增大,与AsA含量的变化趋势一致,说明连续光照蓝光比例越高,DHAR酶活性越高,催化分解为2,3-二酮古洛糖酸那部分DHA转化合成AsA的量越多,但DHAR在连续光照下对AsA升高的贡献有限[24]。可见,连续光照光质对AsA含量的影响主要是与参与AsA再生循环系统的MDHAR酶活性相关,可能与DHAR酶活性相关。
综上所述,采前连续光照光质对水培生菜产量及品质的调控效果有显著影响。随着采前连续光照红光比例的升高,水培生菜的产量会逐渐升高,且可溶性糖含量逐渐升高。AsA含量随采前连续光照蓝光比例的增大而增加,这是AsA合成和再生循环系统综合调控的结果,主要是因为蓝光比例的增大提高了参与AsA再生循环系统的MDHAR酶活性,促进了MDHA转化为AsA的效率。

