利用基因芯片技术筛选氧化应激介导的阿尔茨海默病相关miRNAs并验证
姜磊 张睿 马笑影 高肇妤 崔冬生 许顺江
(河北医科大学第一医院中心实验室 河北省脑科学与精神心理疾病重点实验室,河北 石家庄 050000)
miRNAs是一类长度为20~24个核苷酸的内源性非编码小RNA,主要在转录后水平调控基因表达〔1〕。miRNAs在阿尔茨海默病(AD)等神经退行性疾病的发生发展中具有重要的调控作用〔2〕,且miRNAs可能作为AD诊断的标志及治疗的新靶点〔3〕。miRNA芯片能够克服单基因研究的缺点,在功能基因组学研究中有广泛的用途,从整体上分析细胞或组织之间的差异。本实验通过miRNA芯片技术,分别筛选原代培养的海马神经元和氧化应激的海马神经元及正常老化小鼠(SAMR1)和速老化小鼠(SAMP8)海马组织差异表达的miRNAs,并对这些miRNAs进行qPCR验证及生物信息学分析。
1 材料与方法
1.1实验材料 3月龄SAMR1和3月龄SAMP8购自北京大学医学部动物中心。两种小鼠饲养于河北医科大学第四医院动物中心。本实验所有操作程序经河北医科大学第一医院伦理委员会批准。DMEM/F12培养基、胎牛血清、B27均购于美国Invitrogen公司。H2O2、胰蛋白酶、左旋多聚赖氨酸、Hoechst33258购于美国SIGMA公司。甲臜化合物(MTS)购于美国Promega公司。微管相关蛋白(MAP)-2一抗购于美国BD公司。驴抗鼠荧光二抗购于美国Abbkine公司。miRcute miRNA 提取分离试剂盒、miRcute miRNA cDNA第一链合成试剂盒和miRcute miRNA荧光定量检测试剂盒购于中国TIANGEN公司。
1.2实验方法
1.2.1细胞培养 使用75%乙醇浸泡消毒整个SAMR1新生鼠后,放入超净工作台的弯盘中断头取脑,在磷酸盐缓冲液(PBS)中快速分离海马组织。将剔除脑膜和血管的海马组织剪成1 mm3左右的碎块。向碎块中加入0.125% 胰酶,37℃作用10 min。加入含20%胎牛血清(FBS)的DMEM/F12培养基终止胰蛋白酶消化。接着加入含20% FBS的DMEM/F12培养基制成密度为1×106个/ml的细胞悬液,并放入由0.1 g/L多聚懒氨酸包被的培养皿中。细胞在95% 湿度和5% CO2培养箱中孵育。细胞贴壁后,将培养基换成含2% B27的neurobasal培养基,接着每3 d半量换液孵育7 d。
1.2.2免疫细胞化学 用4%多聚甲醛固定体外培养7 d的海马神经元,使用0.3% TritonX-100改变细胞膜的通透性,用3%牛血清白蛋白(BSA)封闭非特异性抗原。加入MAP-2(1∶200)一抗,4℃孵育过夜,PBS清洗。加入TRITC标记的荧光二抗,室温孵育1 h。使用Hoechst33258复染核。使用荧光显微镜拍照。计算MAP-2阳性细胞占所有细胞的比率,确定细胞纯度。
1.2.3MTS法检测海马神经元的相对存活率 接种于96孔板中培养7 d的原代海马神经元,加入不同浓度H2O2(0、100、200、400和800 μmol/L)处理24 h后,每孔加入20 μl MTS试剂,在37℃、5% CO2的环境下孵育4 h。在酶标仪490 nm波长下读取吸光度值。细胞存活率(%)=〔(As-Ab)/(Ac-Ab)〕×100%(As为实验孔:含细胞的培养基+MTS+H2O2;Ab为空白孔:完全培养基+MTS;Ac为对照组:含细胞的培养基+MTS)。计算不同组别细胞存活率,实验均重复3次,取其均值。
1.2.4miRNAs表达谱分析 使用miRcute miRNA 提取分离试剂盒提取200 μmol/L H2O2处理的原代海马神经元和未经H2O2处理的原代海马神经元及3月龄SAMP8和3月龄SAMR1海马组织总RNA(步骤按照说明书进行)。使用Nanodrop1000分光光度计对提取的总RNA进行定量。使用Affymetrix miRNAs芯片 GeneChip miRNAs 2.0 Array分析miRNAs的表达。
1.2.5实时定量PCR 使用miRcute miRNA 提取分离试剂盒提取200 μmol/L H2O2处理的海马神经元和未经H2O2处理的海马神经元及3月龄SAMP8和3月龄SAMR1海马组织总miRNAs。使用miRcute miRNA cDNA第一链合成试剂盒进cDNA的合成,使用miRcute miRNA荧光定量检测试剂盒进行qPCR检测,以miRNA-U6作为内参。实验步骤按照说明书进行:95℃预变性10 min,95℃变性10 s,60℃退火30 s,72℃延伸15 s,40个循环。反应产物经溶解曲线检测特异性。
1.2.6生物信息学分析 使用miRDB数据库(http://www.mirdb.org/)和Targetscan(http://www.targetscan.org/vert_72/)数据库预测两组芯片共表达的差异miRNAs的靶基因,取其合集,并利用DAVID生物信息学数据库对预测的靶基因进行基于基因功能聚类(GO) 的功能富集分析及基于京都基因与基因组百科全书(KEGG)的生物通路富集分析(P<0.05),错误发现率(FDR)<0.001视为有价值)。
1.3统计学分析 以U6作为内参,采用2-ΔΔCT法计算miRNA的表达。采用GraphPad Prism version 5.0和Excel进行作图。采用SPSS17.0软件进行t检验,方差分析,SNK-q检验。
2 结 果
2.1H2O2处理浓度依赖地抑制海马神经元的存活率 免疫荧光染色结果显示,原代培养的海马神经元纯度大于95%。细胞胞体饱满,突起粗大相互交织成网络状,说明海马神经元处于最佳状态,适用于实验(图1)。用不同浓度(0、100、200、400、800 μmol/L)的H2O2刺激海马神经元24 h,MTS结果显示,海马神经元存活率分别为(100.0±2.8)%、(89.6±4.8)%、(66.6±6.3)%、(60.0±4.9)%、(39.8±7.1)%。其中200 μmol/L 的H2O2处理海马神经元24 h后,存活率显著降低(P<0.01)。因此,在后续实验中,以200 μmol/L H2O2诱导海马神经元制备体外氧化应激模型。
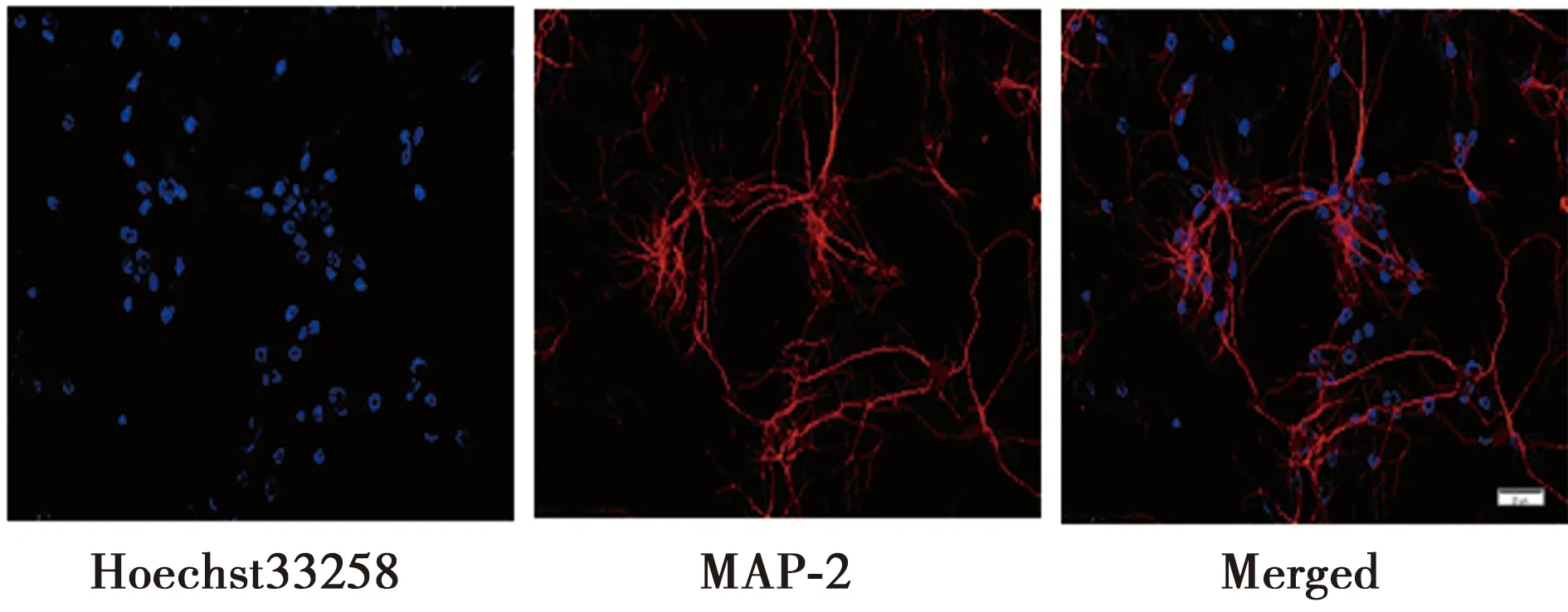
图1 免疫细胞染色分析原代海马神经元纯度
2.2氧化应激介导的AD相关miRNAs的筛选 miRNA芯片分析结果显示,与原代培养的海马神经元相比,氧化应激的海马神经元中101个miRNAs表达改变,其中64 个表达上调,37个表达下调。与SAMR1鼠相比,SAMP8鼠海马组织中294个miRNAs表达改变,其中131个表达上调,163个表达下调。其中有6个差异表达的miRNAs (miR-296、miR-20a、miR-329、miR-193b、miR-130b和miR-24)在体外氧化应激的海马神经元和SAMP8鼠海马组织中表达的miRNAs中表达均上调,而miR-376b则在两种模型基因芯片结果中表达均下调。
2.3氧化应激介导的AD相关miRNAs的表达 与对照组相比,200 μmol/L H2O2处理的海马神经元中miR-329(1.024±0.256 vs 2.244±0.742,P<0.05)、miR-193b(1.011±0.176 vs 3.611±0.329,P<0.01)、miR-20a(1.009±0.165 vs 3.470±0.297,P<0.01)、miR-296(1.023±0.235 vs 4.127±0.735,P<0.01)、miR-130b(1.003±0.083 vs 2.238±0.733,P<0.05)和miR-24(1.012±0.173 vs 2.508±0.355,P<0.01)表达量明显上升,miR-376b(1.019±0.228 vs 0.448±0.062,P<0.01)表达量明显下降。与SAMR1比较,SAMP8海马组织miR-329(1.021±0.238 vs 2.562±0.839,P<0.05)、miR-193b(1.033±0.308 vs 2.369±0.253,P<0.01)、miR-20a(1.007±0.147 vs 3.098±0.550,P<0.01)、miR-296(1.017±0.208 vs 1.817±0.225,P<0.01)、miR-130b(1.010±0.166 vs 2.449±0.508,P<0.01)和miR-24(1.005±0.113 vs 2.185±0.842,P<0.05)表达量明显上升,miR-376b(1.008±0.142 vs 0.385±0.107,P<0.01)表达量明显下降。Real-time PCR 结果与miRNA芯片结果一致。
2.4差异表达miRNAs靶基因的GO富集分析和KEGG分析 miRDB数据库和Targetscan数据库预测显示两组芯片共同表达的差异miRNAs共调控1 443个靶基因。GO富集分析结果显示,这些靶基因主要参与细胞核的组成、蛋白质的结合和DNA转录调控(图2)。将预测的靶基因向KEGG数据库映射,结果显示这些靶基因可能参与神经发育、MAPK信号通路和内吞作用等(图3)。

图2 差异表达 miRNAs靶基因的GO分析
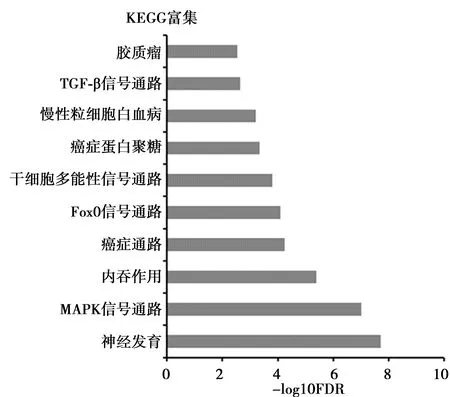
图3 差异表达 miRNAs靶基因的KEGG分析
3 讨 论
60岁以上的老年人中AD的发病率可高达2%~3%〔4,5〕。目前认为,氧化应激是公认的AD的发病机制之一,在AD的整个病程进展中中枢神经系统均暴露于氧化应激条件下。Feng等〔6〕发现氧化应激不仅直接参与了AD的发病,更重要的是通过级联酶促反应放大了AD神经变性的发生。此外,氧化应激在AD发病和进展过程中可导致基因表达失调。其中包括miRNAs在内的非编码RNA,在AD等中枢神经系统退行性疾病的发病过程中的调控作用逐渐成为近年来的研究热点〔7,8〕。miRNAs主要通过调节其下游靶基因的方式,在AD的发病中发挥作用〔9〕。梁厚成等〔10〕发现,氧化损伤引起视网膜色素上皮细胞中 miR-31等17个miRNAs的表达随H2O2浓度升高呈逐渐降低的趋势。Ansari等〔11〕发现,miR-146a和miR-181a参与轻度认知障碍和AD的发生发展。
共表达可能来源于共调节,共表达分析可为研究不同miRNAs功能提供更重要的信息。SAMP8主要特征表现为与衰老相关的学习记忆障碍,具有β-淀粉样蛋白(Aβ)沉积、脑萎缩生等病理变化,并且在行为学、神经递质及分子水平方面均表现出一定的衰老变化,是目前研究脑老化理想的动物模型〔12〕。研究发现,SAMP8在4月龄时出现Tau蛋白异常磷酸化和Aβ沉积,7月龄时出现严重的认知功能受损,因此以SAMP8作为AD动物模型〔13〕。而利用H2O2处理细胞制备的体外模型已被广泛应用氧化应激机制研究。本研究将动物模型和体外细胞模型结合起来分析共同表达的差异miRNAs,能更精确筛选出与氧化应激相关,并在AD的发生与发展中具有重要作用的miRNAs。有研究表明,miR-130b、miR-20a、miR-24和miR-329均对脑的发育和神经元的分化具有重要的调节作用〔14~17〕。同样,本研究发现,氧化应激和AD动物模型海马组织中miR-130b、miR-20a、miR-24、和miR-329均表达上调。刘辰庚等〔18〕发现在AD患者和轻度认知障碍患者血清外吐小体中miR-193b的表达较对照组降低。其结果与本研究中miR-193b在氧化应激和AD动物模型海马组织中表达上调的结果不符,可能由于标本来源不同所致。此外,本研究筛选出的差异miR-296和miR-376b尚未见其在氧化应激、衰老和神经元变性疾病中发挥作用的报道。研究显示,在AD患者脑神经元中表达下降的基因数目是表达上升基因数目的3倍〔19〕。由于miRNAs主要在转录后水平调控基因表达,因此上述AD患者脑神经元中表达下降的基因可能受某些上调miRNAs的调控。本研究筛选出的两组芯片共同表达改变的miRNAs以上调表达为主,因此,推测这些上调miRNAs通过下调某些基因表达参与AD的发生发展。通过GO和pathway功能分析发现两组芯片共同表达改变的miRNAs靶基因可能参与细胞核的组成、蛋白质的结合和DNA转录调控等多个生物学过程,并通过神经发育、p38丝裂原活化蛋白激酶(MAPK)信号通路和内吞作用等通路进行调节。为阐明共同表达改变miRNAs的生物学功能及可能的通路提供有价值的信息。在AD发病中的作用机制提供实验依据。

