基于ROS/NLRP3/Caspase-1通路的鹿芪方对慢性心力衰竭小鼠心肌细胞焦亡的影响
张晓青,瞿惠燕,赵丹丹,杨晓利,兰真真,杨涛,周华
基于ROS/NLRP3/Caspase-1通路的鹿芪方对慢性心力衰竭小鼠心肌细胞焦亡的影响
张晓青,瞿惠燕,赵丹丹,杨晓利,兰真真,杨涛,周华
上海中医药大学附属曙光医院,上海中医药大学附属曙光医院心血管研究所,上海 201203
观察鹿芪方对慢性心力衰竭小鼠心肌细胞焦亡的影响,从ROS/NLRP3/Caspase-1通路探讨其作用机制。60只C57BL/6J小鼠随机分为假手术组、模型组、鹿芪方组、培哚普利组,采用冠状动脉前降支结扎法制备慢性心力衰竭小鼠模型。鹿芪方组和培哚普利组分别予相应药液灌胃,假手术组和模型组予等量生理盐水灌胃,连续6周。超声检测小鼠心功能,HE染色、Masson染色检测小鼠心肌组织病理变化和胶原纤维沉积,DHE荧光探针检测心肌组织活性氧(ROS)含量,Western blot检测心肌组织NLRP3、ASC、Caspase-1蛋白表达,免疫组化检测白细胞介素(IL)-1β表达,透射电镜观察心肌组织超微结构。与假手术组比较,模型组小鼠左室射血分数(LVEF)和左室收缩分数(LVFS)降低,左室舒张末期内径(LVIDd)与左室收缩末期内径(LVIDs)升高;心肌细胞明显增大,排列不规则,有较多炎性细胞聚集及胶原纤维沉积;心肌组织ROS含量增加,NLRP3、ASC、Caspase-1蛋白及IL-1β表达升高,差异均有统计学意义(<0.01)。与模型组比较,鹿芪方组与培哚普利组小鼠LVEF和LVFS升高,LVIDd和LVIDs降低;心肌细胞损伤改善,胶原纤维沉积明显减少,心肌纤维化明显减轻;心肌组织ROS含量减少,NLRP3、ASC、Caspase-1蛋白及IL-1β表达降低,差异均有统计学意义(<0.01)。鹿芪方能有效减轻慢性心力衰竭小鼠心肌细胞焦亡,其机制可能与抑制ROS/NLRP3/Caspase-1通路活化,减轻心肌炎症反应相关。
鹿芪方;活性氧;NLRP3;炎性小体;心力衰竭;小鼠
慢性心力衰竭(chronic heart failure,CHF)因其较高的发病率和死亡率,始终是心血管疾病研究领域的热点与难点[1-2]。细胞焦亡是由Caspase-1介导的程序性细胞死亡,不同于细胞凋亡、坏死,细胞焦亡时细胞内容物释放,引起强烈的炎症反应,因此又称细胞炎性坏死[3]。心肌梗死后,早期的炎症反应对清除坏死的细胞和组织碎片至关重要,但过度的炎症反应会加剧心肌梗死后的炎症级联反应,不利于瘢痕组织愈合,最终导致心力衰竭[4]。研究表明,在心力衰竭患者心肌组织中,NLRP3、Caspase-1等焦亡关键蛋白表达升高[5-6]。Han等[7]通过缺氧心肌细胞模型发现,长链非编码RNA H19过表达可抑制NLRP3、Caspase-1表达,减轻心肌细胞焦亡。因此,抑制ROS/NLRP3/Caspase-1通路活化,减少心肌细胞焦亡可能是治疗心力衰竭的有效方法之一。
鹿芪方为周华教授治疗CHF的经验方,具有益气温阳、活血利水功效。课题组前期研究发现,鹿芪方可促进心肌细胞自噬,改善心肌能量代谢,增强心肌细胞抗凋亡能力[8-9]。基于此,本实验基于ROS/ NLRP3/Caspase-1信号通路观察鹿芪方对CHF小鼠心肌细胞焦亡的影响。
1 实验材料
1.1 动物
SPF级雄性C57BL/6J小鼠60只,8周龄,体质量(20±2)g,购于上海斯莱克实验动物有限责任公司,动物许可证号SYXK(沪)2020-0009,饲养于上海中医药大学实验动物中心SPF级动物房,自由摄食饮水。实验方案经上海中医药大学实验研究伦理委员会批准(PZSHUTCM200807012)。动物饲养及处理过程严格按照《实验动物管理和使用指南》[10]进行。
1.2 药物及制备
鹿芪方(鹿角片9 g,红花9 g,黄芪30 g,党参30 g,桂枝9 g,葶苈子20 g),饮片由上海中医药大学附属曙光医院中药房提供,并制成中药免煎颗粒,使用时配制成68 mg/mL混悬液。培哚普利片,施维雅(天津)制药有限公司,批号2017106,配制成浓度为60.7 μg/mL溶液。
1.3 主要试剂与仪器
HE染色试剂盒(上游碧云天科技有限公司,货号C0105S),Masson染色试剂盒(安徽雷根生物,货号DC0032),异氟烷(上海玉研科学仪器有限公司),BCA蛋白浓度测定试剂盒(赛默飞生物,货号P0012),兔抗小鼠NLRP3抗体(美国CST,货号15101S),ASC抗体(美国CST,货号67824S),Caspase-1抗体(英国Abcam,货号ab179515),白细胞介素(IL)-1β抗体(美国Santa Cruz,货号sc-12742),GAPDH抗体(美国Bioworld,货号AP0066),HRP标记山羊抗兔IgG(美国CST,货号7074),ECL发光液(上海天能,货号180-501)。彩色多普勒超声诊断系统(美国GE,VIVID5),多功能酶标仪(美国BioTek,Cytation 3),倒置显微镜(日本Nikon,Eclipse Ts2R),垂直式蛋白电泳槽(美国Bio-Rad,165-8004),湿转膜仪(美国Bio-Rad,170-3930),化学发光成像系统(上海天能,4600SF),电泳及转膜电源仪(美国Bio-Rad,Universal)。
2 实验方法
2.1 分组、造模及给药
60只小鼠随机分为假手术组、模型组、鹿芪方组和培哚普利组,每组15只。除假手术组外,其余各组小鼠行冠状动脉前降支(LAD)结扎术。小鼠气体麻醉机下麻醉,脱毛剂去除颈前及左胸部毛发,暴露手术区,酒精消毒,于第3、4肋间打开胸腔充分暴露心脏,用直镊夹起少量心包并于左心耳下撕开少许心包,迅速挤压出心脏,用7-0带线缝合针于左心耳下缘2 mm处进针,穿过LAD,以完全阻断LAD血流。结扎后迅速将心脏复位,并用5-0带线缝合针缝皮,心电图ST段抬高表明造模成功。假手术组仅开胸、穿线不结扎。按人与小鼠体表面积换算等效剂量,鹿芪方组和培哚普利组分别予予鹿芪方0.68 g/kg、培哚普利0.607 mg/kg灌胃,假手术组和模型组予等体积生理盐水灌胃。给药体积0.2 mL,连续6周。
2.2 心功能检测
小鼠麻醉后,行超声观察,计算心脏左室射血分数(LVEF)、左室收缩分数(LVFS)、左室舒张末期内径(LVIDd)、左室收缩末期内径(LVIDs)。
2.3 心肌组织病理观察
取小鼠心肌组织,石蜡包埋后切片(5 µm),梯度乙醇脱蜡,行HE染色,中性树胶封片后显微镜下观察。另取心肌组织石蜡切片,梯度乙醇脱蜡,Weigert铁苏木素染色10 min;乙酸分化液分化水洗,Masson蓝化液返蓝,水洗;丽春红酸性品红染色液染5 min,弱酸工作液洗1 min;磷钼酸溶液洗2 min,弱酸工作液洗1 min;苯胺蓝染液复染2 min,弱酸工作液复洗1 min,脱水后中性树胶封片。光镜下观察并拍照,采用图像分析软件Image J 1.41进行测定,计算心肌纤维化面积。心肌纤维化面积(%)=胶原纤维沉积面积÷视野总面积×100%。
2.4 心肌组织活性氧检测
心肌组织OCT包埋后行冰冻切片(5 μm),4%多聚甲醛室温固定5 min,纯水洗涤3次,每次30 s;DHE工作液室温染色5~20 min,纯水洗涤3次,每次1 min,甘油封片。荧光显微镜下观察并拍照。采用Image J 1.41分析荧光强度。ROS阳性率(%)=红色荧光细胞数目÷细胞总数×100%。
2.5 Western blot检测小鼠心肌组织NLRP3、ASC、Caspase-1蛋白表达
取20 mg小鼠心肌组织,加入200 μL RIPA裂解液,匀浆机研磨90 s,BCA法测定蛋白浓度,95 ℃煮10 min使蛋白变性;SDS-PAGE后,转至PVDF膜,5%脱脂奶粉封闭1 h;按1∶1 000加入NLRP3、ASC、Caspase-1一抗,4 ℃孵育过夜;TBST洗膜3次,每次10 min;加入HRP标记二抗,室温孵育1 h;TBST洗膜3次,每次10 min;滴加ECL发光液(A液、B液按1∶1混匀),化学发光成像系统曝光,以GAPDH为内参,计算目的蛋白相对表达量。
2.6 免疫组化检测心肌组织白细胞介素-1β表达
取心肌组织石蜡切片,梯度乙醇脱蜡,柠檬酸钠抗原修复,去除内源性过氧化物酶;10%BSA室温封闭1 h,滴加IL-1β(1∶100)一抗,4 ℃孵育过夜;二抗室温孵育1 h,DAB显色,苏木素染色30 s,流水冲洗5 min,梯度乙醇脱水,中性树胶封片。使用Image J 1.41软件分析IL-1β表达的平均光密度。
2.7 透射电镜观察心肌组织超微结构
心肌组织置于2.5%戊二醛中固定2 h,缓冲液清洗3次,每次10 min;1%锇酸固定,缓冲液清洗;梯度乙醇脱水,丙酮浸透;包埋液浸透1.5 h,37 ℃包埋12 h,60 ℃包埋48 h;行超薄切片,使用醋酸双氧铀-柠檬酸铅双染法染色,透射电子显微镜观察。
3 统计学方法
4 结果
4.1 鹿芪方对模型小鼠心功能的影响
与假手术组比较,模型组小鼠LVEF和LVFS显著降低,LVIDd和LVIDs显著升高(<0.01);与模型组比较,各给药组小鼠LVEF和LVFS显著升高,LVIDd和LVIDs显著降低(<0.01)。结果见图1。

注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
4.2 鹿芪方对模型小鼠心肌组织病理形态的影响
假手术组小鼠心肌纤维束排列整齐,无胶原纤维沉积;与假手术组比较,模型组小鼠心肌细胞形态明显增大,排列不规则,有较多炎性细胞聚集及胶原纤维沉积;与模型组比较,鹿芪方组及培哚普利组小鼠心肌损伤明显改善,胶原纤维沉积明显减少,心肌纤维化明显减轻。结果见图2、图3。
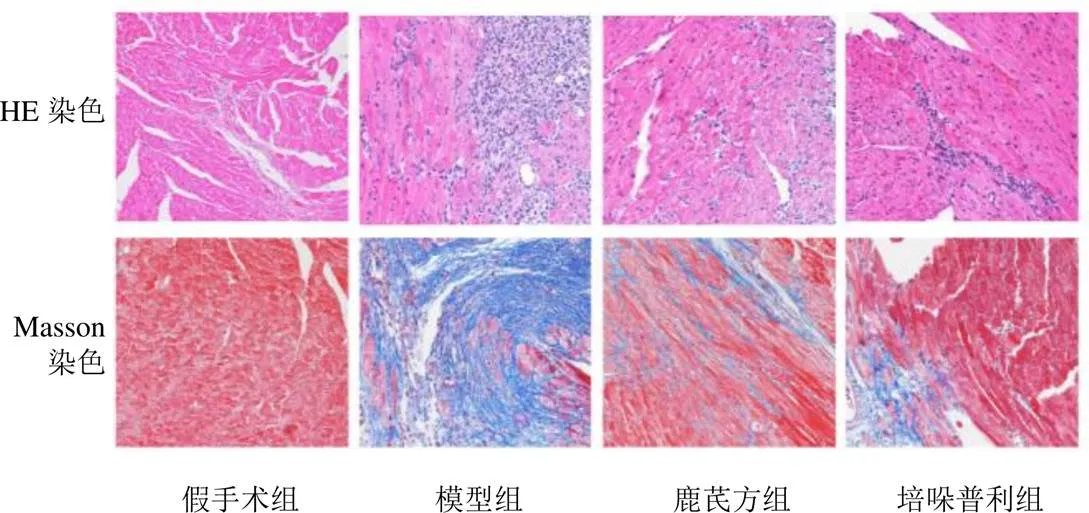
图2 各组小鼠心肌组织形态(×200)
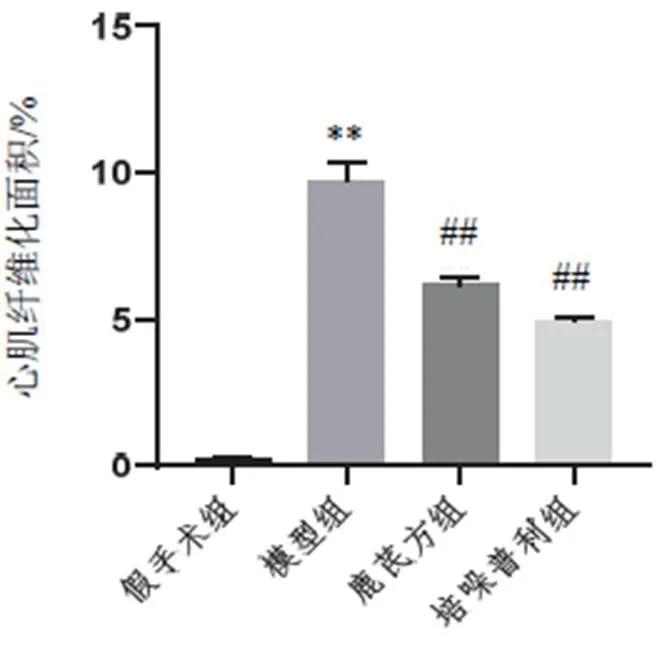
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
4.3 鹿芪方对模型小鼠心肌组织活性氧含量的影响
与假手术组比较,模型组小鼠心肌组织ROS含量明显增加(<0.01);与模型组比较,各给药组小鼠心肌组织ROS含量明显减少(<0.01)。结果见图4、图5。
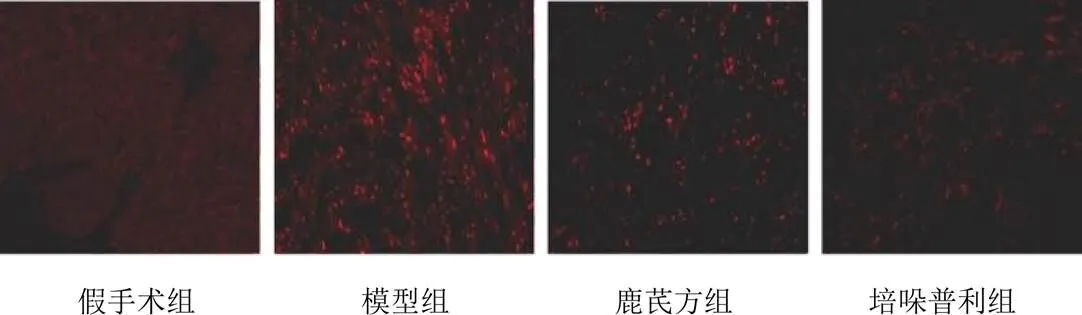
图4 各组小鼠心肌组织ROS表达(DHE荧光探针,×200)
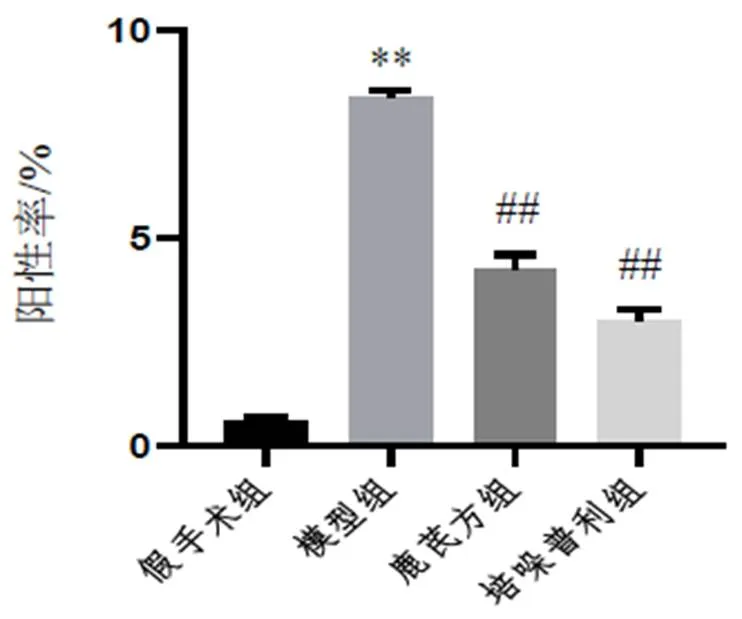
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
4.4 鹿芪方对模型小鼠心肌组织NLRP3、ASC、Caspase-1蛋白表达的影响
与假手术组比较,模型组小鼠心肌组织NLRP3、ASC、Caspase-1蛋白表达显著升高(<0.01);与模型组比较,各给药组小鼠心肌组织NLRP3、ASC、Caspase-1蛋白表达显著降低(<0.01)。结果见图6。
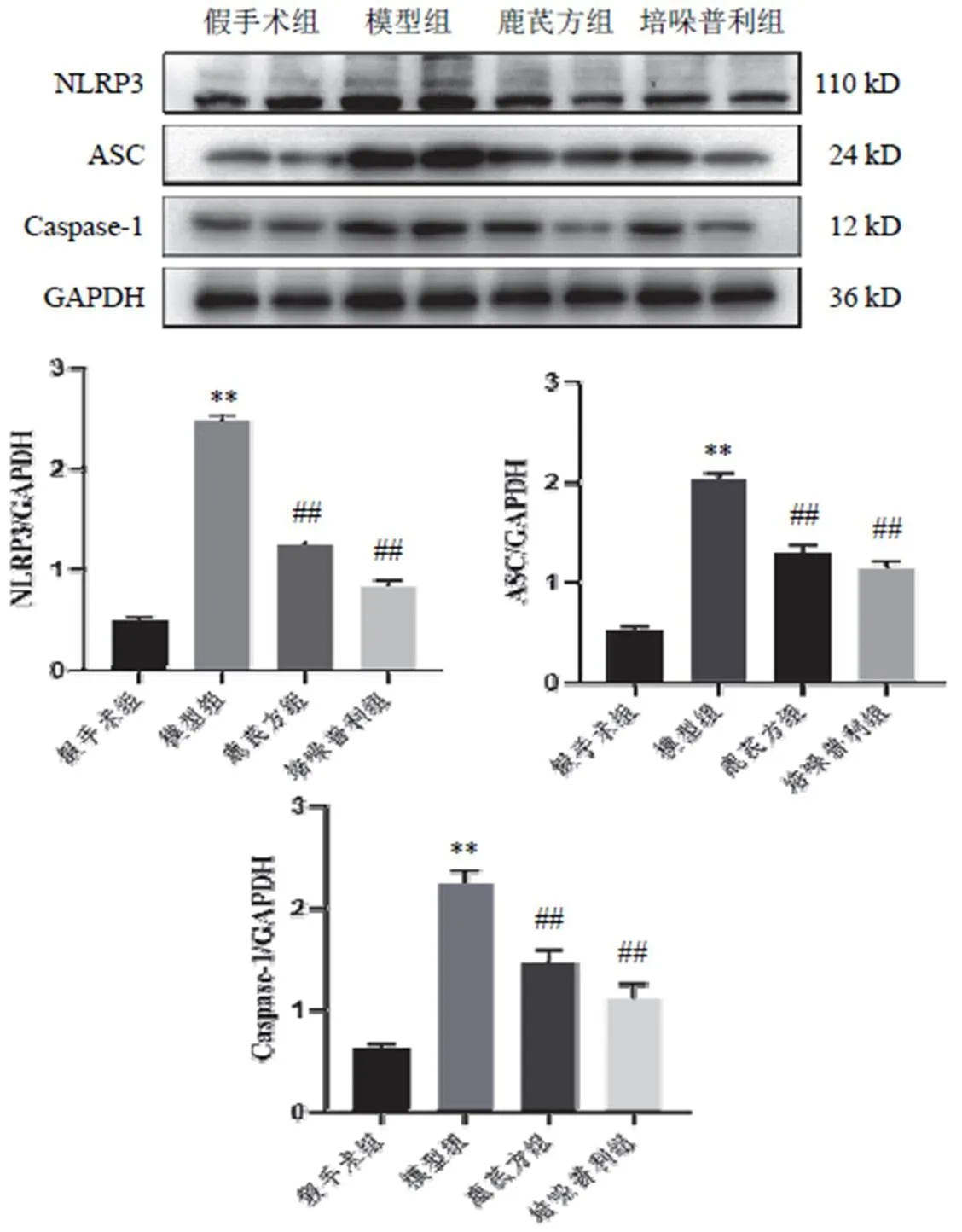
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
4.5 鹿芪方对模型小鼠心肌组织白细胞介素-1β表达的影响
与假手术组比较,模型组小鼠心肌组织IL-1β表达显著升高(<0.01);与模型组比较,各给药组小鼠心肌组织IL-1β表达明显降低(<0.01)。见图7。

注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01
4.6 鹿芪方对模型小鼠心肌组织超微结构的影响
假手术组小鼠心肌组织肌节排列整齐,心肌细胞正常,闰盘正常;模型组小鼠心肌闰盘排列紊乱,细胞器肿胀溶解,呈空泡化改变;鹿芪方组小鼠心肌细胞基本正常,闰盘连接略不规则,线粒体明显增多。见图8。

图8 各组小鼠心肌组织超微结构
5 讨论
CHF属中医学“心水”“喘证”等范畴,为本虚标实、虚实夹杂之证。鹿芪方中鹿角温肾助阳,配伍红花,共奏温通心脉之功;黄芪与党参配伍,共达益气温阳通脉之功;桂枝配伍葶苈子,以达泻肺利水、降气平喘之功。药理研究表明,红花主要成分红花黄色素能提高心肌缺血再灌注大鼠乳酸脱氢酶含量,减少脂质过氧化物生成,提高超氧化物歧化酶、谷胱甘肽过氧化物酶活性,通过抑制氧化应激减轻心肌超微结构损伤[11]。黄芪主要成分黄芪总黄酮能减少缺血心肌乳酸脱氢酶产生,增强心肌抗缺氧能力[12]。党参碱和桂枝能增加冠状动脉血流,提高心排血量[13-14]。本研究结果表明,鹿芪方对CHF小鼠心功能具有良好的保护作用。
细胞焦亡表现为细胞膜破裂,NLRP3、Caspase-1等焦亡关键蛋白表达升高及IL-1β和IL-18等炎症因子释放。Caspase-1介导的细胞焦亡为经典的细胞焦亡途径,而Caspase-1的激活又依赖于NLRP3炎性小体的形成[15]。NLRP3炎性小体由NLRP3(NOD样受体热蛋白结构域相关蛋白3)、ASC(凋亡相关斑点样蛋白)及pro-Caspase-1构成。近年研究发现,NLRP3炎性小体与心脏无菌性炎症反应的发生密切相关[16]。心肌缺血时,死细胞、细胞碎片和细胞溶解后释放的细胞内容物作为损伤相关分子模式,导致线粒体内ROS产生过多,激活NLRP3炎性小体,触发先天性免疫应答[17],活化的NLRP3炎性小体发挥蛋白水解作用,促使Caspase-1前体剪切,活性Caspase-1进一步剪切促炎症细胞因子IL-1β、IL-18并促使其向细胞外释放[18],扩大心肌梗死后的炎症反应,加剧心力衰竭的发生发展[19]。因此,特异性抑制ROS及NLRP3/Caspase-1信号通路是治疗心力衰竭的关键[20]。
本研究结果显示,与假手术组比较,模型组小鼠心肌组织ROS含量增加,NLRP3、ASC、Caspase-1蛋白及IL-1β表达显著升高,表明心力衰竭小鼠存在心肌细胞焦亡;与模型组比较,鹿芪方可抑制小鼠心肌组织ROS生成,降低NLRP3、ASC、Caspase-1蛋白表达,减少IL-1β释放,表明鹿芪方可能通过抑制ROS/NLRP3/Caspase-1信号通路的激活,减轻CHF小鼠心肌细胞焦亡,发挥心肌保护作用。Bracey等[21]发现,结构性心肌病心力衰竭小鼠心肌组织NLRP3、Caspase-1含量较野生型小鼠升高,NLRP3-/-心力衰竭小鼠心肌炎症反应及心肌收缩功能改善。Zhang等[22]发现,二甲双胍可通过抑制AMPK/NLRP3信号通路减轻心肌细胞焦亡,改善心功能。
综上所述,鹿芪方能有效减轻CHF小鼠心肌细胞焦亡,改善CHF小鼠心功能,其机制可能与抑制ROS/NLRP3/Caspase-1通路活化相关。
[1] MURPHY S P, IBRAHIM N E, JANUZZI J L. Heart failure with reduced ejection fraction:a review[J]. JAMA,2020,324:488-504.
[2] LI F F, YANG Y M, XUE C Y, et al. Zinc finger protein ZBTB20 protects against cardiac remodelling post-myocardial infarction via ROS-TNFα/ASK1/JNK pathway regulation[J]. J Cell Mol Med, 2020,24(22):13383-13396.
[3] YAN Z P, QI Z W, YANG X Y, et al. The NLRP3 inflammasome:multiple activation pathways and its role in primary cells during ventricular remodeling[J]. J Cell Physiol,2021.DOI:10.1002/jcp. 30285.
[4] FRANGOGIANNIS N G. Regulation of the inflammatory response in cardiac repair[J]. Circ Res,2012,110(1):159-173.
[5] WANG J Y, DENG B, LIU Q, et al. Pyroptosis and ferroptosis induced by mixed lineage kinase 3 (MLK3) signaling in cardiomyocytes are essential for myocardial fibrosis in response to pressure overload[J]. Cell Death Dis,2020,11(7):574.
[6] ZENG C, WANG R Q, TAN H M. Role of pyroptosis in cardiovascular diseases and its therapeutic implications[J]. Int J Biol Sci, 2019,15(7):1345-1357.
[7] HAN Y J, DONG B, CHEN M J, et al. LncRNA H19 suppresses pyroptosis of cardiomyocytes to attenuate myocardial infarction in a PBX3/ CYP1B1-dependent manner[J]. Mol Cell Biochem,2021,476(1):1-14.
[8] 戎靖枫,封舟,刘茜,等.基于心力衰竭大鼠PPARα和β3表达筛选鹿红方有效组分[J].上海中医药大学学报,2017,31(4):82-86.
[9] ZHAO W, HU W Y, WANG X L, et al. A traditional Chinese medicine,prescription, as a potential therapy for hypertrophic cardiomyocytes by acting on histone acetylation[J]. J Chin Med Assoc,2015,78(8):486-493.
[10] 贺争鸣,李根平,朱德生,等.实验动物管理与使用指南[M].北京:科学出版社,2016.
[11] 姜丹.搜风祛痰中药对大鼠心肌缺血再灌注损伤保护机制的实验研究[D].沈阳:辽宁中医药大学,2019.
[12] 黄玫,曲晶,李晓天,等.黄芪化学成分及对心血管系统作用的研究进展[J].中国老年学杂志,2009,29(11):1451-1453.
[13] 李浅予,汤岐梅,侯雅竹,等.中药党参的心血管药理研究进展[J].中西医结合心脑血管病杂志,2019,17(17):2604-2606.
[14] 朱华,秦丽,杜沛霖,等.桂枝药理活性及其临床应用研究进展[J].中国民族民间医药,2017,26(22):61-65.
[15] WANG Y C, LIU X X, SHI H, et al. NLRP3 inflammasome, an immune- inflammatory target in pathogenesis and treatment of cardiovascular diseases[J]. Clin Transl Med,2020,10(1):91-106.
[16] PELLEGRINI C, MARTELLI A, ANTONIOLI L, et al. NLRP3 inflammasome in cardiovascular diseases:pathophysiological and pharmacological implications[J]. Med Res Rev,2021.DOI:10.1002/ med.21781.
[17] ZAHID A, LI B F, KOMBE A J K, et al. Pharmacological inhibitors of the NLRP3 inflammasome[J]. Front Immunol,2019,10:2538.
[18] 王楠.慢性心衰患者血浆NLRP3表达水平及其与NT-proBNP的相关性研究[D].石河子:石河子大学,2020.
[19] DUBOIS-DERUY E, PEUGNET V, TYRKIEH A, et al. Oxidative stress in cardiovascular diseases[J]. Antioxidants,2020,9(9):864.
[20] GAUTHIER L D, GREESTEIN J L, O’ROURKE B, et al. An integrated mitochondrial ROS production and scavenging model:implications for heart failure[J]. Biophys J,2013,105(12):2832-2842.
[21] BRACEY N A, BECK P L, MURUVE D A, et al. The NLRP3 inflammasome promotes myocardial dysfunction in structural cardiomyopathy through interleukin-1β[J]. Exp Physiol,2013,98:462-472.
[22] ZHANG J, HUANG L L, SHI X, et al. Metformin protects against myocardial ischemia-reperfusion injury and cell pyroptosis via AMPK/NLRP3 inflammasome pathway[J]. Aging (Albany NY),2020, 12(23):24270-24287.
Effects ofPrescription on Myocardial Cell Pyrolysis in Mice with Chronic Heart Failure Based on ROS/NLRP3/Caspase-1 Pathway
ZHANG Xiaoqing, QU Huiyan, ZHAO Dandan, YANG Xiaoli, LAN Zhenzhen, YANG Tao, ZHOU Hua
To investigate the effects ofPrescription on myocardial cell pyrolysis in mice with chronic heart failure; To discuss its mechanism of action from the ROS/NLRP3/Caspase-1 pathway.Totally 60 C57BL/6J mice were randomly divided into sham-operation group, model group,Prescription group and perindopril group. Chronic heart failure model was made by ligation of anterior descending coronary artery. ThePrescription group and the perindopril group were given respective medicine for garage, while the sham-operation group and the model group were given the same amount of sodium chloride solution for garage. After 6 weeks of continuous administration, the cardiac function of mice was detected by ultrasound; the cardiac morphological changes and collagen fiber deposition were detected by HE and Masson staining; DHE fluorescent probe was used to detect ROS content in myocardial tissue; Western blot was used to detect the expressions of NLRP3, ASC and Caspase-1 protein in myocardial tissue; the expression of IL-1β was detected by immunohistochemistry; the ultrastructural changes of myocardial tissue were observed by projection electron microscopy.Compared with sham-operation group, left ventricular ejection fraction (LVEF) and left ventricular fractional shortening (LVFS) in model group decreased; left ventricular end-diastolic diameter (LVIDd) and left ventricular end-systolic diameter (LVIDs) increased; myocardial cells were obviously enlarged and arranged irregularly; there were more inflammatory cell aggregation and collagen fiber deposition; the content of ROS in myocardial tissue increased; expressions of NLRP3, ASC, Caspase-1 protein and IL-1β increased, with statistical significance (<0.01). Compared with model group, the LVEF and LVFS of the mice inPrescription group and perindopril group increased; the LVIDd and LVIDs decreased; the myocardial cell damage was improved; collagen fiber deposition, myocardial fibrosis, the content of ROS in myocardial tissue reduced, and the expression of NLRP3, ASC, Caspase-1 protein and IL-1β were decreased, with statistical significance (<0.01).Prescription can effectively reduce myocardial pyrolysis in chronic heart failure mice, and the mechanism may be related to the inhibition of ROS/NLRP3/Caspase-1 pathway activation and the reduction of myocardial inflammatory response.
Prescription; reactive oxygen species; NLRP3; inflammasome; heart failure; mice
R285.5
A
1005-5304(2021)10-0093-06
10.19879/j.cnki.1005-5304.202102230

国家自然科学基金(81673753);上海市申康医学发展中心三年行动计划(SHDC2020CR1053B);上海市科学技术委员会科技支撑项目(18401932800);上海市申康医学发展中心新兴前沿技术联合攻关项目(SHDC12018125);上海中医药大学研究生创新能力项目(Y2020014)
周华,E-mail:zhouhua@shutcm.edu.cn
(收稿日期:2021-02-19)
(修回日期:2021-03-30;编辑:郑宏)

