肾衰Ⅱ号方对慢性肾衰竭大鼠有氧糖酵解及肾间质纤维化的影响
杨柳易,王蒙,周圆,王琛
实验研究
肾衰Ⅱ号方对慢性肾衰竭大鼠有氧糖酵解及肾间质纤维化的影响
杨柳易,王蒙,周圆,王琛
上海中医药大学附属曙光医院,上海中医药大学中医肾病研究所,上海市中医临床重点实验室,上海 201203
观察肾衰Ⅱ号方对慢性肾衰竭大鼠有氧糖酵解及肾间质纤维化的影响,探讨其抗肾间质纤维化的作用机制。体内实验以5/6(A/I)手术构建慢性肾衰竭大鼠模型,随机分为假手术组、模型组、中药组、西药组,进行相应干预8周后,取肾组织行PAS染色观察肾脏病理变化,Western blot检测α-平滑肌肌动蛋白(α-SMA)蛋白表达,免疫组化检测α-SMA、己糖激酶(HK)2蛋白定位,紫外法检测肾组织HK活性,比色法检测肾组织乳酸、丙酮酸浓度;体外实验以白细胞介素(IL)-1β刺激大鼠肾成纤维细胞NRK-49F构建NRK-49F增殖活化模型,细胞分为空白组、IL-1β组、IL-1β+肾衰Ⅱ号方低剂量组(200 µg/mL)、IL-1β+肾衰Ⅱ号方高剂量组(400 µg/mL)、IL-1β+2-脱氧-D-葡萄糖组(10 mmol/L),Western blot检测NRK-49F细胞α-SMA、增殖细胞核抗原(PCNA)、纤维连接蛋白(FN)、HK2蛋白表达,比色法检测细胞培养基乳酸浓度,葡萄糖氧化酶法检测细胞培养基葡萄糖浓度,免疫荧光检测HK2蛋白表达。体内实验:与假手术组比较,模型组PAS染色提示肾间质糖原含量增加,肾小球、肾小管形态异常;α-SMA蛋白表达明显升高(<0.01),肾组织乳酸浓度、乳酸/丙酮酸、HK活性、HK2蛋白表达均明显升高(<0.01)。与模型组比较,中药组和西药组肾组织病理变化改善,α-SMA蛋白表达、乳酸浓度、乳酸/丙酮酸、HK活性、HK2蛋白表达均明显降低(<0.05,<0.01)。体外实验:与空白组比较,IL-1β组NRK-49F细胞FN、α-SMA、PCNA、HK2蛋白表达明显升高(<0.05,<0.01);细胞培养基pH值、葡萄糖浓度明显降低(<0.05),乳酸浓度明显升高(<0.01);与IL-1β组比较,各干预组NRK-49F细胞FN、α-SMA、PCNA、HK2蛋白表达明显降低(<0.05,<0.01);细胞培养基pH值、葡萄糖浓度升高(<0.05,<0.01),乳酸浓度明显降低(<0.01)。肾衰Ⅱ号方可通过抑制NRK-49F细胞有氧糖酵解反应,从而阻止成纤维细胞增殖活化,实现其抗肾间质纤维化的作用。
肾衰Ⅱ号方;肾间质纤维化;有氧糖酵解;肾成纤维细胞;大鼠
肾间质纤维化(renal interstitial fibrosis,RIF)是各种病因引起的慢性肾脏病(chronic kidney disease,CKD)进展至终末期肾脏病(end-stage renal disease,ESRD)的共同病理表现,肾功能进行性恶化与肾间质损害程度关系密切[1]。RIF的发生发展与细胞外基质(extracellular matrix,ECM)合成和降解失衡、肾成纤维细胞增殖活化、炎症或非炎症损伤导致ECM过度沉积直接相关[1-2]。肾成纤维细胞是组成肾间质及合成和降解ECM的主要细胞,对维持肾间质ECM平衡稳态十分重要[3]。研究表明,抑制肾成纤维细胞的增殖和活化可有效改善多种CKD动物模型肾纤维化[4-6]。因此,寻求抑制肾成纤维细胞增殖和激活的多靶点药物是减缓RIF进程的主要方向。肾衰Ⅱ号方由上海中医药大学附属曙光医院肾病科王琛教授研制,临床用于治疗早中期慢性肾衰竭20余年。前期研究表明,肾衰Ⅱ号方可有效改善CKD3~4期患者肾功能和微炎症状态[7-8],并有效抑制5/6(ablation/infarction,A/I)慢性肾衰竭大鼠模型的RIF,其作用机制可能与抑制炎症反应、细胞凋亡、有氧糖酵解相关[9-13],但其具体作用机制仍需进一步探讨。本实验以肾成纤维细胞中能量代谢异常为切入点,以5/6(A/I)慢性肾衰竭大鼠和白细胞介素-1β(IL-1β)诱导大鼠肾成纤维细胞NRK-49F作为实验模型,进一步探讨肾衰Ⅱ号方抗RIF的作用机制。
1 实验材料
1.1 动物
雄性SPF级SD大鼠67只,8周龄,体质量140~160 g,购自上海西普尔-必凯实验动物有限公司,动物许可证号SCXK(沪)2012-0002。饲养于上海中医药大学实验动物中心,温度20~24 ℃,相对湿度53%~57%,12 h/12 h明暗交替,动物实验通过上海中医药大学伦理委员会审查批准(SZY201604006)。
1.2 药物
肾衰Ⅱ号方(党参15 g,淫羊藿 15 g,丹参15 g,当归15 g,川芎15 g,桃仁15 g,制大黄15 g,黄连6 g,紫苏叶15 g,虫草菌丝5 g),所有饮片由上海中医药大学附属曙光医院提供,由该院药剂科徐光临药师鉴定为正品,并委托该院药剂科制成中药复方冻干粉。氯沙坦钾片,杭州默沙东制药有限公司,货号N035513;2-脱氧-D-葡萄糖(2-DG),美国Sigma Aldrich公司,货号D8375。
1.3 细胞
大鼠肾成纤维细胞NRK-49F,购自中国科学院细胞库。
1.4 主要试剂与仪器
纤维连接蛋白(FN)抗体(英国Abcam公司,货号ab45688),增殖细胞核抗原(PCNA,英国Abcam公司,货号ab92552),α-平滑肌肌动蛋白(α-SMA)抗体(华安生物公司,货号ET1607-53),己糖激酶2(HK2)抗体(英国Abcam公司,货号ab209847),GAPDH抗体(美国Proteintech公司,货号60004-1-Ig),β-actin(美国Proteintech公司,货号66009-1-Ig),重组大鼠IL-1β细胞因子(美国PeproTech公司,货号400-01B),DMEM高糖培养基(杭州吉诺公司,货号C11995500BT),胎牛血清(FBS,美国Gibco公司,货号10099141),青链霉素(美国Gibco公司,货号15140-122),乳酸、丙酮酸、葡萄糖测定试剂盒(南京建成生物工程研究所有限公司,货号分别为A081-1-1、A081-1-1、F006-1-1)。Nikon80i荧光显微镜(日本Nikon公司),YZB/USA 0816-2014型恒温培养箱(美国Thermo公司),Centrifuge 5424R高速低温离心机(德国Eppendorf公司),Cytation 3细胞成像多功能检测系统(美国BioTek公司),电泳及转膜电源仪(美国Bio-Rad公司)。
2 实验方法
2.1 造模及分组
随机选取55只SD大鼠应用5/6(A/I)手术造模[14],将造成模功的36只大鼠随机分为模型组、中药组、西药组,另取12只大鼠为假手术组,分别给予中药组肾衰Ⅱ号方(4 g/mL)3 mL、西药组氯沙坦钾(3.33 mg/mL)3 mL、假手术组和模型组生理盐水3 mL灌胃,每日1次,干预8周。
2.2 NRK-49F细胞培养及分组
将NRK-49F细胞用含10%FBS和1%双抗的DMEM高糖培养基于5%CO2、37 ℃恒温培养箱中培养,细胞密度为80%时进行细胞传代,每周传代2~3次。取对数生长期细胞进行细胞铺板,细胞贴壁后用含0.5%FBS的DMEM高糖培养基饥饿处理12 h,再进行相应干预24 h。将细胞分为空白组、模型组(IL-1β 10 ng/mL,IL-1β组)、肾衰Ⅱ号方低剂量组(肾衰Ⅱ号方200 µg/mL+IL-1β 10 ng/mL,IL-1β+SSRL组)、肾衰Ⅱ号方高剂量组(肾衰Ⅱ号方400 µg/mL+IL-1β 10 ng/mL,IL-1β+SSRH组)及2-DG组(2-DG 10 mmol/L+IL-1β 10 ng/mL,IL-1β+2-DG组)。
2.3 Western blot检测
使用RIPA裂解液冰上裂解大鼠肾组织蛋白和细胞蛋白30 min,15 000 r/min离心15 min,取上清液,BCA法测定蛋白浓度后进行蛋白样品制备。所有一抗均按1∶1 000比例稀释。Western blot检测方法参照文献[13]。
2.4 免疫组化染色
将大鼠肾组织置于4%多聚甲醛中固定24 h,梯度乙醇脱水,石蜡包埋,切片(厚度3 µm),脱蜡后进行抗原修复,3%BSA封闭30 min,滴加相应一抗,4 ℃孵育过夜,二抗孵育后显色,倒置显微镜下观察并采集图像。
2.5 乳酸浓度测定
2.5.1 大鼠肾组织
称取20 mg大鼠肾组织,加180 µL生理盐水,匀浆,5 000 r/min离心10 min,取上清液进行后续检测。BCA法测定组织蛋白浓度。乳酸浓度测定严格按试剂盒说明书操作,于酶标仪波长530 nm测定各孔吸光度(OD)。组织乳酸浓度(mmol/g)=(样品OD值-空白OD值)÷(标准OD值-空白OD值)×标准样品浓度÷样品蛋白浓度。
2.5.2 细胞培养基
NRK-49F细胞干预结束后,取6孔板中细胞培养基于2 mL EP管,1 000 r/min离心5 min,取上清液进行乳酸浓度检测,严格按试剂盒说明书操作,于酶标仪波长530 nm处测定各孔OD值。细胞培养基乳酸浓度(mmol/L)=(样品OD值-空白OD值)÷(标准OD值-空白OD值)×标准样品浓度。
2.6 肾组织丙酮酸浓度测定
组织处理及蛋白浓度测定同“2.5.1”项下方法,严格按试剂盒说明书操作,于酶标仪波长505 nm处测定各孔OD值。组织丙酮酸浓度(mmol/g)=(样品OD值-空白OD值)÷(标准OD值-空白OD值)×标准样品浓度÷样品蛋白浓度。
2.7 肾组织己糖激酶活性测定
组织处理及蛋白浓度测定同“2.5.1”项下方法,按试剂盒说明书进行操作,于酶标仪波长340 nm处测定各孔20 s初始吸光度(A1)和5 min 20 s时吸光度(A2)。组织HK活性[nmol/(min•mg)]=(A2-A1)÷样品蛋白浓度。
2.8 细胞免疫荧光检测
将细胞悬液加至底部提前包被无菌盖玻片24孔板,进行不同干预,1×PBS冲洗细胞,4%多聚甲醛室温固定30 min,0.5%Triton X-100室温通透20 min,10%BSA室温封闭30 min,滴加适量HK2抗体(1∶200),置于湿盒4 ℃孵育过夜,滴加荧光二抗,置于湿盒避光,室温孵育1 h,加入DAPI工作液,置于湿盒避光,室温孵育5 min,迅速于荧光显微镜下观察并采集图像。
3 统计学方法

4 结果
4.1 PAS染色结果
与假手术组比较,模型组大鼠肾小管管腔扩张,损伤明显,肾小球硬化,肾小球基底膜增厚,肾小球内及肾小管间质内糖原呈紫红色,ECM含量增加;与模型组比较,中药组和西药组肾小管损伤减轻,肾小球硬化及肾小球基底膜增厚减少,肾小球内及肾小管间质内糖原含量减少。见图1。
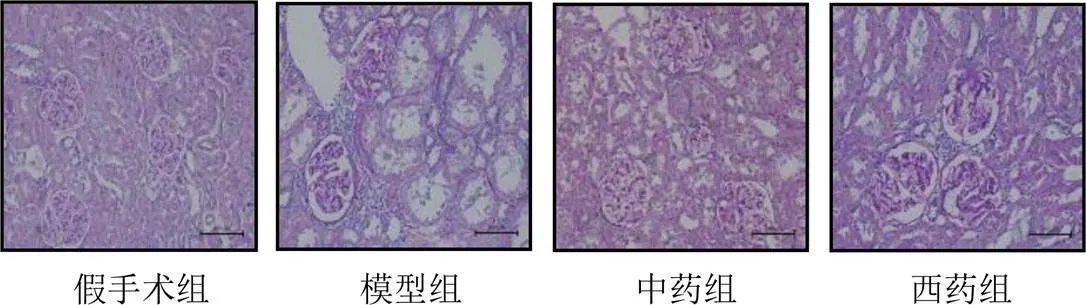
图1 各组大鼠肾组织形态(PAS染色,标尺=100 μm)
4.2 肾衰Ⅱ号方对模型大鼠肾组织α-平滑肌肌动蛋白表达的影响
与假手术组比较,模型组大鼠肾组织α-SMA蛋白表达明显升高,差异有统计学意义(<0.01),且α-SMA主要在肾间质表达,并可见肾组织有大量炎性细胞浸润;与模型组比较,中药组和西药组大鼠肾组织α-SMA蛋白表达降低,差异有统计学意义(<0.05),且α-SMA在肾间质表达减少。见表1、图2、图3。
4.3 肾衰Ⅱ号方对模型大鼠肾组织乳酸浓度、乳酸/丙酮酸的影响
与假手术组比较,模型组大鼠肾组织乳酸浓度和乳酸/丙酮酸明显升高,差异有统计学意义(<0.01);与模型组比较,中药组和西药组大鼠肾组织乳酸浓度和乳酸/丙酮酸明显下降(<0.05,<0.01)。见表2。

表1 各组大鼠肾组织α-SMA蛋白表达比较(±s)
注:与假手术组比较,**<0.01;与模型组比较,#<0.05
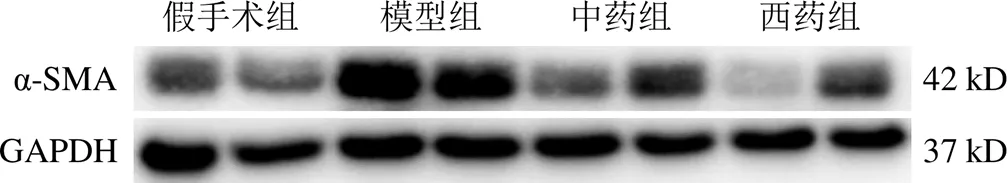
图2 各组大鼠肾组织α-SMA蛋白免疫印迹图
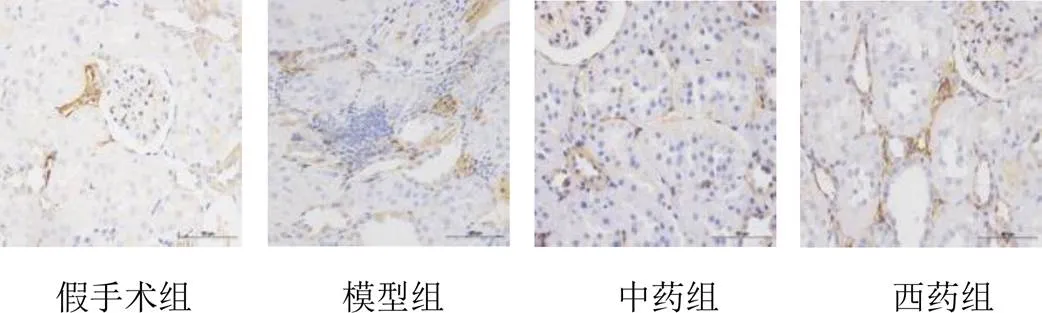
图3 各组大鼠肾组织α-SMA蛋白阳性表达(免疫组化染色,标尺=100 μm)

表2 各组大鼠肾组织乳酸浓度、乳酸/丙酮酸比较(±s)
注:与假手术组比较,**<0.01;与模型组比较,#<0.05,##<0.01
4.4 肾衰Ⅱ号方对模型大鼠肾组织己糖激酶活性和己糖激酶2蛋白表达的影响
与假手术组比较,模型组大鼠肾组织HK活性明显升高(<0.05),HK2蛋白在肾间质高表达;与模型组比较,中药组和西药组大鼠肾组织HK活性明显降低(<0.05,<0.01),HK2蛋白在肾间质表达明显减少。见表3、图4。

表3 各组大鼠肾组织HK活性比较(±s)
注:与假手术组比较,**<0.01;与模型组比较,#<0.05,##<0.01
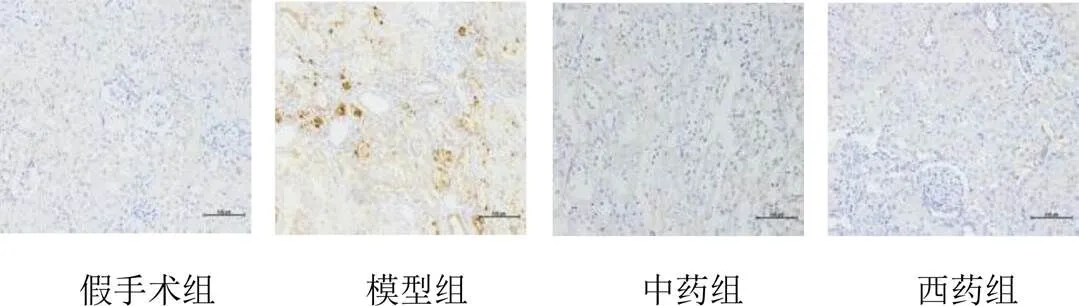
图4 各组大鼠肾组织HK2蛋白阳性表达(免疫组化染色,标尺=100 μm)
4.5 肾衰Ⅱ号方对NRK-49F细胞纤维连接蛋白、α-平滑肌肌动蛋白、增殖细胞核抗原蛋白表达的影响
与空白组比较,IL-1β组NRK-49F细胞FN、α-SMA、PCNA蛋白表达明显升高(<0.05,<0.01);与IL-1β组比较,IL-1β+SSRL组、IL-1β+SSRH组及IL-1β+2-DG组NRK-49F细胞FN、α-SMA、PCNA蛋白表达降低,其中IL-1β+SSRH组、IL-1β+2-DG组差异有统计学意义(<0.05,<0.01)。见表4、图5。

表4 各组NRK-49F细胞FN、α-SMA、PCNA蛋白表达比较(±s)
注:与空白组比较,*<0.05,**<0.01;与IL-1β组比较,#<0.05,##<0.01
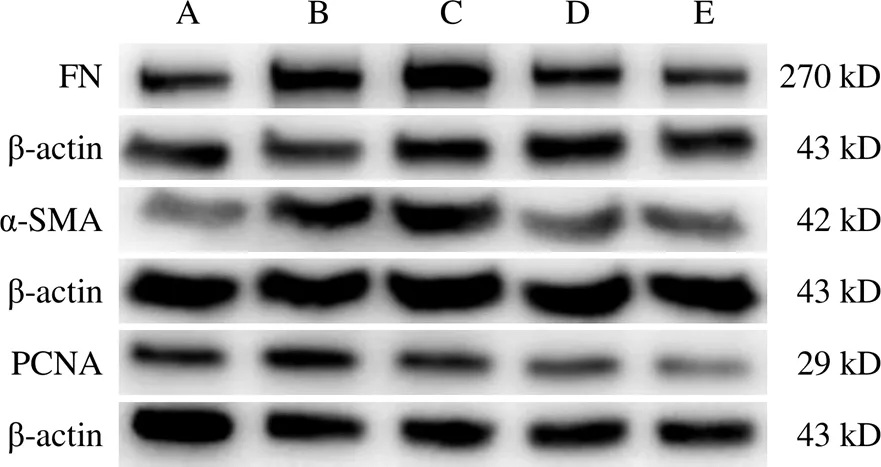
注:A.空白组;B. IL-1β组;C. IL-1β+SSRL组;D. IL-1β+SSRH组;E. IL-1β+2-DG组
4.6 肾衰Ⅱ号方对NRK-49F细胞培养基pH值、乳酸浓度、葡萄糖浓度的影响
与空白组比较,IL-1β组NRK-49F细胞培养基pH值和葡萄糖浓度明显下降(<0.05),乳酸浓度明显上升(<0.01);与IL-1β组比较,IL-1β+SSRH组及IL-1β+2-DG组NRK-49F细胞培养基pH值和葡萄糖浓度明显升高(<0.01,<0.05),乳酸浓度明显下降(<0.01)。见表5。

表5 各组NRK-49F细胞培养基pH值、乳酸浓度和葡萄糖浓度比较(±s)
注:与空白组比较,*<0.05,**<0.01;与IL-1β组比较,#<0.05,##<0.01
4.7 肾衰Ⅱ号方对NRK-49F细胞己糖激酶2蛋白表达的影响
与空白组比较,IL-1β组NRK-49F细胞HK2蛋白表达明显升高(<0.01),且HK2蛋白在胞浆中大量表达;与IL-1β组比较,IL-1β+SSRL组、IL-1β+SSRH组及IL-1β+2-DG组NRK-49F细胞HK2蛋白表达明显降低(<0.05,<0.01),且HK2蛋白在胞浆中表达明显减少。见表6、图6、图7。

表6 各组NRK-49F细胞HK2蛋白表达比较(±s)
注:与空白组比较,**<0.01;与IL-1β组比较,#<0.05,##<0.01

注:A.空白组;B. IL-1β组;C. IL-1β+SSRL组;D. IL-1β+SSRH组;E. IL-1β+2-DG组

图7 各组NRK-49F细胞HK2蛋白阳性表达(免疫荧光染色,标尺=100 μm)
5 讨论
由德国学者Warburg[15]在肝癌细胞中首次发现的有氧糖酵解是指不论氧气充足与否,大部分葡萄糖会被分解产生乳酸,少部分葡萄糖经过氧化磷酸化进行分解产生二氧化碳(CO2)和水(H2O),此过程中1 mol葡萄糖代谢可获得4 mol ATP。有氧糖酵解早期被认为是肿瘤细胞独有的特征,但随着研究进展发现,增殖细胞也可通过有氧糖酵解应对不断变化的环境条件[16]。目前,越来越多研究表明,在多种纤维化组织中出现能量代谢重编程,包括肺纤维化、肝纤维化、肾纤维化等[17-19]。高氧耗、高代谢、高耗能的生理特点使肾脏对能量代谢的变化极敏感,关于有氧糖酵解如何参与肾纤维化已经成为研究热点。有氧糖酵解参与胚胎细胞肾单位祖细胞(NPC)的自我更新过程,抑制糖酵解可刺激NPC的分化,促进肾间充质向上皮的转变和肾脏生成,在肾脏中可能存在糖代谢的开关来调控细胞增殖和修复[20]。多种肾纤维化动物模型证实,在RIF形成过程中,能量代谢方式的改变是肌成纤维细胞活化的主要特征,成纤维细胞从氧化磷酸化到有氧糖酵解的代谢转变是其增殖和细胞外基质合成的主要动力源泉,抑制成纤维细胞的糖酵解反应是减少RIF的有效策略[21-24]。本课题组前期研究发现,肾衰Ⅱ号方可改善5/6(A/I)慢性肾衰竭大鼠肾功能,可能与抑制有氧糖酵解限速酶HK2、M2型丙酮酸激酶表达有关,但其具体作用机制还需进一步探讨。
2-DG是HK2的竞争性抑制剂,是一种可口服的葡萄糖异构体,可被磷酸化为6磷酸2-DG,6磷酸2-DG不能进一步参加葡萄糖代谢,同时2-DG还可与葡萄糖竞争多种催化酶,从而阻止葡萄糖代谢的进一步反应。2-DG可减轻单侧输尿管结扎小鼠RIF,对TGF-β1刺激的成纤维细胞活化也具有抑制作用[24]。有研究指出,IL-1β是促进RIF的关键因素,主要作用机制是通过IL-1β/IRAK4/c-Myc信号通路促进肾脏有氧糖酵解反应增强,进一步明确了炎症、有氧糖酵解与RIF之间的关系[25]。本研究细胞实验发现,与IL-1β组比较,2-DG抑制NRK-49F细胞有氧糖酵解反应的同时下调纤维化相关因子表达,再次表明有氧糖酵解通过促进成纤维细胞增殖活化而加重RIF。
根据RIF临床表现,将其归属中医学“虚劳”“水肿”“癥积”等范畴。RIF病机之本为脾肾不足,标见湿、热、毒、瘀,随着病情进展,本虚影响标实,标实加重本虚,虚实错杂,邪正交争。有氧糖酵解是一种消耗较多葡萄糖而产能过少的代谢方式,是由于邪气盛而消耗人体大量正气的过程,线粒体氧化磷酸化属气归正化,有氧糖酵解属气失正化,是邪气盛的表现。RIF患者脾肾虚损,出现物质转换和物质转为能量的功能减弱,这与有氧糖酵解代谢方式将葡萄糖转化为乳酸而非彻底有氧氧化为CO2和H2O,并产能过少相吻合。此外,能量代谢障碍导致的细胞代谢产物积累,属中医湿热瘀毒范畴,进而造成线粒体功能障碍,促进有氧糖酵解,形成恶性循环。因此,慢性肾功能衰竭RIF“脾肾虚损,湿热瘀毒”的中医病机与能量代谢障碍的病理特征相合。肾衰Ⅱ号方重用党参、淫羊藿以同补先后天,加用当归、丹参、川芎、桃仁以养血活血,佐以紫苏叶、大黄、黄连清热泄浊解毒和虫草菌丝壮命火、益精髓,共奏益气补肾、养血活血、化瘀降浊解毒功效,契合有氧糖酵解所致慢性肾衰竭RIF的发病机制。
本研究首先利用5/6(A/I)慢性肾衰竭大鼠模型进行初步探索,体内实验通过检测有氧糖酵解的终产物乳酸、中间产物丙酮酸浓度和限速酶HK活性及HK2蛋白表达定位,发现与假手术组比较,模型大鼠肾组织存在有氧糖酵解反应增强,而且可能集中在肾间质细胞中。进一步对肾间质主要组成细胞成纤维细胞进行研究,利用IL-1β诱导NRK-49F细胞活化模型,结果发现,IL-1β组NRK-49F细胞增殖活化的同时有氧糖酵解反应明显增强。而肾衰Ⅱ号方可抑制慢性肾衰竭大鼠肾间质中肌成纤维细胞标志蛋白α-SMA表达,减轻慢性肾衰竭大鼠病理变化。体外实验显示,肾衰Ⅱ号方干预后的NRK-49F细胞增殖活化相关蛋白表达下降,有氧糖酵解代谢状态接近空白组,提示肾衰Ⅱ号方可通过抑制NRK-49F细胞有氧糖酵解影响RIF的进程。
综上,有氧糖酵解反应增强是RIF形成和进展的重要影响因素。肾衰Ⅱ号方抗RIF作用与减弱成纤维细胞的有氧糖酵解反应,进而抑制成纤维细胞增殖活化、减少ECM蛋白沉积有关。本研究进一步阐释了肾衰Ⅱ号方抗RIF的作用机制,本方抑制有氧糖酵解的具体机制有待进一步研究。
[1] LIU Y. Cellular and molecular mechanisms of renal fibrosis[J]. Nat Rev Nephrol,2011,7(12):684-696.
[2] QIU M, LI J, TAN L, et al. Targeted ablation of distal cerebrospinal fluid-contacting nucleus alleviates renal fibrosis in chronic kidney disease[J]. Front Physiol,2018,21(9):1640- 1649.
[3] KALLURI R, ZEISBERG M. Fibroblasts in cancer[J]. Nat Rev Cancer, 2006,6(5):392-401.
[4] SOUMA T, YAMAZAKI S, MORIGUCHI T, et al. Plasticity of renal erythropoietin-producing cells governs fibrosis[J]. J Am Soc Nephrol,2013,24(10):1599-1616.
[5] LI J, REN J, LIU X, et al. Rictor/mTORC2 signaling mediates TGFβ1-induced fibroblast activation and kidney fibrosis[J]. Kidney Int,2015,88(2):515-527.
[6] LI N, WANG Z, GAO F, et al. Melatonin ameliorates renal fibroblast-myofibroblast transdifferentiation and renal fibrosis through miR-21-5p regulation[J]. J Cell Mol Med,2020, 24(10):5615-5628.
[7] 周圆,王琛,何立群,等.肾衰Ⅱ号方治疗CKD 3-4期患者的临床疗效观察[J].上海中医药医药大学学报,2011,25(4):37-40.
[8] 杨婧,严睿俊,王琛,等.肾衰Ⅱ号方对慢性肾脏病患者肾功能及炎症因子的影响[J].中国中医药信息杂志,2014,21(12):15-18.
[9] WANG M, YANG L, YANG J, et al. Shen Shuai Ⅱ Recipe attenuates renal injury and fibrosis in chronic kidney disease by regulating NLRP3 inflammasome and Sirt1/Smad3 deacetylation pathway[J]. BMC Complement Altern Med,2019,19(1):107.
[10] 姚东升,徐琳,吴锋,等.肾衰Ⅱ号方对肾功能衰竭大鼠肠通透性及微炎症的影响[J].中国中医药信息杂志,2021,28(1):67-72.
[11] WANG M, YANG J, WANG C. Shen Shuai Ⅱ Recipe attenuates apoptosis in 5/6 renal ablation/infarction rats by inhibiting p53 and the mitochondrial pathway of apoptosis[J]. Oxid Med Cell Longev,2020,2020:708357.
[12] 王蒙,王琛,杨柳易,等.肾衰Ⅱ号方对5/6肾切除大鼠残余肾组织凋亡相关蛋白表达的影响[J].中国中医药信息杂志,2019,26(5):64-68.
[13] 杨柳易,王琛,王蒙,等.肾衰Ⅱ号方对慢性肾功能衰竭大鼠糖酵解限速酶HK2、PKM2表达的影响[J].中华中医药杂志,2020,35(11):5807- 5811.
[14] DENG A H, TANG T, SINGH P, et al. Regulation of oxygen utilization by angiotensin Ⅱ in chronic kidney disease[J]. Kidney Int,2009,75(2):197-204.
[15] WARBURG O, WIND F, NEGELEIN E. The metabolism of tumors in the body[J]. J Gen Physiol,1927,8(6):519-530.
[16] VANDER H M G, CANTLEY L C, THOMPSON C B. Understanding the Warburg effect:the metabolic requirements of cell proliferation[J]. Science,2009,324(5930):1029-1033.
[17] XIE N, TAN Z, BANERJEE S, et al. Glycolytic reprogramming in myofibroblast differentiation and lung fibrosis[J]. Am J Respir Crit Care Med,2015,192(12):1462-1474.
[18] BARCENA V M, PAISH H, ALVAREZ L, et al. Epigenetic mechanisms and metabolic reprogramming in fibrogenesis:dual targeting of G9a and DNMT1 for the inhibition of liver fibrosis[J]. Gut, 2021,70(2):388-400.
[19] SMITH E R, WIGG B, HOLT S, et al. TGF-β1 modifies histone acetylation and acetyl-coenzyme a metabolism in renal myofibroblasts[J]. Am J Physiol Renal Physiol,2019,316(1):517-529.
[20] LIU J, EDGINGTON G F, DUGAS C, et al. Regulation of nephron progenitor cell self-renewal by intermediary metabolism[J]. J Am Soc Nephrol,2017,28(11):3323-3335.
[21] SRIVASTAVA S P, LI J, KITADA M, et al. SIRT3 deficiency leads to induction of abnormal glycolysis in diabetic kidney with fibrosis[J]. Cell Death Dis,2018,9(10):997.
[22] YIN X, WANG J, CUI L, et al. Enhanced glycolysis in the process of renal fibrosis aggravated the development of chronic kidney disease[J]. Eur Rev Med Pharmacol Sci,2018,22(11):4243-4251.
[23] WEI Q, SU J, DONG G, et al. Glycolysis inhibitors suppress renal interstitial fibrosis via divergent effects on fibroblasts and tubular cells[J]. Am J Physiol Renal Physiol,2019,316(6):1162- 1172.
[24] DING H, JIANG L, XU J, et al. Inhibiting aerobic glycolysis suppresses renal interstitial fibroblasts activation and renal fibrosis[J]. Am J Physiol Renal Physiol,2017,313(1):561-575.
[25] LEMOS D R, MCMURDO M, KARACA G, et al. Interleukin-1β activates a MYC-dependent metabolic switch in kidney stromal cells necessary for progressive tubulointerstitial fibrosis[J]. J Am Soc Nephrol,2018,29(6):1690-1705.
Effect ofⅡ Recipe on Aerobic Glycolysis and Renal Interstitial Fibrosis in Rats with Chronic Renal Failure
YANG Liuyi, WANG Meng, ZHOU Yuan, WANG Chen
To observe the effects ofⅡ Prescription on aerobic glycolysis and renal interstitial fibrosisin rats with chronic renal failure; To explore its anti-renal fibrosis mechanism.In vivo experiment, the rat model of chronic renal failure was established by 5/6 (A/I) operation. The rats were divided into sham-operation group, model group, TCM group and Western medicine group. After 8 weeks of intervention, renal tissue was taken for PAS staining to observe the pathological changes of kidney; Western blot was used to detect the expression of α-smooth muscle actin (α-SMA) protein; immunohistochemistry was used to detect the protein localization of α-SMA and hexokinase (HK) 2; the activity of HK in renal tissue was detected by UV; the concentration of lactic acid and pyruvate in renal tissue was measured by colorimetry. In vitro experiment, the proliferation and activation model of NRK-49F was established by stimulating rat renal fibroblasts NRK-49F with interleukin (IL) -1β. The cells were divided into blank group, IL-1β group, IL-1β + low dosage ofⅡ Recipe group (200 μg/mL) and IL-1β + high dosage ofⅡ Recipe group (400 μg/mL), IL-1β + 2-deoxy-D-glucose group (10 mmol/L). The protein expression of α-SMA, proliferating cell nuclear antigen (PCNA), fibronectin (FN) and HK2 in NRK-49F cells were detected by Western blot; the concentration of lactic acid in cell medium was detected by colorimetry; the glucose concentration in cell medium was detected by glucose oxidase method; the expression of HK2 protein was detected by immunocytofluorescence.Vivo experiment showed that, compared with the sham-operation group, the PAS staining in the model group indicated that the interstitial glycogen content increased, the morphology of glomerulus and renal tubule was abnormal, the expression of α-SMA protein increased (<0.01), and the concentration of lactic acid, lactic acid/pyruvate, HK activity and HK2 protein expression in renal tissue increased (<0.01). Compared with the model group, the pathological changes of renal tissue in the TCM group and the Western medicine group were improved, and the expressions of α-SMA protein, lactic acid concentration, lactic acid/pyruvate, HK activity and HK2 protein expressions decreased in the TCM group and Western medicine group (<0.05,<0.01). Vitro experiment showed that, compared with the blank group, the protein expressions of FN, α-SMA, PCNA and HK2 in NRK-49F cells of the IL-1β group increased (<0.05,<0.01), the pH value of culture medium and the concentration of glucose decreased (<0.05), and the concentration of lactic acid increased (<0.01). Compared with the model group, the protein expressions of FN, α-SMA, PCNA and HK2 in each intervention group decreased (<0.05,<0.01), the pH value of culture medium and the concentration of glucose increased (<0.05,<0.01), and the concentration of lactic acid decreased (<0.01).Ⅱ Prescription may inhibit the aerobic glycolysis of NRK-49F cells to prevent the proliferation and activation of fibroblasts and achieve its anti-renal fibrosis effect.
Ⅱ Recipe; renal interstitial fibrosis; aerobic glycolysis; renal fibroblasts; rats
R285.5
A
1005-5304(2021)10-0057-07
10.19879/j.cnki.1005-5304.202103451

国家自然科学基金(81973770);上海市进一步加快中医药事业发展三年行动计划(ZY-(2018-2020)-FWTX-7005);上海中医药大学“研究生创新培养专项”(Y2020006)
王琛,E-mail:chenwang42@163.com
(收稿日期:2021-03-23)
(修回日期:2021-04-14;编辑:华强)

