重楼皂苷Ⅱ对人非小细胞肺癌A549细胞凋亡的影响
游丽娇,孙芳园,杨小芳,耿欢,雷鸣
重楼皂苷Ⅱ对人非小细胞肺癌A549细胞凋亡的影响
游丽娇,孙芳园,杨小芳,耿欢,雷鸣
上海中医药大学附属第七人民医院,上海 200137
观察重楼皂苷Ⅱ对人非小细胞肺癌A549细胞凋亡的影响,探讨其可能的作用机制。不同浓度重楼皂苷Ⅱ作用于A549细胞48 h,CCK-8法检测细胞存活率;将细胞分为对照组和重楼皂苷Ⅱ低、中、高剂量组,JC-10荧光探针检测线粒体膜电位(MMP),Fluo-4 AM荧光探针检测细胞内Ca2+水平,DCFH-DA荧光探针检测细胞内活性氧(ROS)水平,Western blot检测细胞内Bax、Bcl-2、cleaved Caspase-3蛋白表达。与对照组比较,各浓度重楼皂苷Ⅱ可降低A549细胞存活率,差异均有统计学意义(<0.01);重楼皂苷Ⅱ低、中、高剂量组A549细胞MMP显著降低,Ca2+、ROS水平显著升高,Bcl-2蛋白表达显著降低,重楼皂苷Ⅱ高剂量组Bax、cleaved Caspase-3蛋白表达显著升高,差异均有统计学意义(<0.05)。重楼皂苷Ⅱ可能通过降低细胞MMP,提高细胞内Ca2+水平,增加细胞内ROS含量,调节凋亡相关蛋白Bcl-2、Bax、cleaved Caspase-3表达,促进A549细胞凋亡。
非小细胞肺癌;重楼皂苷Ⅱ;A549细胞;线粒体;凋亡
非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的85%,是全球癌症死亡的主要原因[1]。早期诊断和治疗虽然有效,但由于化学抗癌药物的毒性和耐药性,故亟需探索和开发更安全、有效的抗癌药物[2]。近年来,从中药中提取天然的抗癌活性成分受到广泛关注。研究报道,中药有效成分可通过诱导癌细胞凋亡、改变细胞周期、免疫修饰和抑制炎症发挥抗癌活性[3-4]。线粒体是传递凋亡信号的主要细胞器,细胞凋亡过程中,细胞内Ca2+、活性氧(ROS)水平和线粒体膜电位(MMP)变化是线粒体功能障碍的主要事件[5]。因此,靶向线粒体途径有望成为抗肿瘤药物筛选的主要策略。重楼皂苷Ⅱ是从重楼中提取的天然三萜类活性成分,已有研究显示,多种三萜类化合物可促进癌细胞凋亡[6]。本研究观察重楼皂苷Ⅱ对人非小细胞肺癌A549细胞凋亡的影响,探讨其可能的作用机制。
1 材料与方法
1.1 药物和细胞
重楼皂苷Ⅱ,成都普菲德生物公司,纯度>98%,批号76296-72-5。人非小细胞肺癌A549细胞,中国科学院上海细胞库。
1.2 主要试剂与仪器
RPMI 1640培养基(货号MA0315)、FBS(货号PWL001)、青链霉素(货号MA0110)、CCK-8细胞存活率检测试剂盒(货号MAO218)、JC-10荧光探针(货号MB6097)、Fluo-4 AM钙离子荧光探针(货号MA0196)、DCFH-DA ROS荧光探针(货号MB4682)、Hoechst 33342染色剂(货号MB3210)和PBS(货号MA0015),大连美仑生物;Bax(货号5023S)、Bcl-2(货号3498S)、cleaved Caspase-3(货号9661S)和β-actin(货号8457S)一抗,美国CST公司。CO2培养箱(美国Thermo Scientific公司),倒置显微镜(德国徕卡),超净工作台(美国Thermo Scientific公司),纯水仪(美国Millipore公司),MQ05267多功能酶标仪(美国Molecular Devices公司),高内涵细胞分析仪(美国GE),电泳仪和转膜仪(美国Bio-Rad),Amersham Imager 600蛋白成像仪(美国GE)。
1.3 细胞培养及分组
A549细胞用含10%FBS和1%青链霉素的RPMI 1640培养基,置于37 ℃、5%CO2培养箱中培养,取对数生长期细胞进行实验。将细胞分为对照组和重楼皂苷Ⅱ低、中、高剂量组,根据细胞存活率检测结果,选择细胞存活率为50%(IC50)时的浓度作为中剂量,2倍IC50浓度为高剂量,1/2 IC50浓度为低剂量,每组设5个复孔。
1.4 细胞存活率测定
取对数生长期A549细胞,以5×l03个/孔细胞密度接种于96孔板中培养过夜;分别以终浓度为0.5、1、2、4、8、16、32、64 μmol/L重楼皂苷Ⅱ处理细胞48 h,另设对照组(有细胞,无药物干预)和空白孔(无细胞,只加入培养基);48 h后各孔加入10 μL CCK-8溶液培养1 h,于酶标仪波长450 nm处检测吸光度(OD值),计算细胞存活率。细胞存活率(%)=(实验组OD值-空白孔OD值)÷(对照组OD值-空白孔OD值)×100%。
1.5 线粒体膜电位检测
将A549细胞按5×103个/孔接种于96孔板中培养过夜,分别用低、中、高剂量重楼皂苷Ⅱ培养48 h;PBS洗涤2次,将JC-10试剂和Hoechst 33342染色液均以1∶200加入PBS中,配制JC-10工作液,每孔加100 μL JC-10工作液,37 ℃培养箱中避光孵育45 min,使用高内涵细胞分析仪分析数据并拍照,以红绿荧光比值计算MMP。
1.6 Ca2+水平检测
将A549细胞以5×103个/孔接种于96孔板中培养过夜,分别用低、中、高剂量重楼皂苷Ⅱ培养48 h;PBS洗涤2次,将Fluo-4 AM试剂和Hoechst 33342染色液分别以1∶800、1∶200加入PBS中,配制Fluo-4 AM工作液,每孔加100 μL工作液,37 ℃培养箱中避光孵育45 min,使用高内涵细胞分析仪分析数据并拍照,以绿色荧光强度表示Ca2+水平。
1.7 活性氧水平检测
将A549细胞以5×103个/孔接种于黑色透底96孔板中培养过夜,分别用低、中、高剂量重楼皂苷Ⅱ培养48 h;PBS洗涤2次,将DCFH-DA试剂和Hoechst 33342染色液分别以1∶1 000、1∶200加入PBS中配制DCFH-DA工作液,每孔加100 μL工作液,37 ℃培养箱中避光孵育45 min,多功能酶标仪于激发波长488 nm、发射波长530 nm处测量各孔OD值,计算ROS含量。
1.8 Western blot检测
取对数生长期A549细胞,以2×105个/mL密度接种于6孔板中培养过夜,分别用低、中、高剂量重楼皂苷Ⅱ培养48 h;RIPA裂解液冰上裂解,提取总蛋白,BCA法蛋白定量;按照上样浓度比例加入5×蛋白上样缓冲液,金属浴95 ℃、10 min使蛋白变性;经PAGE后转至PVDF膜,5%脱脂奶粉封闭1 h;用一抗稀释液按1∶1 000比例稀释Bax、Bcl-2、cleaved Caspase-3一抗,4 ℃孵育过夜;1×TBST洗涤3次,每次10 min;室温孵育二抗2 h,1×TBST洗涤3次,每次10 min,ECL成像采集图像,采用Image J软件对条带进行灰度分析。
1.9 统计学方法
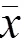
2 结果
2.1 重楼皂苷Ⅱ对A549细胞存活率的影响
与对照组比较,各浓度重楼皂苷Ⅱ显著降低细胞存活率(<0.01)。重楼皂苷Ⅱ浓度为1 μmol/L时,A549细胞存活率为50%,故选择1 μmol/L作为中剂量、2 μmol/L作为高剂量、0.5 μmol/L作为低剂量进行后续实验。结果见图1。
注:与对照组比较,**P<0.01,***P<0.001
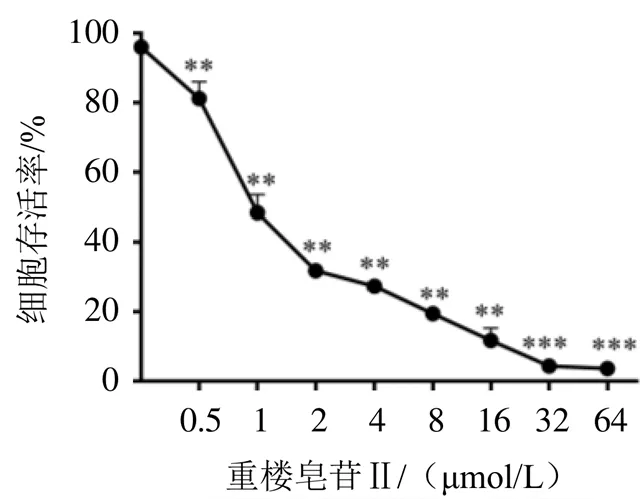
2.2 重楼皂苷Ⅱ对A549细胞线粒体膜电位的影响
当MMP正常时,JC-10聚集在线粒体基质中,形成聚合物,产生红色荧光;当MMP降低时,JC-10从线粒体基质释放到胞浆中,此时JC-10为单体,产生绿色荧光。结果显示,对照组红色荧光较强,表明MMP较高;与对照组比较,重楼皂苷Ⅱ低、中、高剂量组红色荧光减弱,绿色荧光增强,红绿荧光比值降低,提示MMP下降,差异有统计学意义(<0.05)。结果见图2。
注:A.对照组;B.重楼皂苷Ⅱ低剂量组;C.重楼皂苷Ⅱ中剂量组;D.重楼皂苷Ⅱ高剂量组;与对照组比较,*P<0.05,**P<0.01,***P<0.001
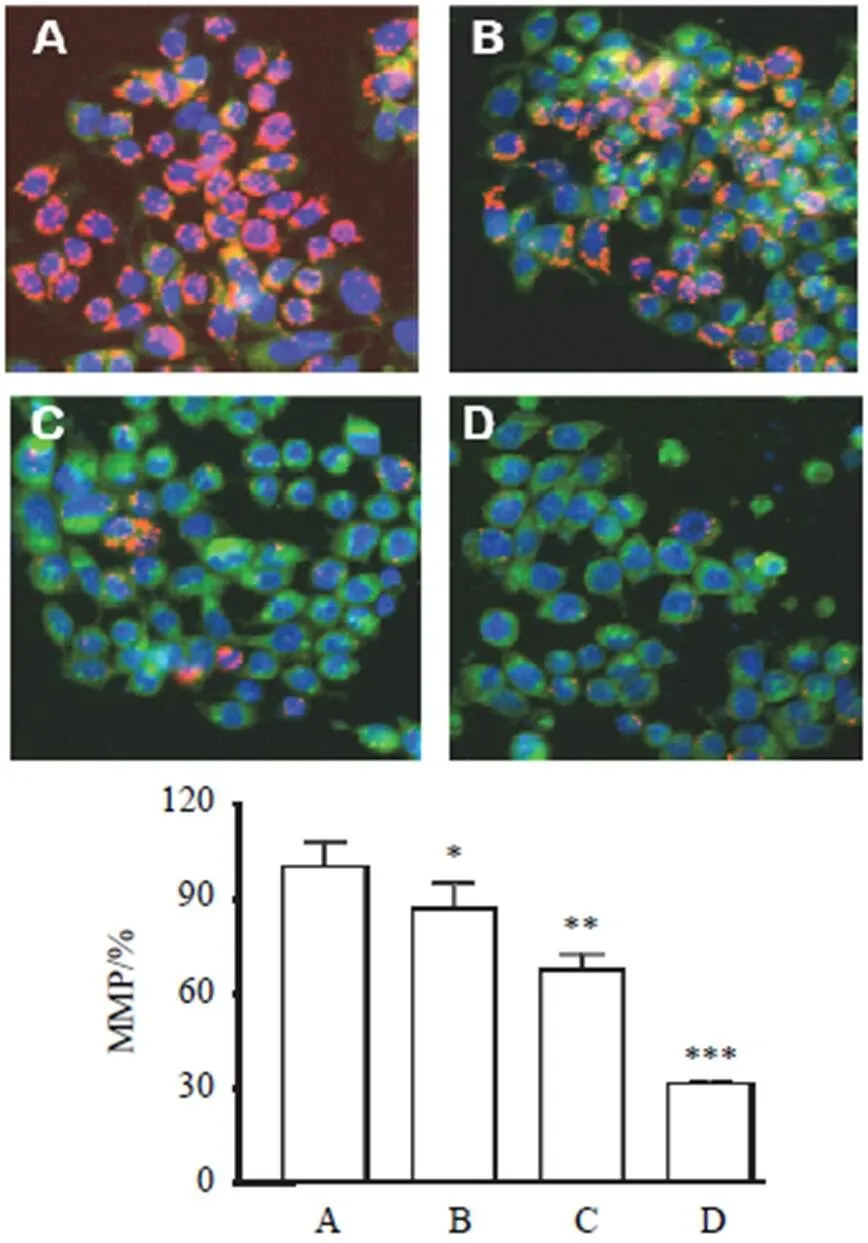
2.3 重楼皂苷Ⅱ对A549细胞Ca2+水平的影响
Fluo-4 AM进入细胞后被酯酶剪切形成Fluo-4,从而滞留在细胞内,Fluo-4可与细胞内的Ca2+结合,产生绿色荧光。结果显示,对照组绿色荧光较弱,表明Ca2+水平较低。与对照组比较,重楼皂苷Ⅱ低、中、高剂量组绿色荧光明显增强,细胞内Ca2+水平显著升高,差异有统计学意义(<0.001)。结果见图3。

注:A.对照组;B.重楼皂苷Ⅱ低剂量组;C.重楼皂苷Ⅱ中剂量组; D.重楼皂苷Ⅱ高剂量组;与对照组比较,***P<0.001
2.4 重楼皂苷Ⅱ对A549细胞活性氧含量的影响
与对照组比较,重楼皂苷Ⅱ中、高剂量组A549细胞ROS含量明显增加,差异有统计学意义(<0.01)。结果见图4。
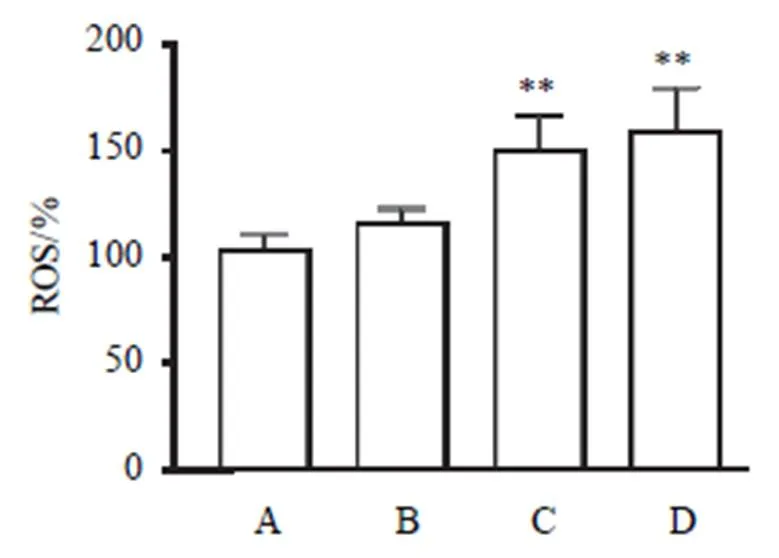
注:A.对照组;B.重楼皂苷Ⅱ低剂量组;C.重楼皂苷Ⅱ中剂量组; D.重楼皂苷Ⅱ高剂量组;与对照组比较,**P<0.01
2.5 重楼皂苷Ⅱ对A549细胞凋亡相关蛋白表达的影响
与对照组比较,重楼皂苷Ⅱ低、中、高剂量组Bcl-2蛋白表达显著降低,重楼皂苷Ⅱ中、高剂量组Bax蛋白表达显著升高,重楼皂苷Ⅱ低、高剂量组cleaved Caspase-3蛋白表达显著升高,差异均有统计学意义(<0.05,<0.01)。结果见表1、图5。
表1 各组A549细胞Bcl-2、Bax、cleaved Caspase-3蛋白表达比较(±s)
注:与对照组比较,*<0.05,**<0.01
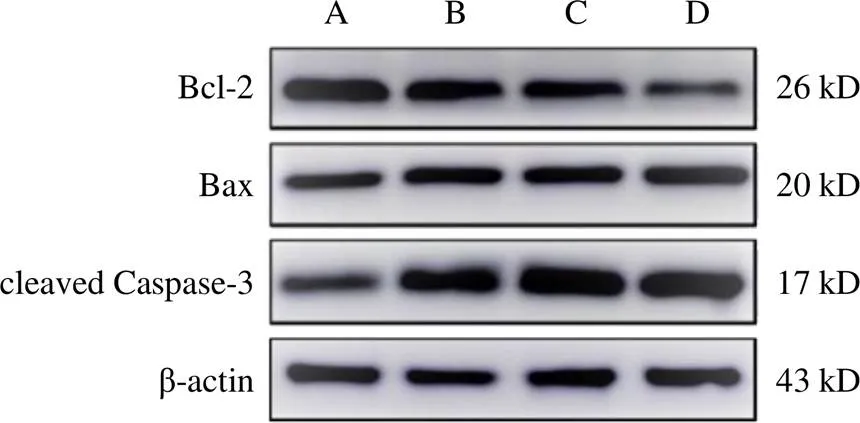
注:A.对照组;B.重楼皂苷Ⅱ低剂量组;C.重楼皂苷Ⅱ中剂量组; D.重楼皂苷Ⅱ高剂量组
3 讨论
肺癌当前以手术、化疗和放疗为主,但不良反应大。天然植物类抗肿瘤药物因其不良反应少成为研究热点[7]。有研究显示,重楼皂苷Ⅱ对膀胱癌[8]、肝癌[9]等具有一定作用。本研究通过体外实验探讨重楼皂苷Ⅱ对人非小细胞肺癌A549细胞的作用及相关机制。
CCK-8实验结果显示,重楼皂苷Ⅱ可降低细胞存活率,提示重楼皂苷Ⅱ可抑制A549细胞增殖,且随着药物浓度增加,抑制效果增强。当线粒体产生能量时,线粒体内膜将质子泵入内膜和外膜之间的空隙,导致大量质子积聚,形成质子梯度,并在两侧产生电位差,从而形成MMP,MMP是评价线粒体功能完整性的指标[10-11]。采用荧光染料JC-10检测MMP,结果显示,重楼皂苷Ⅱ处理后,A549细胞MMP降低,提示呼吸链受损,线粒体功能异常。线粒体能吸收并释放Ca2+,从而维持细胞正常功能,如新陈代谢、增殖和凋亡等[12]。Ca2+水平升高导致线粒体Ca2+超负荷,使线粒体外膜通透性增加,线粒体内的Ca2+释放到细胞质中,诱导线粒体功能障碍[13]。重楼皂苷Ⅱ处理后,细胞内Ca2+水平升高,导致线粒体肿胀、破裂,进而诱导细胞凋亡。低浓度ROS在细胞生理调节中起重要作用,高浓度ROS可产生毒性作用导致细胞死亡[14]。线粒体是产生ROS的主要场所,ROS水平升高可使线粒体膜通透性增加,促进细胞色素C释放,并激活Caspase级联反应,诱导细胞凋亡[15-16]。采用DCFH-DA荧光染料检测细胞内ROS含量,结果显示,重楼皂苷Ⅱ可增加A549细胞内ROS含量,提示重楼皂苷Ⅱ可使线粒体发生氧化应激反应。
凋亡是细胞程序性死亡的主要方式,在维持组织稳态中起重要作用[17]。Bcl-2家族蛋白在细胞凋亡中起重要调节作用,主要由抗凋亡因子Bcl-2和促凋亡因子Bax等组成。凋亡系统激活后,Bax和Bcl-2会在线粒体外膜上形成同型低聚体,并使细胞色素C释放进入细胞质,诱导Caspase激活[18]。本研究结果表明,重楼皂苷Ⅱ处理后,A549细胞促凋亡蛋白Bax和cleaved Caspase-3蛋白表达升高,抗凋亡蛋白Bcl-2蛋白表达降低,提示重楼皂苷Ⅱ可促进细胞凋亡。
综上所述,重楼皂苷Ⅱ可诱导细胞凋亡,其作用机制可能与降低A549细胞MMP,提高细胞内Ca2+水平,增加细胞内ROS含量,调节Bax、Bcl-2、cleaved Caspase-3蛋白表达有关。本研究为重楼皂苷Ⅱ用于NSCLC的辅助治疗提供了实验依据。
[1] BRAY F, FERLAY J, SOERJOMATARAMoer I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018,68(6):394-424.
[2] YU H, KIM Y M, CHO M. Cytoplasm-localized SIRT1 downregulation attenuates apoptosis and cell cycle arrest in cisplatin-resistant lung cancer A549 cells[J]. J Cancer,2020,11(15):4495-4509.
[3] LIU F Y, PEI S H, LI W Q, et al. Characterization of formononetin sulfonation in SULT1A3 overexpressing HKE293 cells:involvement of multidrug resistance-associated protein 4 in excretion of sulfate[J]. Frontiers in Pharmacology,2021.https://doi.org/10. 3389/fphar.2020.614756.
[4] NIU H T, LIU Y, WANG Y Z, et al. Columbamine-mediated PTEN/AKT signal pathway regulates the progression of glioma[J]. Cancer Management and Research,2021,13:489-497.
[5] TEMIZ E, KOYUNCU L, SAHIN E. CCT3 suppression prompts apoptotic machinery through oxidative stress and energy deprivation in breast and prostate cancers[J]. Free Radic Biol Med,2021,165:88-99.
[6] 刘洁,胡晶,戴娜,等.益气解毒方主要三萜类化合物抑制鼻咽癌CNE2细胞增殖效应的比较[J].湖南中医药大学学报,2019,39(11):1315-1320.
[7] 喻青青,樊旭,朱敏,等.重楼皂苷Ⅰ抗肝癌细胞作用的初步研究[J].中国免疫学杂志,2021,37(1):57-60.
[8] NIU W, XU L, LI J, et al. Polyphyllin Ⅱ inhibits human bladder cancer migration and invasion by regulating EMT-associated factors and MMPs[J]. Oncology Letters,2020,20(3):2928-2936.
[9] PANNG D J, YANG C C, LI C, et al. Polyphyllin Ⅱ inhibits liver cancer cell proliferation, migration and invasion through downregulated cofilin activity and the AKT/NF-κB pathway[J]. Biology Open,2020,9(2):bio046854.
[10] LIU F, ZHANG L, LI F, et al. A noteworthy interface-targeting fluorescent probe for long-term tracking mitochondria and visualizing mitophagy[J]. Biosens Bioelectron,2020,168:112526.
[11] BAGKOS G, KOUFOPOULOS K, PIPERI C. A new model for mitochondrial membrane potential production and storage[J]. Medical Hypotheses, 2014,83(2):175-181.
[12] WYRSCH P, BLENN C, PESCH T, et al. Cytosolic Ca2+shifts as early markers of cytotoxicity[J]. Cell Commun Signal,2013.https:// doi.org/10.1186/1478-811X-11-11.
[13] YANG Y, YANG X L, LI L, et al. LASS2 inhibits proliferation and induces apoptosis in HepG2 cells by affecting mitochondrial dynamics, the cell cycle and the nuclear factor‑κB pathways[J]. Oncol Rep,2019,41(5):3005-3014.
[14] MAILLET A, YADAV S, LOO Y L, et al. A novel osmium-based compound targets the mitochondria and triggers ROS-dependent apoptosis in colon carcinoma[J]. Cell Death Dis,2013,4:e653.
[15] CHENG M H, HUANG H L, LIN Y Y, et al. BA6 induces apoptosis via stimulation of reactive oxygen species and inhibition of oxidative phosphorylation in human lung cancer cells[J]. Oxid Med Cell Longev,2019,2019:6342104.
[16] KUZNETSOV A V, JAVADOV S, SAKS V, et al. Synchronism in mitochondrial ROS flashes, membrane depolarization and calcium sparks in human carcinoma cells[J]. Biochim Biophys Acta Bioenerg,2017,1858(6):418-431.
[17] O'NEILL K L, HUANG K, ZHANG J J, et al. Inactivation of prosurvival Bcl-2 proteins activates Bax/Bak through the outer mitochondrial membrane[J]. Genes & Development,2016,30:973-988.
[18] RAGHAV P K, KUMAR R, KUMAR V, et al. Docking-based approach for identification of mutations that disrupt binding between Bcl-2 and Bax proteins:inducing apoptosis in cancer cells[J]. Mol Genet Genomic Med,2019,7(11):e910.
Effects of Polyphyllin Ⅱ on Apoptosis of Human Non-Small Cell Lung Cancer A549 Cells
YOU Lijiao, SUN Fangyuan, YANG Xiaofang, GENG Huan, LEI Ming
To observe the effects of polyphyllin Ⅱ on human non-small cell lung cancer A549 cells; To explore its possible mechanism of action.Different concentrations of polyphyllin Ⅱ acted on A549 cells for 48 hours, and the cell survival rate was detected by CCK-8 method. A549 cells were divided into control group, polyphyllin Ⅱ low-, medium-, and high-dosage groups, and JC-10 fluorescent probe was used to detect MMP; Fluo-4 AM fluorescent probe was used to detect intracellular Ca2+level; DCFH-DA fluorescent probe was used to detect intracellular ROS level; Western blot was used to detect the protein expressions of Bax, Bcl-2, and cleaved Caspase-3 in cells.Compared with the control group, the survival rate of A549 cells in each polyphyllin Ⅱ group significantly decreased, with statistical significance (<0.01). The MMP of A549 cells was significantly reduced, the levels of Ca2+and ROS significantly increased, and the expression of Bcl-2 protein was significantly reduced in each polyphyllin Ⅱ group; protein expressions of Bax and cleaved Caspase-3 increased significantly in polyphyllin Ⅱ high-dosage group, with statistical significance (<0.05).Polyphyllin Ⅱ may promote A549 cell apoptosis by reducing cell MMP, increasing intracellular Ca2+level, increasing intracellular ROS content, and regulating apoptosis-related proteins Bcl-2, Bax, cleaved Caspase-3 expression.
non-small cell lung cancer; polyphyllin Ⅱ; A549 cells; mitochondria; apoptosis
R285.5
A
1005-5304(2021)10-0081-05
10.19879/j.cnki.1005-5304.202103001

国家自然科学基金面上项目(81973649);浦东新区卫生健康委员会领先人才培养项目(pwr12019-02);浦东新区卫生健康委员会学科建设项目(PWZy2020-07);浦东新区卫生健康委员会临床高原学科建设计划(PWYgy2018-01)
雷鸣,E-mail:leiming6891@163.com
(收稿日期:2021-03-01)
(修回日期:2021-03-20;编辑:郑宏)

