藏系绵羊Smo基因的克隆测序及其功能的细胞水平验证
郑玉才,于 淼,金素钰,黄 林
(西南民族大学畜牧兽医学院,四川 成都 610041)
藏系绵羊(Ovis aries)是中国青藏高原地区的重要家畜之一,基于外貌特征、生产性能可分为三种类型,包括高原型、山谷型和山地型[1].其中,高原型藏系绵羊的比例较高,其毛纤维质量好,是生产羊毛制品的优质原料[2].目前,有关高原型藏系绵羊绒毛生产性能已有一些报道[3],但对其绒毛性状的分子基础研究尚不多.研究藏系绵羊绒毛性状相关基因可为其选育提供科学依据,具有重要意义.
本实验以Hh(Hedgehog)信号通路为切入点,该通路是调控机体发育的一种重要通路[4],与毛囊发育相关.脊椎动物中Hh蛋白含有3种异构体(Dhh、Ihh和Shh),其中Shh为该家族中唯一能在毛囊中表达的成员,是Shh信号通路的重要成员,在毛囊发育中有关键作用[5-6].Smoothened(Smo)基因编码的Smo蛋白是一种G蛋白偶联受体,作为Shh信号通路中的受体之一而发挥重要作用[7].Smo基因的序列较保守,小鼠、人和绵羊Smo基因的编码区长度均在2 kb左右.目前GenBank中绵羊Smo基因仅有预测序列(XM_012131455.2),编码区长度2 342 bp,编码779个氨基酸.本研究设想Smo基因可影响Hh通路中的下游基因表达,影响藏系绵羊毛囊细胞的功能.本研究通过构建高原型藏系绵羊Smo基因的皮肤特异表达载体和干扰载体,通过转染体外培养的人内根鞘细胞,检测该基因对Hh通路下游靶基因(Gli1和Gsk3β)mRNA水平的影响,阐明该基因细胞水平的调控机制.
1 材料与方法
1.1 皮肤样品采集
样品采集于9月份.在四川省都江堰市郊区一个屠宰场,选取成年健康的高山型藏系绵羊(Ovis aries)母羊共5只,在屠宰30 min内采集腹部皮肤,剃除皮肤被毛后用液氮罐运送回实验室.样品于液氮中保存.
1.2 试剂及仪器
PfuDNA高保真聚合酶(Novoprotein公司),TaKa-Ra LA Taq with GC Buffer(TaKaRa公司),Thermo Scientific RevertAid First Strand cDNA Synthesis Kit(Thermo公司),Lipofectamine 3000 Transfection Reagent(Invitrogen公司),PCR一步定向克隆试剂盒(Novoprotein公司),BLOCK-iT PolⅡmiR RNAi Expression Vector Kit(ThermoFisher公司),pCDsRed2-KI真核载体为内蒙古大学生命科学学院刘东军教授惠赠,载体中有KAP6.1启动子、CMV启动子、红色荧光蛋白及Kan/neo抗性基因.IX71S8F型倒置荧光显微镜(Olympus公司),CFX 96荧光定量PCR仪(Bio-Rad公司).
1.3 Smo基因克隆测序
用Trizol试剂提取5只藏系绵羊的皮肤总RNA,并用核酸蛋白检测仪和琼脂糖凝胶电泳检测其浓度和质量.将1μg混合总RNA按PrimeScript RT-PCR kit反转录试剂盒说明,反转录为cDNA.
根据普通绵羊Smo基因的3个预测序列(XM_012131455.2、XM_012131456.2和XM_015095115.1)、小鼠和人的Smo基因序列(NM_176996、NM_005631),设计扩增藏系绵羊Smo基因的PCR引物(Smo-F:5′-TCTGCTGAGTTGGCGGGTTTG-3′,Smo-R:5′-TCCTTTCGTTGCAGGTCCTACTC-3′),预期产物长度2397 bp.PCR条件:95℃预变性5 min;95℃变性30 s,60℃退火45 s,72℃延伸3 min,共40个循环;72℃延伸5 min.25μL的PCR体系含0.5μL的cDNA、0.25μL的TaKaRa LA Taq.扩增产物用1.5 %琼脂糖凝胶电泳分离,胶回收后连接pMD-19T载体、转化感受态DH5α、进行阳性克隆的筛选,通过菌液PCR验证后,取5个阳性克隆(pMD19-Smo)由上海生工生物工程有限公司进行双向测序.结果用DNAMAN Version 6进行分析,并与绵羊、山羊和人的Smo基因序列比对.
1.4 皮肤特异表达载体pCDsRed2-KS构建
比对藏系绵羊Smo基因CDS区序列与pCDsRed2-KI序列,设计包含SalⅠ和KpnⅠ双酶切位点的PCR引物,具体如下:
F:5'-CCTCCTAGAGCAATCGTCGACTCTGCTGAGTTGGCGGGTTT-3'
R:5'-ATAACGCAGGAAAGAGGTACCTCAGAAG TCGGAGTCTGCATC-3'
序列中单下划线部分为载体序列,双下划线部分依次为SalⅠ和KpnⅠ酶切序列.预期扩增长度为2 387 bp.以上述包含藏系绵羊Smo基因的阳性克隆菌液为模板,用高保真PfuDNA聚合酶扩增Smo基因CDS区,琼脂糖凝胶电泳检测PCR产物后进行目的片段胶回收,进而与pCDsRed2载体连接、转化感受态细胞DH5α、筛选阳性克隆.对阳性克隆用上述引物进行菌液PCR鉴定,再进一步提取重组质粒进行SalⅠ和KpnⅠ双酶切鉴定.选取4个经鉴定的阳性克隆进行双向测序.
1.5 Smo基因干扰载体构建
用软件(www.invitrogen.com/rnai,Invitrogen公司)根据藏系绵羊、人Smo的基因序列(NM_005631),确定针对藏系绵羊Smo基因CDS保守区的3个长度均为21 bp干扰靶序列:靶序列1为5′-CATCATCTTTGTCATCGTGTA-3′,靶序列2为5′-CCATCCCTGACTGTGAGATCA-3′,靶序列3为5′-ATGAGGTGCAGAACATCAAGT-3′,几个序列分别在藏系绵羊Smo基因的533 bp、945 bp和1508 bp处.按线性化pcDNA6.2-GW/EmGFP-miR载体粘性末端序列和miR-155的结构特点,设计3对长度为64 bp互补核苷酸序列(图1中的Top strand和Bottom strand),此为用于干扰的前体miRNA(pre-miRNA),按BLOCK-iT PolⅡmiR RNAi Expression Vector Kit的说明,分别退火形成双链,稀释后连入该试剂盒提供的线性载体pcDNA6.2-GW/EmGFP-miR、转化感受态细胞DH5α、筛选阳性克隆.3个干扰载体中前体miRNA序列的上游有1个正向引物序列(编码绿色荧光蛋白),下游有1个反向引物序列,二者分别为:EmGFP-F:5′-GGCATGGACGAGCTGTACAA-3′、miRNA-R:5′-CTCTAGATCAACCACTTTGT-3′,PCR产物预期长度280 bp.用这对引物对筛选的阳性克隆进行菌液PCR鉴定,然后将各干扰载体阳性克隆菌液分别送3个进行双向测序.序列正确的克隆经扩大培养后,分别用小提质粒试剂盒提取干扰载体.
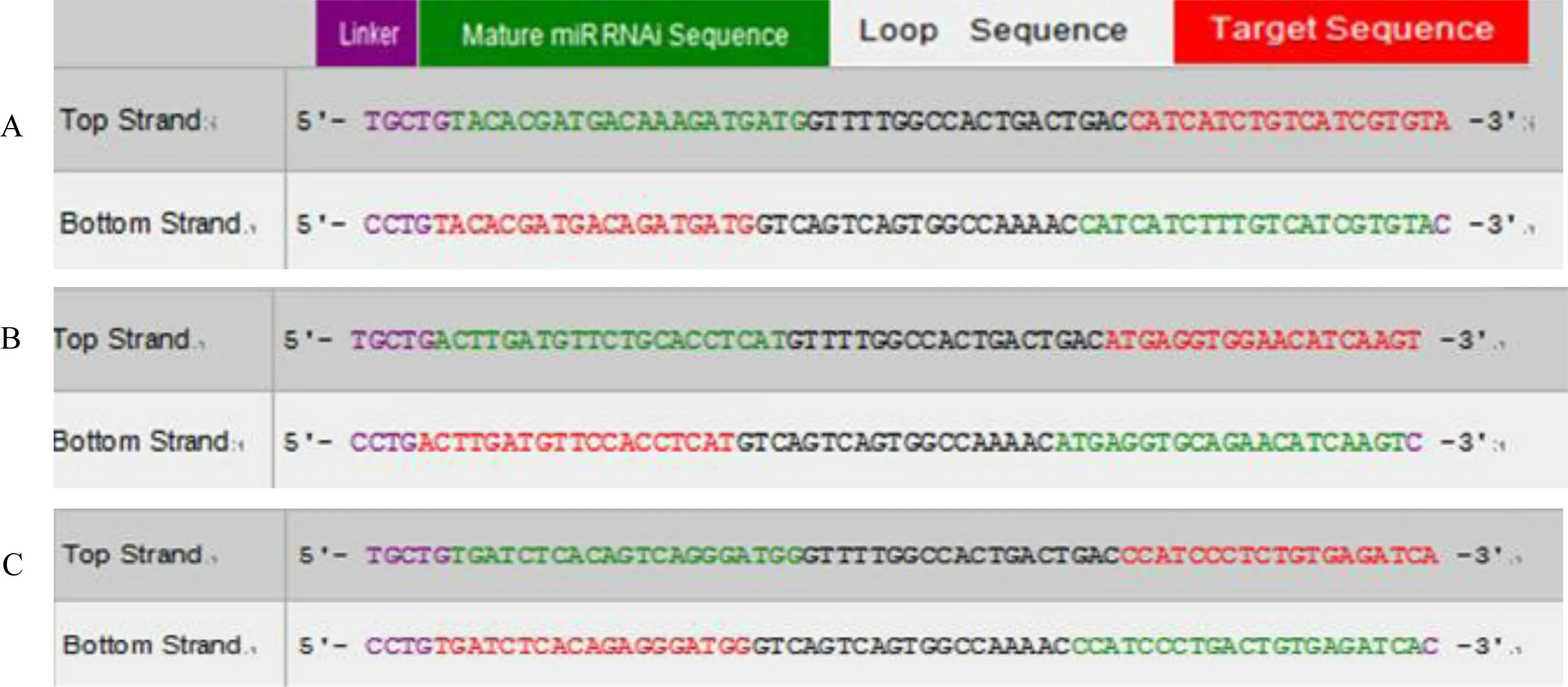
图1 前体miRNA核苷酸序列Fig.1 Sequence of pre-miRNA
A、B、C分别是与Smo基因靶序列1、2和3对应的前体miRNA序列;Top Strand表示质粒外侧链序列,Bottom Strand表示与Top Strand互补同时连接质粒内侧链的序列;Linker为连接载体粘性末端的序列,Mature miR RNAi Sequence为成熟的miRNA干扰序列,Loop Sequence为前体miRNA未配对的序列,Target Sequence为靶序列.
1.6 细胞转染及基因检测
人内根鞘细胞培养采用6孔板,包括空白组:不加质粒;超表达组:转染pCDsRED2-KS;干扰组:转染pcDNA6.2-GW/EmGFP-miRⅠ-Ⅲ,每组重复3孔.按每孔约5×106个内根鞘细胞接种(每组的细胞传代数相同),加3 mL间充质干细胞培养液(含10%胎牛血清),在37℃、5% CO2条件下培养细胞至80%~90%汇合.在转染前加入1.5 mL的opti-MEM培养液培养4 h后,用脂质体分别将表达载体pCDsRed2-KS和3个干扰载体pcDNA6.2-GW/EmGFP-miRⅠ-Ⅲ瞬时转染细胞,24 h后替换为无双抗的含10%胎牛血清的完全培养液3 mL,开始统计转染效率并继续培养,转染48 h后用Trizol试剂提取细胞总RNA.
细胞总RNA经质量、浓度检测后反转录成cDNA,用定量PCR检测Smo、Gli1、GSK3β基因及内参基因GAPDH的mRNA水平.定量PCR引物均参照Gen-Bank中人、绵羊相应基因的保守区设计(表1).定量PCR条件:95℃预变性3 min;95℃变性10 s,55℃~60℃(具体为表1中的退火温度)20 s,72℃15 s;共40个循环.65℃~95℃制作溶解曲线.每个样品做重复.定量PCR的模板和标准曲线制作采用的常规方法.

表1 定量PCR引物信息Table 1 Information of quantitative PCR primers
1.7 数据统计
试验数据用平均值±SD表示,获得的定量PCR数据用2-△△Ct方法分析基因的相对表达水平[8].3个基因的mRNA相对水平用SPSS18.0进行单变量方差分析,两两比较采用LSD法,P<0.05和P<0.01分别表示差异显著和极显著.
2 结果
2.1 藏系绵羊Smo基因的克隆测序
取藏系绵羊皮肤混合总RNA(1μg)反转录成cDNA,用克隆PCR引物进行扩增,产物大小为2 000~4 000 bp(图2,),再通过常规的基因克隆方法获得pMD19-Smo.测序表明藏系绵羊Smo长度为2 397 bp,CDS长度与普通绵羊Smo基因的预测序列(XM_012131455.2)相同,为2 342 bp,序列相似性达99.87%,编码779个氨基酸,两者仅相差3个碱基,其中1个导致692位丙氨酸变成丝氨酸.藏系绵羊与人Smo基因序列(NM_005631)的相似性约为90%;与预测的山羊Smo基因CDS序列(XM_018046943.1)长度一致,相似性为99.32 %,它们编码的氨基酸相似性为99.62 %.这提示Smo基因序列在进化上具有保守性.
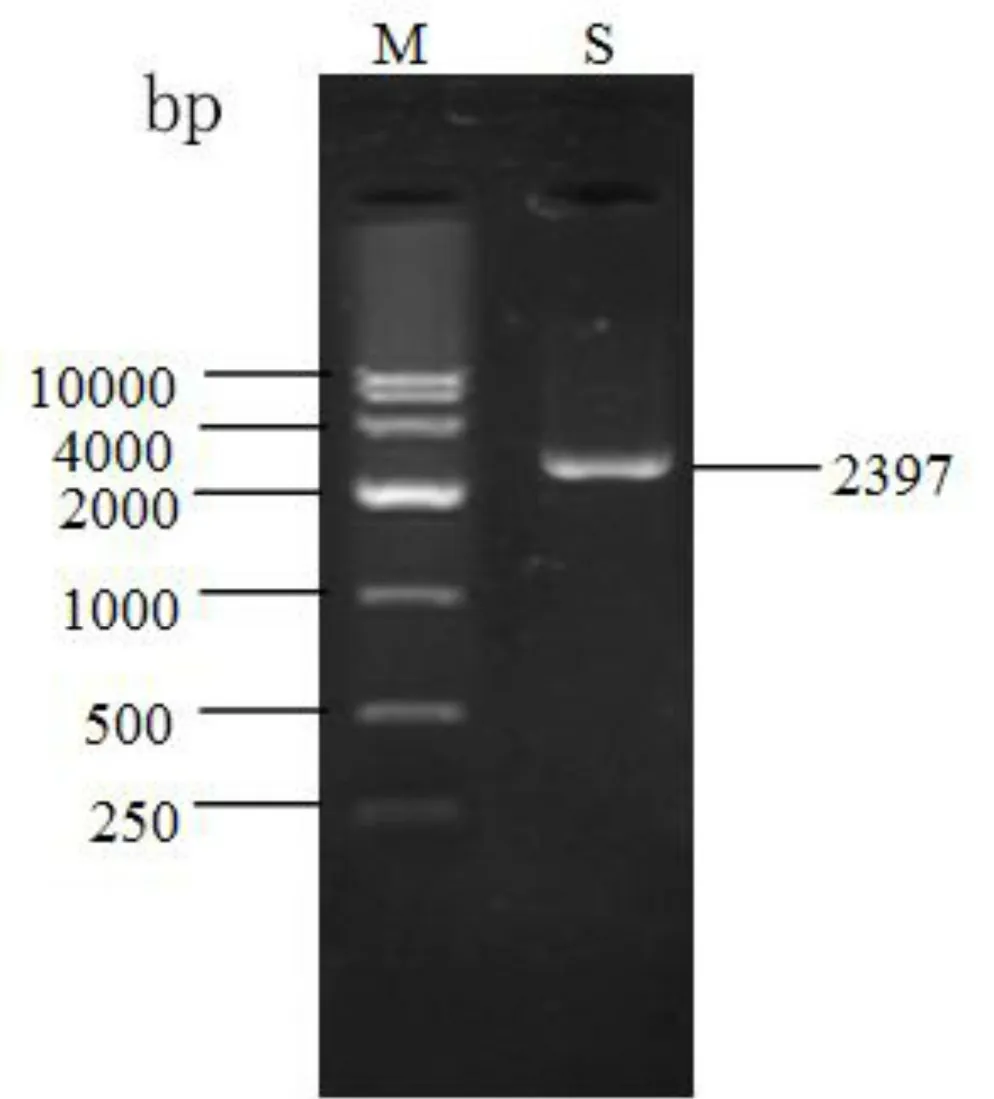
图2 藏系绵羊Smo基因PCR产物电泳图谱Fig.2 Electrophoresis of PCR product amplifying Tibetan sheep Smo geneM.DNA Marker DL10000,S.藏系绵羊Smo基因
2.2 藏系绵羊Smo基因皮肤特异表达载体构建
用含SalⅠ、KpnⅠ两个酶切位点的PCR引物,对含有pMD19-Smo基因的菌液进行扩增(图3A),PCR产物大小与预期相符(2 387 bp),表明获得了含双酶切位点的Smo基因片段.用此片段构建了含藏系绵羊Smo基因的皮肤特异表达载体pCDsRed2-KS,全长8 387 bp(图3B),阳性克隆经菌液PCR鉴定以及质粒的双酶切验证.进一步测序表明该载体中的藏系绵羊Smo基因CDS区核苷酸序列无突变.
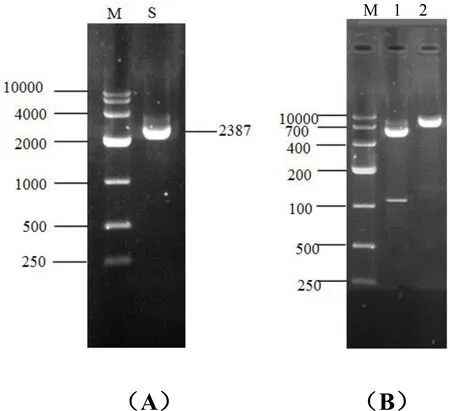
图3 含酶切位点PCR引物扩增Smo基因和pCDsRed2-KS载体的电泳图谱Fig.3 Electrophoresis of amplified products of Smo gene using PCR primers with digestion sites and vector pCDsRed2-KS
M为Marker(bp);A为Smo基因PCR产物;B显示pCDsRed2-KS构建,其中泳道1为pCDsRed2-KI载体SalⅠ和KpnⅠ双酶切产物,泳道2为构建的pCDsRed2-KS载体.
2.3 靶向藏系绵羊Smo基因的干扰载体构建
试验设计的3对干扰序列经连接、转化后,阳性克隆的菌液PCR显示产物长度与预期长度(280 bp)相符(图4).将干扰载体测序后表明,插入的片段与设计的64 bp核苷酸干扰序列完全相同,插入方向正确.表明设计合成的干扰序列已连入pcDNA 6.2-GW/EmGFP-miR载体.

图4 藏系绵羊干扰载体菌液PCR的琼脂糖凝胶电泳图Fig.4 Agarose gel electrophoresis of bacterial liquid PCR products of interference vectors of Tibetan sheepM.DNA Marker DL2000(bp),1~3分别为pcDNA 6.2-GW/EmGFP-miRⅠ~Ⅲ菌液PCR产物.
2.4 细胞的转染及基因表达分析
体外培养的人内根鞘细胞瞬时转染表达载体、干扰载体48 h后,用普通显微镜、荧光显微镜进行观察,发现转染效率均在约40%(图5).

图5 内根鞘细胞转染(100×)Fig.5 Cell transfection of HHIRSC
本研究建立了Smo、Gli1、GSK3β和GAPDH基因的定量PCR分析方法,标准曲线的线性良好(R2≥0.991),扩增效率高(E≥91%).结果显示:pCDsRed2-KS超表达组中Smo、Gli1、GSK3β基因mRNA水平均极显著高于未转染质粒的对照组(P<0.01),相差分别约5 900倍、95倍和20倍;转染了3个干扰载体pcDNA-miRⅠ、Ⅱ、Ⅲ的实验组,对Smo基因沉默效率分别约为98%、99%和98%,且Smo、Gli1和GSK3β基因mRNA水平极均显著低于对照组(图6,P<0.01).

图6干扰载体对体外培养的人毛囊内根鞘细胞中3个基因mRNA水平的影响Fig.6 mRNA levels of three genes in cultured HHIRSC transfected with interfering vectors
3 讨论
Smo蛋白是细胞膜上一种典型的G蛋白偶联受体,作为Hh通路中的一种受体在信号转导中发挥关键作用[7,9],可激活下游的配体Gli家族成员,后者作为Hh通路的最终转录因子,进入细胞核内促使靶基因转录[10].本研究首次从藏系绵羊皮肤中克隆了Smo基因的编码区序列,为进一步研究其功能奠定了基础.藏系绵羊Smo基因与普通绵羊Smo基因预测序列(XM_012131455.2)高度相似,相差的3个碱基中仅有1个为错义突变,但突变的氨基酸(692位丙氨酸变成丝氨酸)性质差异不大,推测不会对Smo蛋白的功能有影响.因此,藏系绵羊与普通绵羊Smo蛋白在性质、功能等方面可能相近.藏系绵羊Smo基因的研究对阐明Hh通路在毛囊中的作用有理论价值[5-6],而相关研究在绵羊上报道少.动物毛囊是具有周期性的器官,一个周期包括生长期、退行期和休止期.毛囊发育一直是家畜绒毛性状研究的热点.有研究表明,Shh通路对于胚胎毛囊形态发生是必需的[10].
基因的超表达和干扰是当前研究其功能的重要手段.本研究成功构建了藏系绵羊Smo基因的皮肤特异表达载体和干扰载体,可分别正向和负向调控Smo基因的表达.试验采用脂质体Lipofectamine 3000试剂将构建的载体转染体外培养的内根鞘细胞,获得约40%的转染效率,无需再进行细胞筛选即可检测转染前后基因表达变化.另外,本研究中细胞转染时间增加到24 h,推测这可能有助于提高转染效率.试验中表达载体转染内根鞘细胞48 h后,细胞中的Smo、Gli1、GSK3β基因mRNA水平均极显著增加,显示了它们在表达上的关联.配体Gli1是Hh信号通路最终的效应物[4],可反映该通路的活性,因此,通过调控Smo基因的表达,有望借助Hh信号通路而影响藏系绵羊毛囊细胞的功能.
miRNA是细胞内源性非编码小RNAs,参与基因表达的调控,具有结合mRNA导致相应基因沉默的作用[11-13].研究表明,miR-326就可抑制Smo和Gli基因的表达[14].在哺乳动物中约60%的编码蛋白质的基因受miRNA的调控[15],因此,利用miRNA干扰基因表达是研究基因功能的重要方法.本试验设计合成了3个特异识别藏系绵羊Smo基因mRNA的前体miRNA互补序列,采用pcDNA 6.2-GW/EmGFPmiR载体,构建了干扰效率高的载体,在细胞中可合成特异的miRNA而影响基因表达.本试验表明,转染体外培养的人内根鞘细胞后,Smo基因的mRNA水平极显著降低,同时,Gli1、GSK3β基因的mRNA水平亦极显著下降(图6),说明本实验构建的藏系绵羊Smo基因3个干扰载体均是有效的,并且,内根鞘细胞中Gli1、GSK3β基因与Smo基因mRNA水平相关.深入分析Hh信号通路中诸多基因的网络关系,是开展毛囊发育调控的基础.

