藏药秦艽花黄酮对DXMS模型小鼠红细胞免疫功能的影响
杨 悦,高如意,刘 群
(西南民族大学畜牧兽医学院,四川成都610041)
免疫制剂包括免疫增强剂、免疫抑制剂和免疫调节剂.实验免疫药理学研究常涉及到动物模型的建立.目前建立免疫抑制模型的方法有辐射损伤法、胸腺摘除法、免疫抑制剂诱导法和相关基因敲除法等.免疫抑制剂诱导法由于操作简单、成本较低,在免疫学研究中应用广泛.环磷酰胺和地塞米松是相关研究报道中应用最多的两类免疫抑制剂[1].红细胞通过其膜上的CR1(C3b受体)粘附抗原、抗原-抗体复合物实现其免疫功能[2-3].藏药秦艽花具有清热、解毒、退虚热、舒经络、祛风湿、利湿退黄等功效,临床上用于消化系统炎症的治疗[4-6].但目前对藏药秦艽花的化学成分及药理作用研究极少[7].本研究以乙醇回流提取的总黄酮为研究材料,DXMS(地塞米松)小鼠为研究对象,RBC-C3bRR、RBC-ICR、RBC-C3bER、RBC-C3bIR、RBC-C3bMφ、DTER为研究手段,探讨不同剂量秦艽花黄酮对地塞米松致免疫抑制小鼠红细胞免疫的调节作用,现将研究结果报告如下.
1 材料
1.1 研究药物
白花秦艽(GentianastramineaMaxim.)花采集于四川甘孜色达地区,由西南大学园艺园林学院李先源鉴定.室温通风干燥,避光保存.
1.2 实验动物
ICR小鼠,8周龄,雌雄各半,体重20 g±2 g/只.由成都达硕生物实验动物有限公司提供(SCXK(川)2015-030).
1.3 主要试剂及仪器
DXMS(2008204);左旋咪唑(20190101);豚鼠血清(北京索莱宝科技有限公司,1010M051);瑞氏染液(北京索莱宝科技有限公司,20201107);酵母菌冻干粉(西南民族大学畜牧兽医学院实验室提供,SWUN5700)等.光学显微镜(日本奥林巴斯公司,CX21FS1);离心机(四川蜀科仪器有限公司,TGL-16);超净工作台(济南鑫贝西生物技术有限公司,BBS-DDC)等.
2 方法
2.1 研究材料的制备
秦艽花总黄酮,参照李琦对藏药秦艽花总黄酮提取工艺[8],提取温度60℃、乙醇体积分数45%、提取时间30 min、液 料 比25∶1,总黄酮实际得率24.4 mg/g.按照生药浓度,将总黄酮配制成高200%(48.8 mg/mL)、中100%(24.4 mg/mL)、低50%(12.2 mg/mL)口服液,4℃冰箱保存备用.
2.2 实验动物分组及处理
ICR小鼠,120只,适应性饲喂7 d,随机分为6组,每组20只,雌雄各半(分笼饲养).各组处理:空白组,皮下注射灭菌生理盐水,同时灌胃生理盐水0.01 mL/g·d,连续14 d;DXMS组,皮下注射DXMS50mg/kg·d(5 mg/mL),同时灌胃生理盐水20 mL/kg·d,连续14 d;左旋咪唑组,皮下注射DXMS 50 mg/kg·d,同时灌胃左旋咪唑10 mg/kg·d(1 mg/mL),连续14 d;低剂量组,皮下注射DXMS 50 mg/kg·d,同时灌胃低剂量口服液0.01 mL/g·d(总黄酮浓度12.2 mg/mL),连续14 d;中剂量组,皮下注射DXMS 50 mg/kg·d,同时灌胃中剂量口服液0.01 mL/g·d(总黄酮浓度24.4 mg/mL),连续14 d;高剂量组,皮下注射DXMS 50 mg/kg·d,同时灌胃高剂量口服液0.01 mL/g·d(总黄酮浓度48.8 mg/mL),连续14 d.
2.3 红细胞悬液制备
在灌胃的第7 d、14 d后24 h,各组随机抽取10只小鼠,眼眶采后,肝素抗凝,制备红细胞悬液和血浆,4℃冰箱保存,待测.
2.4 检测指标
本文通过红细胞C3b受体酵母菌花环率(RBCC3bRR)、红细胞免疫复合物酵母菌花环率(RBCICRR)、红细胞免疫黏附促进/抑制因子花环率(RBC-C3bER/RBC-C3bIR)、红细胞C3b受体调节吞噬细胞吞噬功能试验(RBC-C3bMφ)所反映的吞噬率和吞噬指数以及肿瘤细胞花环率(DTER)来反映秦艽花黄酮对小鼠红细胞免疫功能的影响.其中,RBCC3bRR是红细胞C3b受体通过与C3b致敏的酵母菌粘附,使酵母菌吸附于周围而形成花环(C3bRR),C3bRR高低可反映红细胞C3b受体活性[9-11];RBC-ICRR是酵母菌通过其表面的酵母多糖与粘附于红细胞表面的免疫复合物中的补体成分C3b分子结合而形成ICRR,ICRR高低可反映红细胞C3b受体活性[9-11];血清中存在红细胞免疫调节抑制因子及促进因子,在进行红细胞C3b受体酵母菌花环试验时加入不同处理的新鲜血清,统计红细胞C3b受体花环抑制率(ERIR)及促进率(ERIR),从而评价红细胞免疫黏附促进因子与抑制因子活性[12];RBC-C3bMφ是将粘附有酵母菌(补体致敏酵母菌)的红细胞与吞噬细胞共同孵育,吞噬细胞吞噬酵母菌的吞噬百分率和吞噬指数反映吞噬细胞功能,间接反应红细胞C3b受体对吞噬细胞吞噬功能的调理作用[13];DTER是肿瘤细胞可旁路激活补体系统并粘附补体C3b,红细胞膜上的CR1能与肿瘤细胞表面的C3b发生免疫粘附,从而粘附肿瘤细胞达到抗肿瘤的作用[14].
2.5 数据处理
实验数据用平均数±标准差(x±s)表示,采用SPSS 26.0进行统计学分析.
3 结果与分析
3.1 RBC-C3bRR
各组小鼠在灌胃第7 d、14 d的红细胞C3b受体酵母菌花环率(RBC-C3bRR)见表1.
表1 红细胞C3b受体酵母菌花环率组间和组内比较( ±s,%,n=10)Table 1 Comparison of erythrocyte C3b receptor yeast rosette rate between and within groups(±s,%,n=10)

表1 红细胞C3b受体酵母菌花环率组间和组内比较( ±s,%,n=10)Table 1 Comparison of erythrocyte C3b receptor yeast rosette rate between and within groups(±s,%,n=10)
注:同列数据肩上标有相同小写字母表示组间差异不显著(P>0.05),标有不同小写字母表示组间差异显著(0.01<P<0.05),标有不同大写字母表示组间极显著差异(P<0.01);同列数据肩上标记为*表示组内差异不显著(P>0.05),标记为**表示组内差异显著(0.01<P<0.05),标记为***表示组内极显著差异(P<0.01).Note:The same lowercase letters on the shoulders of the data in the same column indicate that the difference between groups is not significant(P>0.05),the difference between lowercase letters indicates that the difference between groups is significant(0.01<P<0.05),and the difference between uppercase letters indicates extreme differences between groups significant difference(P<0.01);and the data in the same column is marked with*to indicate that the difference within the group is not significant(P>0.05),and the mark as**indicates that the difference within the group is significant(0.01<p>0.05),and the mark is marked as***to indicate very significant differences within the group(P<0.01).
组别 剂量(mg/mL) 7 d花环率(%) 14 d花环率(%)空白组 - 9.40±3.60Cc 16.10±4.41Cc***DXMS组 5 5.60±1.07DEde 13.40±2.37Cd***左旋咪唑组 1 13.30±2.58Bb 20.70±2.45Abb***低剂量组 12.2 4.10±0.74Ee 16.20±2.39Cc***中剂量组 24.4 17.10±3.70Aa 23.70±2.87Aa***高剂量组 48.8 7.80±1.40CDcd 19.90±2.73Bb***
小鼠连续皮下注射受试药物7 d后,与DXMS组RBC-C3bRR相比较,除低剂量受试药物组无明显差异外,其余各组均极显著增加,其中值得注意的是,高剂量受试药物组显著低于中剂量受试药物组.再连续皮下注射7 d,各组RBC-C3bRR均极显著增加,其中,三个剂量受试药物组数据均显著高于DXMS组,低剂量受试药物组和空白组相当.连续皮下注射7~14 d DXMS,小鼠RBC-C3bRR明显下降;给予7~14 d左旋咪唑,RBC-C3bRR有极显著增加;给予7~14 d不同剂量受试药物,RBC-C3bRR极显著增加,中剂量受试药物组最为明显.
实验结果表明,藏药秦艽花总黄酮具有增强小鼠红细胞C3b受体活性的作用并具有良好的时效关系,其中以生药浓度100%(总黄酮浓度24.4 mg/mL)作用尤为明显.
3.2 RBC-ICRR
各组小鼠在灌胃第7 d、14 d的红细胞免疫复合物花环率(RBC-ICRR)见表2.
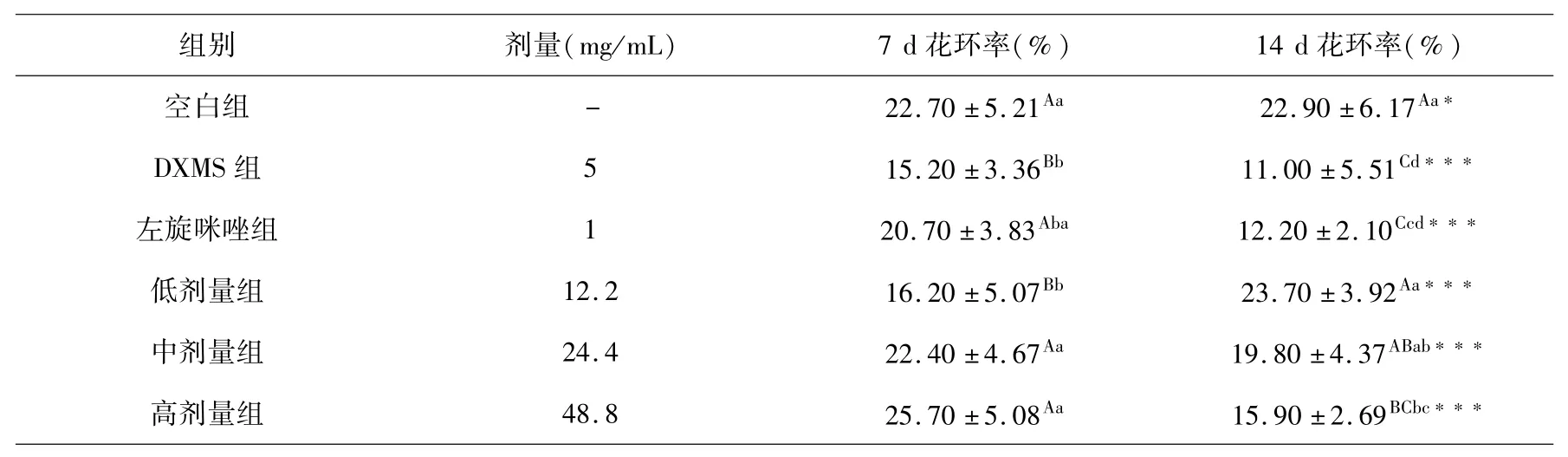
表2 红细胞免疫复合物花环率组间和组内比较(x ±s,%,n=10)Table 2 Comparison of rosette rate of red blood cell immune complex between and within groups(x ±s,%,n=10)
小鼠连续皮下注射受试药物7 d后,与DXMS组RBC-ICRR相比较,除低剂量受试药物组没有明显差异无统计意义外,其余各组均极显著高于DXMS组.再连续皮下注射和治疗7 d,DXMS组、左旋咪唑组和高剂量组RBC-ICRR均极显著下降,低剂量组极显著上升,中剂量受试药物组没有明显差异;其中DXMS组、左旋咪唑组均极显著低于空白组,低剂量组与空白组相当,中、高剂量受试药物组显著低于空白组,但均极显著大于左旋咪唑组和DXMS组.连续皮下注射7~14 d DXMS,小鼠RBC-ICR明显下降;给予7~14 d左旋咪唑,RBC-ICR先后呈上升和下降趋势;给予7~14 d不同剂量受试药物,低、中剂量药物组RBC-ICR极显著增加且极显著大于DXMS组的RBC-ICR而与正常小鼠相当.
实验结果表明,藏药秦艽花总黄酮具有拮抗DXMS引起的小鼠红细胞免疫复合物花环率下降的作用,其中以生药浓度50%~200%(总黄酮浓度12.2~48.8 mg/mL)作用更为明显.
3.3 ERER
各组小鼠在灌胃第7 d、14 d的红细胞C3b受体花环促进率(ERER)结果见表3.
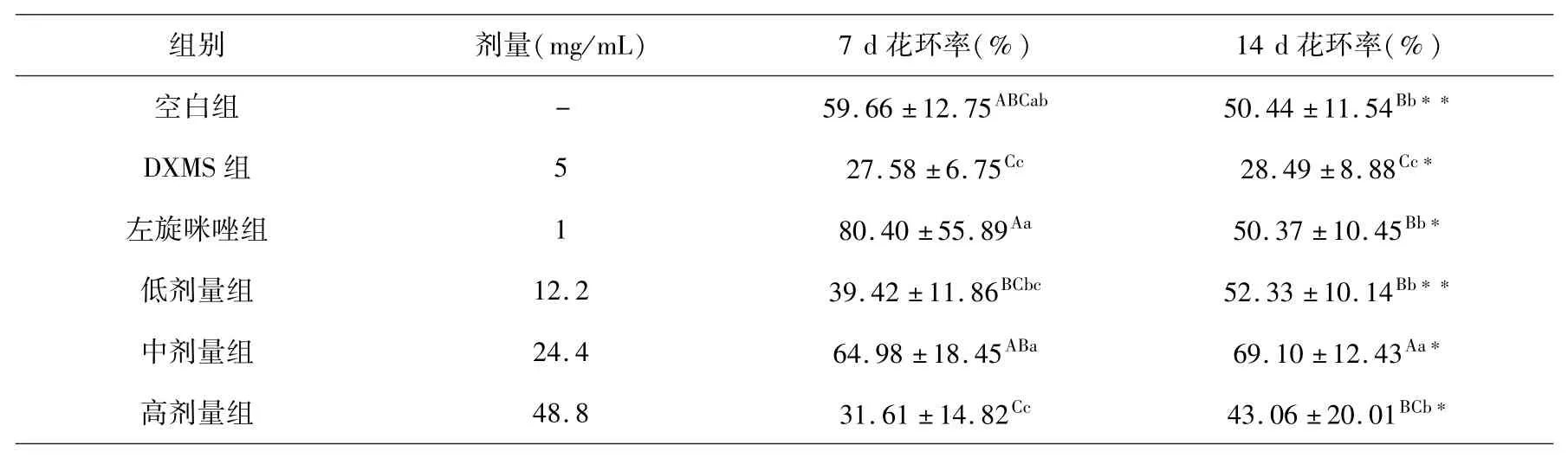
表3 红细胞C3b受体花环促进率组间和组内比较(x ±s,%,n=10)Table 3 Comparison of the promotion rate of red blood cell C3b receptor rosette betweenand within groups(x ±s,%,n=10)
小鼠连续皮下注射受试药物7 d后,与DXMS组ERER相比较,空白对照组显著升高,左旋咪唑组和中剂量受试药物组极显著性升高,低剂量受试药物组虽然无统计学意义,但绝对平均值增大,值得注意,高剂量受试药物组绝对平均值降低.再连续皮下注射7 d,DXMS组、左旋咪唑组和中、高剂量受试药物组均无统计学意义,低试剂量药物组极显著增加;其中左旋咪唑组和高剂量组极显著高于DXMS组并与空白对照组相当,低剂量受试药物组与左旋咪唑组相当,中剂量受试药物组极显著增加且高于空白组.连续皮下注射7~14 d DXMS,小鼠ERER下降;给予7~14 d左旋咪唑,ERER增加并达到正常小鼠水平;给予7~14 d不同剂量受试药物,ERER极显著增加,尤其是低、中剂量受试药物更为明显.
实验结果表明,藏药秦艽花总黄酮具有拮抗DXMS引起的小鼠血清红细胞免疫调节促进因子低下的作用,其中以生药浓度50%~100%(总黄酮浓度12.2~24.4 mg/mL)作用更为明显.
3.4 ERIR
各组小鼠在灌胃第7 d、14 d的红细胞C3b受体花环抑制率(ERIR)结果见表4.
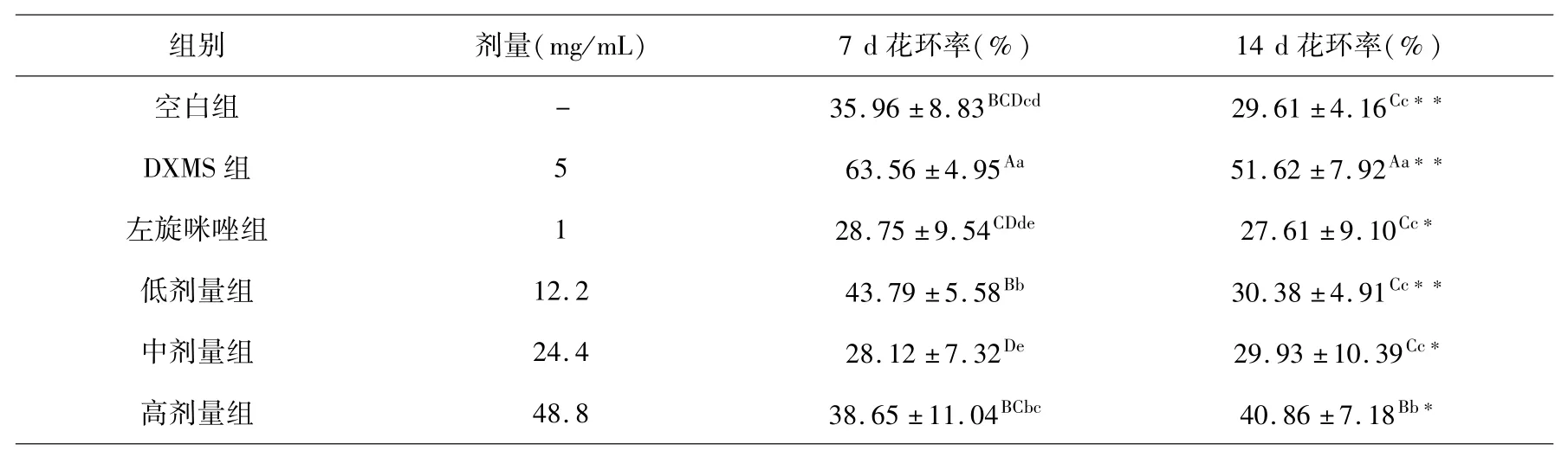
表4 红细胞C3b受体花环抑制率组间和组内比较(x±s,%,n=10)Table 4 Comparison of the inhibition rate of red blood cell C3b receptor rosette between and within groups(x±s,%,n=10)
小鼠连续皮下注射受试药物7 d后,与DXMS组ERIR相比较,空白组、左旋咪唑组和中剂量受试药物均极显著性低下,低剂量受试药物组虽然高于空白对照组,但极显著低于DXMS组,高剂量受试药物组虽有所增加,但仍低于DXMS组.再连续皮下注射7 d,空白对照组、DXMS组有所下降、左旋咪唑组和中、高受试剂量药物组变化不大,低剂量受试药物极显著下降;左旋咪唑组和低、中剂量受试药物组均极显著低于DXMS组而与空白组相当,高剂量受试药物ERIR虽然显著升高,但仍极显著低于DXMS组.连续皮下注射7~14 d DXMS,小鼠ERIR升高;给予7~14 d左旋咪唑,ERIR降低并达到正常小鼠水平;给予7~14 d不同剂量受试药物,ERIR显著降低,尤其是低、中剂量受试药物更为明显.
实验结果表明,藏药秦艽花总黄酮具有降低DXMS引起的小鼠血清红细胞免疫调节抑制因子升高的作用,其中以生药浓度50%~100%(总黄酮浓度12.2~24.4 mg/mL)作用更为明显.
根据红细胞C3b受体花环促进与抑制试验原理,综合“3.3、3.4”实验结果分析,藏药秦艽花总黄酮通过提高血清红细胞免疫促进因子的活性和降低抑制因子的活性达到提高红细胞C3b受体活性.
3.5 红细胞调节吞噬细胞吞噬功能试验
各组小鼠在灌胃第7 d、14 d的红细胞调节吞噬细胞吞噬功能结果见表5、6.
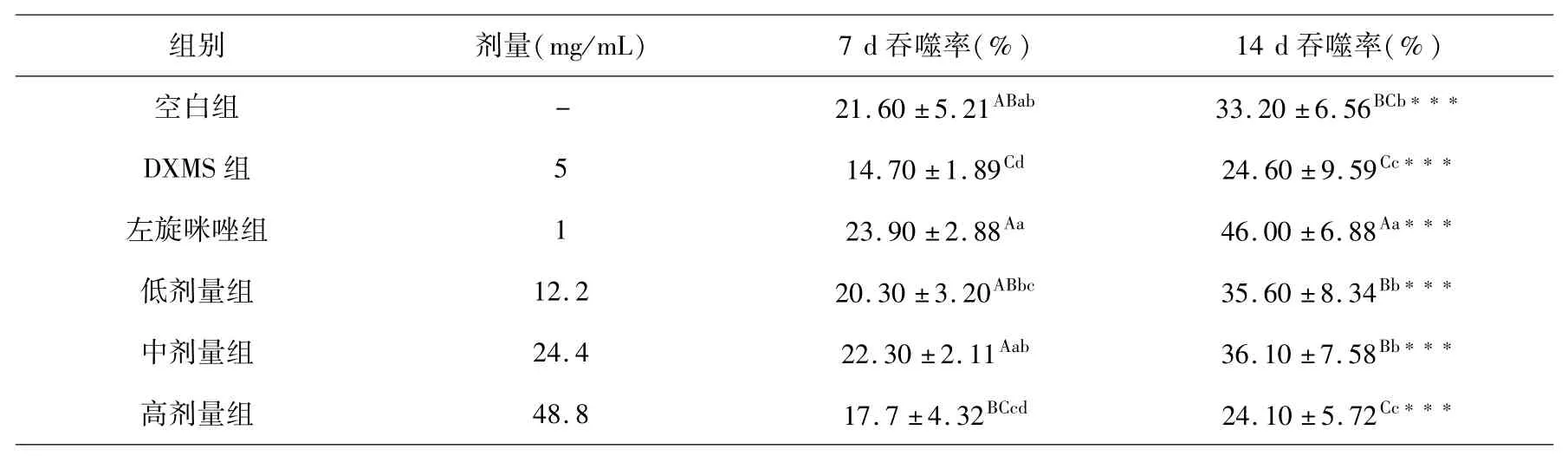
表5 吞噬百分率组间和组内比较(x ±s,%,n=10)Table 5 Comparison of phagocytosis percentage between and within groups(x ±s,%,n=10)
小鼠连续皮下注射受试药物7 d后,与DXMS组巨噬细胞吞噬百分率相比较,空白组、左旋咪唑组和低、中剂量受试药物组均极显著性升高.再连续皮下注射7 d,各组吞噬百分率具有极显著增加;其中左旋咪唑组吞噬百分率极显著高于DXMS组、空白对照组;低、中剂量药物组吞噬百分率虽低于左旋咪唑组,但均极显著高于DXMS组.连续皮下注射7~14 d DXMS,小鼠巨噬细胞吞噬百分率下降;给予7~14 d左旋咪唑,巨噬细胞吞噬百分率增加并高于正常小鼠水平;给予7~14 d不同剂量受试药物,巨噬细胞吞噬百分率极显著增加,尤其是低、中剂量受试药物更为明显.
实验结果表明,藏药秦艽花总黄酮具有拮抗DXMS引起的小鼠巨噬细胞吞噬活性下降的作用,其中以生药浓度50%~100%(总黄酮浓度12.2~24.4 mg/mL)作用更为明显.
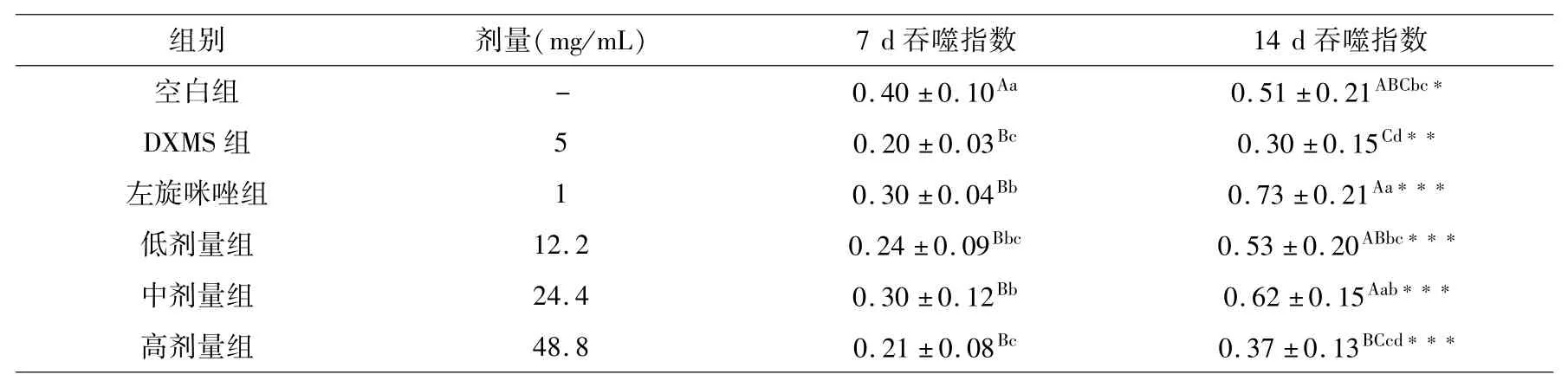
表6 吞噬指数组间和组内比较(x ±s,%,n=10)Table 6 Comparison of phagocytic index between and within groups(x ±s,%,n=10)
小鼠连续皮下注射受试药物7 d后,与DXMS组巨噬细胞吞噬指数相比较,空白组、左旋咪唑组吞噬指数显著性升高;低、中剂量受试药物组虽然吞噬指数低于空白对照组,但显著高于DXMS组,高剂量受试药物组吞噬指数与DXMS组相当.再连续皮下注射7 d,其左旋咪唑组和三个受试剂量受试药物组吞噬指数均极显著增加.低、中剂量药物组吞噬指数虽低于左旋咪唑组,但极显著高于DXMS组.连续皮下注射7~14 d DXMS,小鼠巨噬细胞吞噬指数下降;给予7~14 d左旋咪唑,巨噬细胞吞噬指数增加并高于正常小鼠水平;给予7~14 d不同剂量受试药物,巨噬细胞吞噬指数极显著增加,尤其是低、中剂量受试药物更为明显.
实验结果表明,藏药秦艽花总黄酮具有拮抗DXMS引起的小鼠巨噬细胞吞噬指数下降的作用,其中以生药浓度50%~100%(总黄酮浓度12.2~24.4 mg/mL)作用更为明显.
根据红细胞调节吞噬细胞吞噬功能试验原理,综合上述分析,藏药秦艽花总黄酮通过促进红细胞C3b受体活性达到提高吞噬细胞的吞噬活性和增强吞噬细胞的吞噬能力.
3.6 肿瘤细胞花环试验
各组小鼠在灌胃第7 d、14 d的红细胞C3b受体肿瘤细胞花环率(DTER)结果见表7.
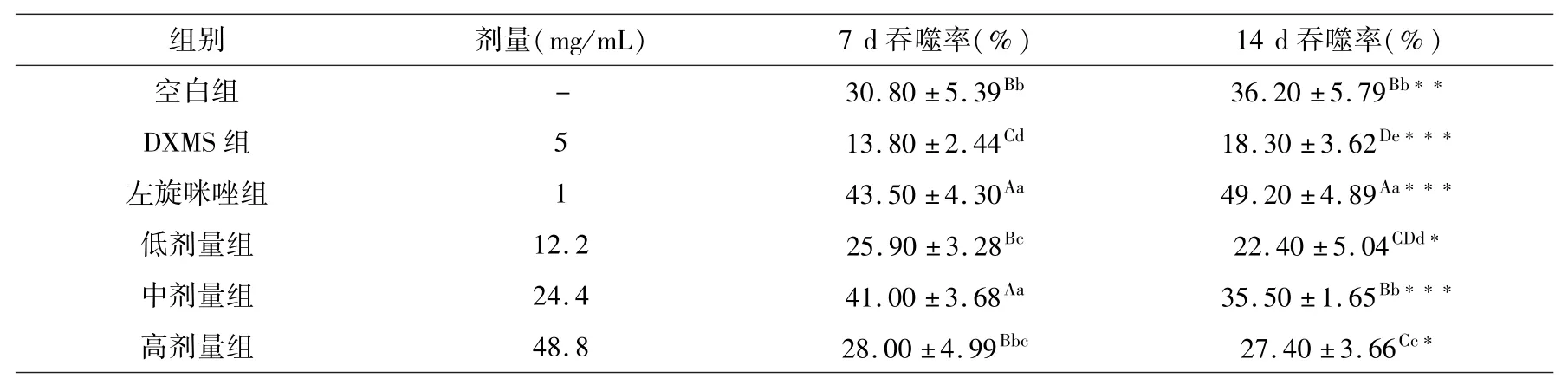
表7 肿瘤细胞花环率组间和组内比较(x ±s,%,n=10)Table 7 Comparison of tumor cell rosette rate between and within groups(x ±s,%,n=10)
小鼠连续皮下注射受试药物7 d后,与DXMS组DTER相比较,空白组、左旋咪唑组和低剂量受试药物组均极显著性升高且左旋咪唑组极显著大于空白组和低剂量受试药物组;中剂量受试药物组极显著高于低剂量受试药物,高剂量受试药物组虽下降,但仍极显著高于DXMS组而与空白对照组相当.再连续皮下注射7 d,DXMS组、左旋咪唑组增加,中剂量药物组降低;三个受试剂量药物组虽低于左旋咪唑组,但极显著高于DXMS组,其中中剂量药物组DTER与空白组相当.连续皮下注射7~14 d DXMS,DTER下降;给予7~14 d左旋咪唑,DTER增加并高于正常小鼠水平;给予7~14 d不同剂量受试药物,DTER极显著增加,尤其是中剂量受试药物更为明显.
实验结果表明,藏药秦艽花总黄酮具有拮抗DXMS引起的DTER下降的作用,其中以生药浓度100%(总黄酮浓度24.4 mg/mL)作用更为明显.
4 讨论
1981年,Siegel等突破红细胞只具有运输O2和CO2的传统认识,提出了“红细胞免疫系统”(RCIS)概念并认为红细胞免疫功能的发挥主要是通过红细胞免疫黏附的方式体现[15].红细胞存在有许多与免疫有关的物质,如CR1/3/58/59、LFA-3、DAF、HRF、CD58+、CD59+、IL-8受体和SOD等,数目众多,因而具有识别、粘附、浓缩、杀伤抗原、清除循环免疫复合物(circle immune complex,CIC)的作用而自成系统,参与机体的免疫调控,是机体免疫系统不可分割的重要组成部分,数目众多,自成系统[15-20].红细胞免疫功能主要是通过免疫黏附作用(RCIA)来实现的,故能识别、黏附和运输循环“抗原-抗体-补体”复合物至肝脾清除,其物质基础是红细胞膜上的CR1(C3b受体)[21].血循环中C3b受体总数的95%以上是存在于红细胞膜上,且呈簇状分布的结合位点并具多价性,有利于抗原物质牢固结合,因此将红细胞膜上的C3b受体活性和数量作为重要的指标来评价红细胞免疫功能[22-23].
红细胞免疫功能检测包括红细胞免疫黏附、自我调控以及对其他免疫细胞调控能力三个方面.目前,国内外评价红细胞的免疫功能主要是通过测定红细胞的免疫粘附(RCIA)活性来实现.本研究以乙醇辅助提取秦艽花黄酮为研究材料,DXMS(地塞米松)致免疫抑制小鼠为研究对象,通过RBC-C3bRR、RBC-ICRR、RBC-C3bER/RBC-C3bIR、RBC-C3bMφ、DTER,探讨藏药秦艽花总黄酮对机体红细胞免疫功能的影响,研究结果表明:连续注射7~14 d DXMS,红细胞C3b受体活性下降,红细胞免疫复合物花环率下降、血清红细胞免疫调节促进因子活性低下、血清红细胞免疫调节抑制因子活性升高、调理吞噬细胞的吞噬作用下降、肿瘤细胞花环率下降,说明DXMS导致机体红细胞功能低下;给予7 d~14 d的秦艽花黄酮,小鼠红细胞C3b受体酵母花环率上升、免疫复合物花环率上升、红细胞C3b受体肿瘤细胞花环率上升,说明藏药秦艽花总黄酮具有增强小鼠红细胞C3b受体活性的作用(生药浓度100%、总黄酮浓度24.4 mg/mL作用明显);血清红细胞C3b受体促进因子花环率上升、血清红细胞C3b受体抑制因子花环率降低,说明藏药秦艽花总黄酮具有增强促进因子活性和降低抑制因子活性的作用(生药浓度50%~100%、总黄酮浓度12.2~24.4 mg/mL作用明显);秦艽花总黄酮能使DXMS引起的小鼠腹腔巨噬细胞低下的吞噬百分率和吞噬指数增大,说明藏药秦艽花总黄酮通过促进红细胞C3b受体活性达到提高吞噬细胞的吞噬活性和增强吞噬细胞的吞噬能力(生药浓度50%~100%、总黄酮浓度12.2~24.4 mg/mL作用明显).
5 小结
藏药秦艽花总黄酮(12.2~24.4 mg/mL)通过提高血清红细胞免疫促进因子的活性和降低抑制因子的活性达到提高红细胞C3b受体活性,实现其促进红细胞免疫粘附功能和增强吞噬细胞吞噬功能的作用.

