基因Ⅶ型新城疫病毒F基因DNA及亚单位疫苗细胞免疫效果评估
李 乐,孙军峰,陈林娜,师乾凯,邸 涛,刘添仪,赵 冉,张春玮,韩宗玺,刘胜旺 (中国农业科学院 哈尔滨兽医研究所 禽呼吸道传染病创新团队 兽医生物技术国家重点实验室,黑龙江 哈尔滨150069)
新城疫(Newcastle disease,ND)是由新城疫病毒(Newcastle disease virus,NDV)引起的禽类的一种以呼吸道、消化道损伤为典型特征的急性、高度接触性传染病[1]。根据国际病毒分类委员会(ICTV)最新报告,NDV属于副黏病毒科(Paramyxoviridae),禽腮腺炎病毒亚科(Avulavirinae),正禽腮腺炎病毒属(Orthoavulavirus),正禽腮腺炎病毒1型(Avinaorthoavulavirus1)。NDV基因组长度分别有15 186,15 192,15 198 nt 3种类型,基于基因组大小和融合蛋白(F)基因的系统发育分析,NDV可分为ClassⅠ和ClassⅡ 两大类,分别进一步分为1.1.1(1a)、1.1.2(1b)、1.2(1c+1d)型和Ⅰ-ⅩⅪ型[2]。自20世纪50年代以来,疫苗广泛应用于该病的防控,在全世界范围内极大地降低了NDV引起的临床疾病所造成的经济损失。中国采用了广泛且严格的免疫政策用于ND的预防,其中使用最广泛的NDV疫苗株属于ClassⅡ类基因Ⅱ型。而20世纪90年代开始,ClassⅡ类中的基因Ⅶ型NDV强毒株在免疫鸡群和鹅群中持续存在,并引起了疾病的发生[3-4]。流行的基因Ⅶ型强毒株与基因Ⅱ型疫苗株之间的遗传和抗原性差异被认为是导致强毒株在免疫鸡群中存在并引发疾病的主要原因[5-6],因此,需要开发新型疫苗用于基因Ⅶ型NDV的防控。
活疫苗、灭活疫苗、病毒载体疫苗和基因工程疫苗等众多类型的疫苗被用于保护家禽免受NDV的感染[7-8]。常规的活疫苗、灭活疫苗和病毒载体疫苗通常需要将病毒接种鸡胚或易感细胞,需要在适当的生物安全条件下进行,且费时费力。活疫苗能够诱导体液和细胞免疫,但其在雏鸡中的免疫效果容易受到母源抗体的干扰。灭活疫苗通常用于加强免疫,能够诱导产生高水平的体液免疫,但清除病毒感染的能力较差。而病毒载体疫苗诱导产生保护力所需的时间较长,限制了其在现地应用[7]。基于目前所使用的疫苗存在的问题以及我国针对ND防控的政策要求,迫切需要研制新型NDV疫苗。基因工程疫苗是一种可靠的选择,其中DNA疫苗相较于传统疫苗具有稳定性和安全性高、不存在毒力返强的隐患、易于大量制备等优势,另外,利用体外表达系统表达的病毒蛋白作为亚单位疫苗也能够刺激机体产生特异性的保护性免疫。近年来研究表明,用DNA疫苗进行首次免疫,用蛋白亚单位疫苗进行加强免疫所诱导的免疫反应效果更确实[9-10]。NDV具有血凝素神经氨酸酶(HN)和F蛋白两种囊膜糖蛋白,二者对病毒的感染和致病性是至关重要的。HN和F蛋白均能够诱导针对NDV的保护性免疫,其中F蛋白诱导产生中和抗体和保护性免疫的能力要优于HN[11]。以含有NDV F基因的质粒作为DNA疫苗以及重组F蛋白作为亚单位疫苗已有研究报道。目前所构建的DNA疫苗大多采用病毒自身的F基因序列,病毒与宿主的密码子偏好性之间的差异可能会导致DNA疫苗所编码的蛋白不能在自然宿主体内高效表达,从而影响其诱导的免疫反应水平。体外表达F蛋白所采用的系统主要为大肠杆菌、酵母和昆虫细胞表达系统,由于上述系统不能进行有效的糖基化修饰,导致表达的F蛋白不能或仅能发生部分糖基化修饰,从而影响F蛋白的免疫原性[12-13]。此外,细胞免疫同样参与针对NDV感染的保护,可能有助于机体清除体内的病毒[14]。目前,以F基因的表达质粒作为DNA疫苗以及重组F蛋白作为亚单位疫苗免疫后是否能够诱导产生细胞免疫尚未有详细报道。
本研究对基因Ⅶ型NDV毒株F基因进行密码子优化,使其适合在鸡体内表达;将优化的基因克隆至高效真核表达载体中,获得了表达基因Ⅶ型NDV毒株F蛋白的真核表达质粒pCAF。将其转染至悬浮培养的真核细胞进行表达,制备重组proF蛋白并进行纯化;将质粒pCAF和proF作为DNA疫苗和亚单位疫苗,以不同程序免疫雏鸡后评估诱导的细胞免疫水平,以期为开发新型的NDV疫苗提供理论基础。
1 材料与方法
1.1 质粒和细胞含有鸡肌动蛋白启动子和增强子元件的真核表达载体pCAGGS由本实验室保存;Expi293F细胞由本实验室保存培养,培养基为无血清的Expi293 expression medium。
1.2 实验动物SPF雏鸡购自中国农业科学院哈尔滨兽医研究所国家禽类实验动物资源库。
1.3 主要试剂高保真聚合酶KOD-Plus-Neo购自TOYOBO公司;限制性内切酶购自NEB公司;In-Fusion HD Cloning Kit、DL5000 DNA Marker、E.coliDH5α感受态细胞、pMD18-T购自TaKaRa公司;鸡外周血淋巴细胞分离液 (P8730-200)、刀豆蛋白A (ConA)购自北京索莱宝科技有限公司;胎牛血清、RPMI-1640细胞培养基购自HyClone公司;Expi293 expression medium及其ExpiFecTamine293转染试剂盒购自美国Thermo Fisher Scientific公司;Bradford蛋白分析试剂盒、WST-1溶液购自上海碧云天生物技术有限公司;鸡细胞因子IL-4和IFN-γ酶联免疫吸附测定试剂盒购自武汉优尔生科技股份有限公司;镍柱琼脂糖树脂HisPur Ni-NTA购自Thermo Fisher Scientific公司;Strep-Tactin亲和层析购自德国IBA Life sciences公司;其他试剂均为国产分析纯。
1.4 F基因表达质粒的构建将基因Ⅶ型NDV CK/CH/LHLJ/1/06株(GenBank:KU140419)的F基因中编码裂解位点“RRQKRF”的RNA序列突变为编码氨基酸序列“GGQGRF”的DNA序列,使表达的蛋白不能被细胞中普遍存在的弗林样蛋白酶切割成为F1和F2 两个亚单位以更好地维持免疫原性;另外将F基因的跨膜区(TM)和胞浆尾部区(CT)的编码序列替换为噬菌体T4纤维蛋白异源三聚结构域的编码序列,以便于表达的蛋白形成可溶性的三聚体。此外,在序列的3′末端添加His和Strep标签的编码序列以利于蛋白表达后的纯化。将上述基因序列进行密码子优化使其适合在鸡体内表达,由北京华大基因公司合成并克隆至pMD18-T载体。设计引物pcaf-F和pcaf-R(引物具体信息见表1),通过PCR扩增上述优化的F基因,利用In-Fusion HD Cloning Kit将扩增获得的F基因片段与BamHⅠ和XhoⅠ酶切后的pCAGGS载体连接并转化至感受态细胞中,挑取单个克隆提取质粒进行PCR和酶切鉴定,将阳性质粒进行测序验证,测序正确的质粒命名为pCAF。

表1 引物序列及相关信息
1.5 proF的表达、纯化和鉴定利用ExpiFecTamine293转染试剂盒将pCAF质粒转染至悬浮培养的Expi293F细胞中,转染后5 d,收集细胞上清,10 000×g离心10 min去除细胞碎片。用Ni-NTA琼脂糖树脂HisPur Ni-NTA和Strep-Tactin亲和层析柱纯化上清中带有His-Strep标签的F蛋白,获得的蛋白命名为proF。用Bradford蛋白定量试剂盒测定纯化后的proF浓度,将纯化后的F蛋白进行SDS-PAGE后用考马斯亮蓝染色,检测蛋白大小。另外,通过Western blot对纯化的proF进行进一步鉴定:SDS-PAGE后将蛋白转印至硝酸纤维素膜上,以在鸡中制备的基因Ⅶ型NDV CK/CH/LHLJ/1/06株的抗血清作为一抗,辣根过氧化物酶标记的抗鸡抗体作为二抗,用化学发光试剂盒进行显色。
1.6 动物免疫及样品采集将40只14日龄的SPF雏鸡随机分为4组,每组10只。第1组雏鸡用pCAF质粒通过肌肉注射方式免疫,100 μg/只,在第1次免疫后14 d以同样的方式和剂量用pCAF质粒加强免疫;第2组雏鸡用pCAF质粒通过肌肉注射方式免疫,100 μg/只,在第1次免疫后14 d,肌肉注射含Marcol52矿物油佐剂的proF,50 μg/只;第3组鸡在28日龄时通过肌肉注射含Marcol52矿物油佐剂的proF,50 μg/只;第4组鸡通过肌肉注射无菌PBS作为对照组。在最后一次免疫后14 d,通过翅静脉采集各组鸡的抗凝血,用外周血淋巴细胞分离液分离淋巴细胞。
1.7 鸡外周血淋巴细胞增殖试验参照文献报道的方法分离淋巴细胞[15],获得的淋巴细胞用含有10%胎牛血清的RPMI-1640培养基调整为5×105个/mL,于96孔板每孔中加入100 μL含淋巴细胞的培养液进行培养。pCAF质粒单独免疫组、proF单独免疫组、pCAF质粒和proF联合免疫组以及PBS对照组分离到的淋巴细胞分别用终质量浓度为10 mg/L的ConA蛋白(阳性对照)、终质量浓度为10 mg/L纯化的proF(特异性抗原)、RPMI-1640培养基(阴性对照)进行处理,每种处理方式重复3个孔。处理后继续培养细胞48 h,然后在每孔中加入10 μL WST-1溶液,孵育4 h,在450 nm 处测定每孔的吸光度值(D450 nm)。刺激指数(stimulation index,SI)为特异性抗原刺激细胞的平均D值与阴性对照刺激细胞的平均D值的比值。
1.8 细胞因子IL-4和IFN-γ的检测按照1.7中的方法分离、培养和处理鸡外周血淋巴细胞,用10 mg/L 的ConA蛋白(阳性对照)、10 mg/L纯化的proF(特异性抗原)、RPMI-1640培养基(阴性对照)处理淋巴细胞,处理后48 h收集培养上清液,用鸡细胞因子IL-4和IFN-γ酶联免疫吸附测定试剂盒检测上清液中的IL-4和IFN-γ,利用已知浓度的标准品建立标准曲线,并根据标准曲线计算所检测样品中细胞因子IL-4和IFN-γ的浓度。
2 结果
2.1 pCAF质粒的构建和鉴定将PCR扩增获得的F基因片段与酶切后的pCAGGS质粒连接后转化感受态细胞,涂布于抗性LB平板后过夜培养,挑取单个克隆进行培养,提取质粒进行酶切和PCR鉴定。结果显示,重组质粒用XhoⅠ和BamHⅠ进行双酶切后,可检测到2条带,分别为大小5 790 bp的载体片段和1 679 bp的F基因片段,与预期相符(图1A)。进一步以重组质粒为模板,利用引物pcaf-F和pcaf-R进行PCR鉴定,结果显示能够扩增得到1 695 bp 的F基因片段,与预期大小相符(图1B)。将上述鉴定为阳性的重组质粒进行测序,序列测定正确的质粒命名为pCAF。

A.pCAF质粒酶切鉴定(M.DL5000 DNA Marker;1.pCAF质粒的XhoⅠ、BamHⅠ双酶切产物);B.F基因PCR鉴定(M.DL5000 DNA Marker;2.F基因扩增结果)图1 pCAF质粒酶切及PCR鉴定电泳图
2.2 F蛋白的表达和纯化将pCAF质粒转染至悬浮培养的Expi293F细胞中,表达至上清中的蛋白经HisPur Ni-NTA和Strep-Tactin纯化后获得重组proF蛋白。由于对F蛋白裂解位点碱性氨基酸的编码序列进行了突变,使表达的蛋白不能被细胞中普遍存在的弗林样蛋白酶切割形成F1和F2 两个亚单位。对纯化后的proF进行SDS-PAGE,结果如图2A所示,在相对分子质量约为70 kDa处有一条蛋白条带,可见F蛋白未被切割为2个亚单位,与预期设计相符。另外,质粒pCAF编码的重组F蛋白理论相对分子质量为58 kDa,而F蛋白中存在4个糖基化修饰位点,每个糖基化位点发生糖基化修饰后增加的相对分子质量为2~3 kDa,因此本研究表达获得的蛋白应该包含相应的糖基化修饰。进一步通过Western blot对纯化的proF进行鉴定,结果如图2B显示,proF能够被Ⅶ型NDV CK/CH/LHLJ/1/06株的抗血清所识别,表明proF含有能够被NDV抗体所识别的抗原表位。

A.proF的SDS-PAGE结果;B.proF的Western blot鉴定。M.蛋白Marker;1,2.proF图2 proF的SDS-PAGE及Western blot鉴定
2.3 外周血淋巴细胞增殖试验为评估pCAF和proF免疫诱导的细胞免疫水平,采用pCAF质粒单独免疫、proF单独免疫、pCAF质粒和proF联合免疫3种方式免疫SPF雏鸡,以注射PBS的雏鸡作为对照,最后一次免疫后14 d分离外周血淋巴细胞进行淋巴细胞增殖试验。结果如图3所示,与用RPMI-1640培养基刺激相比,3个免疫组和对照组的外周血淋巴细胞经ConA刺激后均可发生明显的增殖。对照组雏鸡的外周血淋巴细胞用proF和RPMI-1640培养基刺激后均未检测到明显的细胞增殖,而3个免疫组的外周血淋巴细胞用proF刺激后发生明显的细胞增殖,并且3个免疫组的外周血淋巴细胞用proF刺激后刺激指数均显著高于对照组。另外,用proF刺激后,pCAF质粒和proF联合免疫组的刺激指数显著高于pCAF质粒单独免疫组和proF单独免疫组。
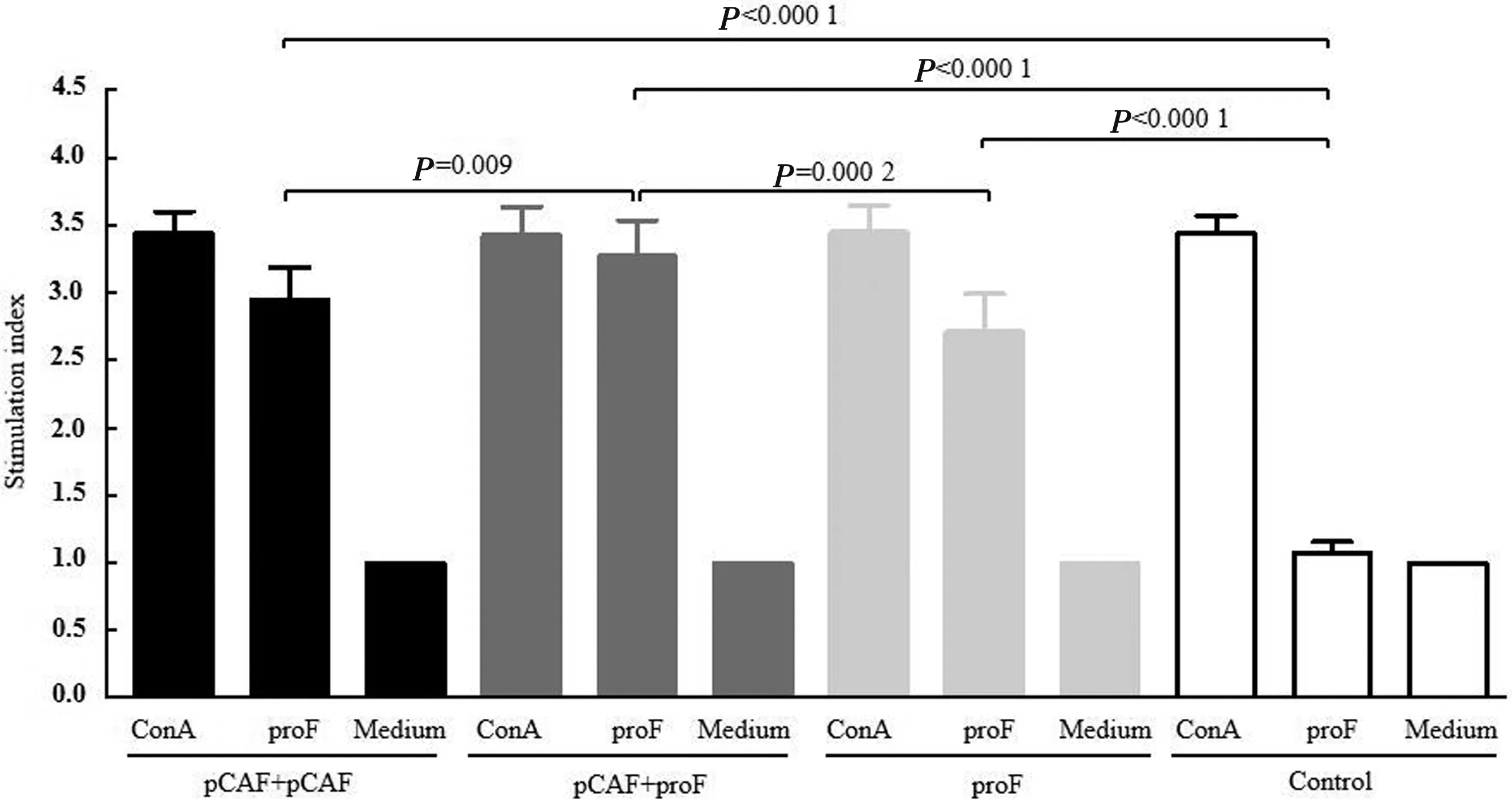
图3 鸡外周血淋巴细胞增殖试验刺激指数的测定结果
2.4 细胞因子IL-4和IFN-γ的检测结果最后一次免疫后14 d分离的淋巴细胞用proF做为特异性抗原进行刺激,ConA和RPMI-1640培养基刺激作为阳性和阴性对照,检测外周血淋巴细胞产生细胞因子IL-4和IFN-γ的水平。IL-4检测结果如图4所示,与用RPMI-1640培养基刺激相比,3个免疫组和对照组的外周血淋巴细胞经ConA刺激后均可产生IL-4。对照组雏鸡的外周血淋巴细胞用proF和RPMI-1640培养基刺激后均未检测到明显的IL-4,而3个免疫组的外周血淋巴细胞用proF刺激后可检测到不同水平的IL-4。其中,pCAF质粒和proF联合免疫组的外周血淋巴细胞经proF刺激后产生的IL-4水平显著高于pCAF质粒单独免疫组和proF单独免疫组,并且proF单独免疫组的外周血淋巴细胞经proF刺激后产生的IL-4水平显著高于pCAF质粒单独免疫组。

图4 细胞因子IL-4检测结果
IFN-γ检测结果如图5所示,与用RPMI-1640培养基刺激相比,3个免疫组和对照组的外周血淋巴细胞经ConA刺激后均可产生IFN-γ。对照组雏鸡的外周血淋巴细胞用proF和RPMI-1640培养基刺激后均未检测到明显的IFN-γ,而3个免疫组的外周血淋巴细胞用proF刺激后可检测到不同水平的IFN-γ。其中,pCAF质粒和proF联合免疫组的外周血淋巴细胞经proF刺激后产生的IFN-γ水平显著高于pCAF质粒单独免疫组和proF单独免疫组,并且pCAF质粒单独免疫组的外周血淋巴细胞经proF刺激后产生的IFN-γ水平显著高于proF单独免疫组。
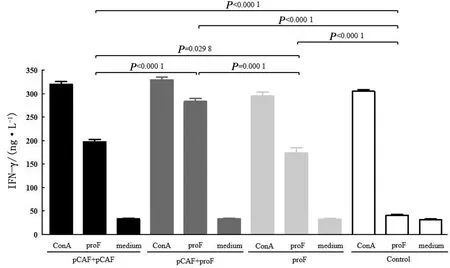
图5 细胞因子IFN-γ检测结果
3 讨论
各种类型的疫苗,包括弱毒活疫苗、灭活疫苗、重组病毒载体疫苗以及抗原性匹配的基因工程疫苗,被广泛应用于预防和控制NDV的传播,但世界范围内仍存在由于疫苗免疫失败导致ND的发生,这也表明当前的控制策略仍不是完全有效的,也表明需要研制新型疫苗用于ND的防控。
与传统疫苗相比,DNA疫苗具有许多独特的优势,包括化学和生物特性稳定、生产简单和易于操作等[16],并且DNA疫苗仅含有编码病毒保护性抗原的基因,因此不存在弱毒活疫苗的毒力返强风险,另外,DNA疫苗诱导的免疫反应与病毒自然感染诱导的免疫反应类似。质粒DNA在宿主细胞内利用宿主细胞的翻译系统表达产生病毒的蛋白,与组织相容性复合物MHC-Ⅰ或Ⅱ类分子结合,引起细胞和体液免疫。尽管DNA疫苗具有众多优势,但用DNA疫苗单独免疫通常不能对病毒的攻击提供完全保护,例如,以表达NDV F蛋白的质粒作为免疫原通过肌肉注射免疫鸡后能够对NDV的攻击提供不同水平(10%~50%)的保护。此外,环形DNA作为疫苗免疫只能诱导产生较低水平的抗体,这也表明DNA疫苗可能诱导细胞免疫从而对病毒的攻击提供保护[17]。研究发现重复免疫能够诱导针对病毒的高水平免疫力,并且连续使用含有相同抗原的不同类型疫苗进行免疫比重复使用同一种类型疫苗的免疫效果更好。因此,为提高DNA疫苗的免疫效果,通常建议用质粒DNA进行首次免疫,灭活疫苗或亚单位疫苗进行加强免疫,从而提高免疫反应的水平。
本研究构建了含有密码子优化的NDV F基因的质粒pCAF,在真核细胞中成功表达后获得了含有糖基化修饰的proF。为评估质粒pCAF和proF免疫所诱导的细胞免疫反应,分别采用pCAF质粒单独免疫、proF单独免疫、pCAF质粒和proF联合免疫的方式免疫SPF鸡,通过淋巴细胞增殖试验和细胞因子的检测来评估免疫诱导的细胞免疫反应。结果发现3种免疫方式均能引起明显的淋巴细胞增殖和细胞因子IL-4和IFN-γ的产生,其中pCAF质粒和proF联合免疫组引起的淋巴细胞增殖反应和细胞因子IL-4和IFN-γ的水平最高,另外,pCAF质粒单独免疫诱导产生的IFN-γ的水平高于proF单独免疫,而proF单独免疫诱导产生的IL-4的水平高于pCAF质粒单独免疫。
细胞因子在免疫反应的发展和病毒感染的预防中起着关键作用。IFN-γ主要由辅助性T细胞1(Th l)分泌,介导细胞免疫应答,在抗感染等方面起重要作用;IL-4主要由辅助性T细胞2(Th2)分泌,主要介导体液免疫应答,辅助抗体的产生。本研究发现,proF诱导的Th2细胞因子(IL-4)水平高于pCAF质粒,而pCAF质粒诱导的Th1细胞因子(IFN-γ)水平高于proF,并且与单独接种pCAF质粒或proF相比,pCAF质粒和proF联合免疫的方式诱导产生的细胞因子水平更高,这与之前的报道一致,即DNA疫苗免疫主要诱导Th1型免疫反应,而蛋白疫苗免疫主要诱导Th2型免疫反应[18]。此外,pCAF质粒和proF联合免疫诱导了针对NDV的混合Th1/Th2型免疫反应,并增加了细胞因子IL-4和IFN-γ的产生。本团队前期研究发现,表达F基因的质粒作为DNA疫苗单独免疫后检测不到体液抗体,但能对NDV的攻击提供部分保护。因此,本研究结果进一步表明F基因DNA疫苗免疫后诱导的细胞免疫可能参与了针对NDV的保护,这需要进一步的证实。
综上所述,本研究结果表明,pCAF质粒和proF均可诱导细胞免疫应答,且与单独接种pCAF质粒或proF相比,pCAF质粒和proF联合免疫诱导的细胞免疫效果更好。此外,针对NDV HN的血凝抑制抗体通常用来评价疫苗诱导的免疫水平,并且可作为NDV感染的标记。鉴于DNA疫苗免疫不受母源抗体的干扰,并且F基因DNA疫苗和亚单位疫苗免疫后不会诱导产生针对NDV的血凝抑制抗体,因此本研究构建的F基因DNA疫苗和亚单位疫苗更适合“区分感染与免疫的动物(DIVA)”这一免疫策略。本研究的结果为研制适合我国NDV防控的新型疫苗奠定理论基础。

