DNA甲基化对奶牛乳腺上皮细胞乳脂和乳糖合成的影响
张岩,夏安婷,刘青悦,刘杰,魏翔飞,曲波,姜毓君,王春梅,张莉
(东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
0 引言
DNA甲基化是在DNA甲基转移酶(DNMT)的作用下在Cp G二核苷酸的胞嘧啶上添加一个甲基的过程[1]。DNA甲基化通过抑制转录因子与基因启动子的结合,从而抑制基因的转录,在细胞分化、胚胎发育和疾病发生发展上发挥着重要作用[2-4]。近年来,随着表观遗传学研究的深入,DNA甲基化在奶牛乳腺发育与泌乳生物学中的调控机制引起了越来越多研究者的重视[5-6]。乳脂是牛奶中主要的营养物质,乳糖是牛奶中主要的碳水化合物,二者决定了奶牛的产奶量及乳品质[7]。实验室前期研究发现高产奶牛和低产奶牛的一些泌乳相关基因启动子甲基化水平存在显著差异,因此本实验利用奶牛乳腺上皮细胞模型来探究DNA甲基化水平对奶牛乳脂和乳糖合成的影响,以期为泌乳调控提供研究基础。
1 实验
1.1 试剂与仪器
主要试剂:CK18抗体(Cell Signaling Technology),FITC标记驴抗兔二抗(北京博奥森),胎牛血清,I型胶原酶(Gibco),DMEM-F12培养液(Hyclone),lipofectamineTM3000(Thermo Scientific),Taq DNA聚合酶、Hind III和Kpn I限制性内切酶(Takara),RNA微量提取试剂盒(Magen),ReverTar Ace qPCR RT Kit(上海TOYOBO),THUNDERBIRD SYBR qPCR Mix(上海TOYOBO),Bovine milk fat ELISA KIT、Bovine lactose ELISA KIT(上海酶联生物),E.Z.N.A.ⓇEndo-Free Plasmid Mini Kit I(美国Omega)。
主要仪器:PCR仪,美国Eppendorf;荧光定量PCR仪,Roche,LightCycle480;M odel 680酶标仪,美国IORAD;CO-150型CO2培养箱,美国Eppendorf;DFC280倒置相差显微镜,德国Leica;激光共聚焦扫描显微镜,德国Leica;TAL-16A台式离心机,上海安亭科学仪器厂。
1.2 方法
1.2.1 奶牛乳腺上皮细胞的分离培养与鉴定
按照本实验室奶牛乳腺上皮细胞培养和鉴定的标准进行奶牛乳腺上皮细胞的培养与鉴定[8]。将体外分离得到的奶牛乳腺组织用胰酶消化得到原代奶牛乳腺上皮细胞,在5%CO2、37℃的条件下,使用含有10%血清和100 U/mL青霉素、100μg/mL链霉素的DF12培养液贴壁培养。纯化后,采用免疫荧光染色法对细胞进行角蛋白18的染色鉴定,使用FITC标记的荧光二抗标记角蛋白18,DAPI标记细胞核。
1.2.2 DNMT 3A过表达载体的构建
采用RNA提取试剂盒提取奶牛乳腺上皮细胞总RNA,反转录成cDNA作为模板,根据NCBI数据库中奶牛的DNMT 3A的mRNA序列设计特异性引物,进行PCR扩增,将胶回收产物与pcDNA3.1载体分别使用Hind III和Kpn I进行双酶切,连接、转化、测序。测序成功的阳性克隆经扩大培养,提取质粒备用。PCR扩增引物如表1所示。表1中下划线处为Hind III和Kpn I酶切位点,酶切位点前为保护碱基。质粒提取采用美国Omega无内毒素质粒提取试剂盒,具体操作按照说明书进行。

表1 PCR引物序列
1.2.3 奶牛乳腺上皮细胞的转染
将奶牛乳腺上皮细胞传至六孔板,当奶牛乳腺上皮细胞贴壁培养至70%~80%的密度时进行转染。空白对照组(blank组)、pcDNA3.1空载体组(control组)、DNMT 3A过表达质粒组(pcDNA3.1-DNMT3A组)均按照实验要求用脂质体3000进行转染,具体操作按照说明书进行。转染后在CO2培养箱中(5%CO2,37℃)继续培养48 h,收样进行后续实验。
1.2.4 RNA提取与荧光定量PCR
采用RNA提取试剂盒提取奶牛乳腺上皮细胞总RNA,按照反转录试剂盒说明书操作,将总RNA反转录成cDNA作为模板,按照SYBR qPCR试剂盒说明书配制20 uL反应体系,使用两步法进行荧光定量PCR,引物序列如表2所示。

表2 荧光定量PCR引物序列
1.2.5 乳糖与乳脂检测
细胞转染48 h后,收集细胞培养液,按照乳脂和乳糖试剂盒说明书进行操作,检测奶牛乳腺上皮细胞中乳脂和乳糖的含量。
1.2.6 数据处理与统计分析
使用Graphpad prism统计软件对至少3个独立实验的数据进行分析和作图,组间比较用单因素方差分析,组内比较用t检验并对多组进行了单因素方差分析。P<0.05(*)表示具有统计学显著性差异,P<0.01(*)表示具有统计学极显著性差异。
2 结果
2.1 奶牛乳腺上皮细胞的鉴定
奶牛乳腺上皮细胞经分离纯化培养后,采用免疫荧光染色法检测奶牛乳腺上皮细胞的特征蛋白CK18的表达,结果如图1所示,细胞核被DAPI染成蓝色,CK18呈绿色荧光,说明本研究分离纯化后得到的是奶牛乳腺上皮细胞。
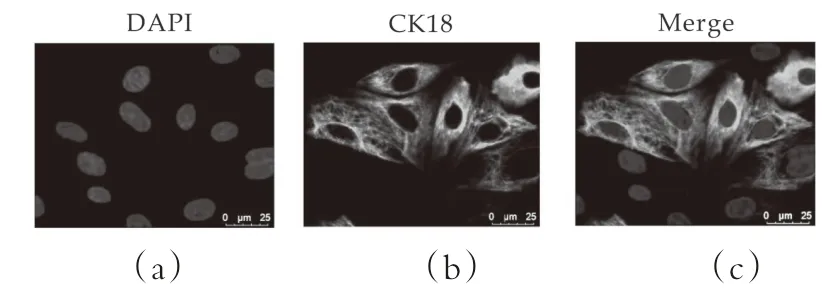
图1 奶牛乳腺上皮细胞角蛋白18的鉴定
2.2 DNMT3A过表达载体的构建
本实验提取的奶牛乳腺上皮细胞总RNA,经1%琼脂糖凝胶电泳分离后检测结果如图2(a)所示,RNA质量较好,可用于后续实验。以上述RNA反转录的cDNA为模板,进行PCR扩增的扩增结果如图2(b)所示,获得的基因片段长度约为2851 bp,将PCR产物送去测序。测序成功后,将PCR产物胶回收与真核表达载体pcDNA3.1(+)进行连接。将得到的重组质粒以T7为前引物送去哈尔滨博仕生物公司测序,测序结果用DNAMAN 7.0软件分析,结果证明pcDNA3.1-DNMT3A重组质粒构建成功。

图2 DNMT3A的PCR扩增结果
2.3 DNM T3A的mRNA表达变化
将pcDNA3.1-DNMT 3A重组质粒转染奶牛乳腺上皮细胞48 h后,收集细胞提取总RNA,反转录后通过qRT-PCR方法检测DNMT3A mRNA的表达。结果如图3所示,与空白对照组(blank组)相比,pcDNA3.1空载体组(control组)奶牛乳腺上皮细胞的DNMT3A的mRNA表达无明显变化;与空白对照组(blank组)和pcDNA3.1空载体组(control组)相比,pcDNA3.1-DNMT 3A重组质粒组(DNMT3A组)奶牛乳腺上皮细胞的DNMT3A的mRNA表达极显著增加(P<0.01),说明向奶牛乳腺上皮细胞中转染的pcDNA3.1-DNMT 3A重组质粒有效的增加了细胞中甲基化酶DNMT 3A的表达量,可以进行后续的实验分析。

图3 DCMECs中DNMT3A mRNA的表达水平变化
2.4 DCMECs中乳糖合成的变化
本研究采用Bovine lactose ELISA KIT绘制乳糖标准曲线,检测样品中乳糖浓度。结果如图4所示,与空白对照组(blank组)相比,pcDNA3.1空载体组(control组)奶牛乳腺上皮细胞的乳糖的含量无明显变化;与空白对照组(blank组)和pcDNA3.1空载体组(control组)相比,pcDNA3.1-DNMT 3A重组质粒组(DNMT3A组)中乳糖的含量显著降低(P<0.05),说明过表达DNMT3A后,奶牛乳腺上皮细胞基因的DNA甲基化水平升高后,引起了乳糖的合成和分泌的降低。

图4 DCMECs中乳糖合成的变化
2.5 DCMECs中 乳脂合成的变化
本实验采用Bovine milk fat ELISA KIT绘制乳脂标准曲线,检测样品中乳脂浓度。检测结果如图5所示,与空白对照组(blank组)相比,pcDNA3.1空载体组(control组)奶牛乳腺上皮细胞的乳脂的含量无明显变化;与空白对照组(blank组)和pcDNA3.1空载体组(control组)相比,pcDNA3.1-DNMT 3A重组质粒组(DNMT 3A组)中乳脂的含量也显著降低(P<0.05),说明过表达DNMT 3A后,奶牛乳腺上皮细胞基因的DNA甲基化水平升高后,也引起了乳脂的合成和分泌降低。总的来看,DNA甲基化水平升高对奶牛乳脂和乳糖的合成具有抑制作用。
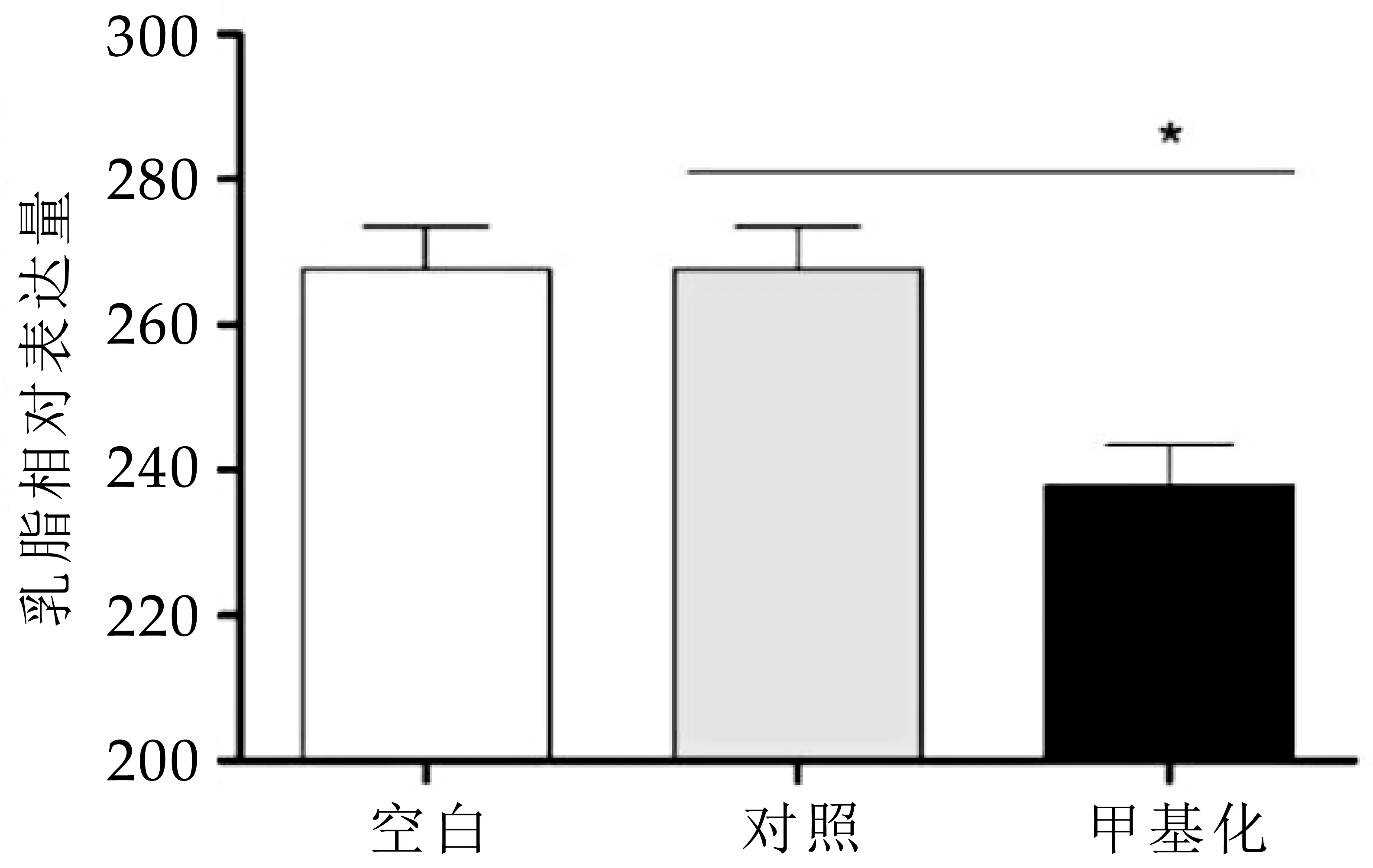
图5 DCMECs中乳脂合成的变化
3 讨论
DNA甲基化作为表观遗传学最重要的修饰方式之一,近年来受到越来越多的关注[9]。DNA甲基化主要发生在Cp G二核苷酸中胞嘧啶的5'端,通常会抑制基因的转录[10-11]。Wang等发现LPS处理牛的子宫内膜细胞,会降低IL-6和IL-8基因的表达,而这种变化是由启动子甲基化所引起的[12-13]。奶牛的产奶量受到多种因素的影响,环境、激素、疾病等都会对奶牛乳腺上皮细胞的数量和活性有重要的调节作用,进而影响泌乳[14]。在奶牛泌乳过程中,如果泌乳相关基因的甲基化状态发生改变,则直接会对奶牛的产奶量和产乳品质等产生重要的影响[15]。Liu等[16]分析了与奶牛产奶量密切相关的基因EEF1D和RPL8的甲基化变化,发现干奶期它们的DNA甲基化水平低于泌乳期,另外,有研究表明,大多数奶牛乳腺炎和基因的DNA甲基化调节也密不可分。乳腺炎是奶牛疾病中最为普遍的一种[17],它会导致牛奶产量减少,影响乳品质,从而导致巨大的经济损失[18-19]。Mao等的研究发现在患有乳腺炎的母牛中,CXCR 1基因的外显子区域的Cp G岛的90%以上的Cp G位点呈甲基化状态[20]。这些研究表明DNA甲基化与奶牛泌乳密切相关。乳脂是影响牛奶质量的主要因素。在乳腺中,乳脂有一半来自于日粮中的脂肪,另外一半则都来源于乳腺上皮细胞合成[21-23]。乳糖也是决定奶牛产奶量的主要因素,这是由于其渗透压的特性会导致乳腺上皮细胞的高尔基体吸收水分[24-27]。本研究结果表明,过表达DNMT 3A后,奶牛乳腺上皮细胞中乳脂和乳糖的合成减少,这种变化应该是与乳脂和乳糖合成的相关基因的甲基化水平升高引起的,具体机制仍需进一步探究。本研究为表观遗传学在奶牛泌乳中的调控作用和机制研究提供了理论研究基础,为一些奶牛疾病的机制研究提供前期研究基础,从而为提高奶牛泌乳质量和泌乳产量服务。

