NFATc1对人肺腺癌细胞增殖、凋亡和侵袭能力的影响
任凤海 朱开彬 王彦博 周福成 庞赛楠 陈澜涛
NFATc1作为NFAT家族成员的一员,在调控细胞增殖、凋亡、迁移、侵袭、血管生成和肿瘤发生中都起着重要的作用。在乳腺癌、结肠癌以及卵巢癌中,NFATc1能够促进细胞的侵袭和转移[1-2]。NFATc1在胰腺癌组织和细胞系中高表达,NFATc1与STAT3的相互作用会促进癌变的发生,进一步增加胰腺癌的侵袭性[3]。此外,NFATc1可以通过激活ERK1/2/p38 MAPK信号通路,促进卵巢癌细胞的生长和肿瘤发生[4]。越来越多的研究表明,NFATc1在肿瘤发生发展中起着重要的作用,但是其在肺癌中的作用以及具体的生物学机制仍有待于进一步的研究。本文旨在探究NFATc1在肺腺癌细胞中的作用以及其发挥作用的生物学机制。
1 材料与方法
1.1 主要试剂
胎牛血清、青霉素、链霉素、细胞培养基以及胰蛋白酶购自美国HyClone公司,TRIzol购自美国Thermo Scientific公司,cDNA逆转录试剂盒和SYBR Green购自美国Roche公司,结晶紫染色液、MTT检测试剂、RIPA裂解液、BCA蛋白测定试剂盒与ECL购自北京索莱宝科技有限公司,凋亡试剂盒购自北京eBioscience有限公司,PI购自美国Sigma公司,Transwell小室购自美国康宁公司。N-Cadherin、Bax、c-Myc、CDK4、NFAT2和GAPDH一抗购自美国Abcam公司,ERK、E-Cadherin、p-ERK和Cleaved caspase-3一抗购自美国CST公司,HRP标记山羊抗兔和抗鼠IgG购自北京中杉金桥生物技术有限公司,引物由上海生工生物工程技术服务有限公司合成。
1.2 人肺腺癌细胞培养
人肺腺癌A549、NCI-H1299和NCI-H1975细胞购自美国ATCC公司,分别用含10%胎牛血清、100 U/mL青霉素与100 mg/L链霉素的F-12k和RPMI-1640培养基,置于37℃、5% CO2的培养箱中进行培养。
1.3 Realtime PCR(qRT-PCR)检测基因表达水平
使用TRIzol试剂提取细胞总RNA,之后使用Nanodrop测定RNA的纯度和浓度。按照cDNA合成试剂盒的说明书进行反转录,采用SYBR Green染料进行相对定量分析,反应采用两步法进行:50℃ 2 min,95℃ 10 min;95℃ 10 s,60℃ 30 s,重复40个循环。以GAPDH的表达作为内参,2-ΔΔCT法计算目的基因的相对表达水平。NFATc1引物序列:F:5′-CCATGAAGTCAGCGGAGGAA-3′,R:5′-GAGGTCTGAAGGTTGTGGCA-3′。GAPDH引物序列:F:5′-AAGAAGGTGGTGAAGCAGGC-3′,R:5′-TCCACCACCCAGTTGCTGTA-3′。
1.4 细胞转染
取对数生长期的细胞,胰酶消化离心后接种在6孔板中,第二天待细胞密度为60%~80%时进行病毒感染,包裹慢病毒的NFATc1敲减质粒(shNFATc1组)和对照质粒(shCtrl组)购自上海吉凯基因化学技术有限公司,转染操作和病毒使用滴度严格按照说明书进行。
1.5 MTT检测细胞增殖
取对数生长期的细胞,胰酶消化离心后按照每孔3 000个细胞接种于96孔板中,在孵箱中培养过夜。第一天在每孔中加入20 μL的5 mg/mL MTT溶液,37℃孵育4 h,弃掉培养液,加入100 μL DMSO震荡10 min,酶标仪490 nm处测量OD值。之后再连续测量4天,每天都在同一时间点重复第一天的操作。
1.6 细胞克隆数目的检测
取对数生长期的细胞,胰酶消化离心后按照每孔1 000个细胞接种于6孔板中,每组重复3个复孔。细胞培养箱中培养2周左右,待形成肉眼可见的细胞克隆,4%多聚甲醛(PFA)固定10 min,PBS洗3次,之后用0.1%结晶紫室温染色6 min,流水冲洗掉多余的染色液,干燥后使用数码相机进行拍照,并记录形成的细胞克隆数目。
1.7 流式细胞仪检测细胞周期和凋亡情况
取对数生长期的细胞,胰酶消化后离心,4℃预冷的DPBS(pH=7.2~7.4)洗涤细胞沉淀一次。加入800 μL的细胞染色液(PI)重悬,使上机时细胞通过率为300~800个细胞。利用流式细胞仪检测各组细胞周期分布。
取对数生长期的细胞,胰酶消化后离心,4℃预冷的D-Hanks洗涤沉淀一次,缓冲液洗涤细胞沉淀一次,200 μL缓冲液重悬细胞沉淀,之后加入10 μL Annexin V-APC室温避光染色10~15 min。利用流式细胞仪检测各组细胞调亡情况。
1.8 Transwell检测细胞的迁移和侵袭能力
取对数生长期的细胞,胰酶消化后离心,用无血清的培养基制备成单细胞悬液,按照每孔105个细胞加入到上小室中,下小室中加入含10%胎牛血清的完全培养基。培养24 h后取出小室,用4% PFA固定10 min,棉签轻轻的擦去上小室的细胞,0.1%结晶紫室温染下小室的细胞6 min。流水冲洗掉多余的染色液,干燥后封片,显微镜下拍照并统计发生迁移的细胞数量。侵袭和迁移步骤基本一致,侵袭需要先在上小室中加基底膜。
1.9 Western blot检测凋亡、EMT转化和MAPK信号通路蛋白表达
取对数生长期的细胞,使用RIPA对细胞进行裂解提取总蛋白,BCA试剂盒测定蛋白浓度,将蛋白调整成等体积等浓度,与上样缓冲液混合后100℃变性5 min。取等体积蛋白样品用SDS-PAGE凝胶进行电泳。湿转法转印蛋白到NC膜上,5%脱脂奶粉室温封闭1 h,一抗ERK(1∶2 000)、E-Cadherin(1∶500)、p-ERK(1∶1 000)、N-Cadherin(1∶500)、Bax(1∶2 000)、Cleaved caspase-3(1∶500)、c-Myc(1∶1 000)、CDK4(1∶1 000)、NFAT2(1∶500)和GAPDH(1∶5 000)4℃孵育过夜,TBS-T洗3次,每次5 min。抗兔和抗鼠IgG二抗(1∶5 000)室温孵育1 h,TBS-T洗3次,每次5 min。使用ECL化学发光显影液进行显影,Image Lab软件获取图像并分析各条带的灰度值,以目的蛋白与GAPDH蛋白灰度的比值作为目的蛋白的相对表达量。
1.10 数据统计与分析

2 结果
2.1 稳定低表达NFATc1细胞株的建立
NCI-H1299细胞中NFATc1的表达水平高于NCI-H1975和A549细胞(F=20.970,P=0.002)(图1A)。qRT-PCR结果显示,与shCtrl组相比,shNFATc1组NFATc1 mRNA(t=7.643,P=0.002)表达下降(图1B)。Western blot结果显示,与shCtrl组相比,shNFATc1组NFATc1蛋白(t=5.942,P=0.004)表达下降(图1C),NFATc1敲减效率较高,可以用于接下来的研究。
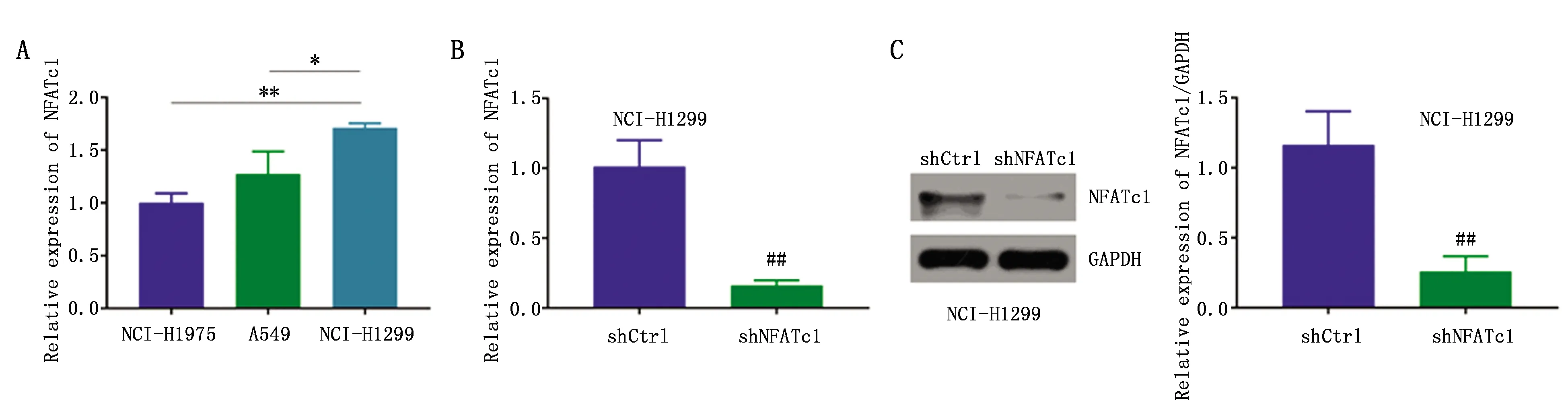
图1 NCI-H1299细胞中NFATc1表达水平检测
2.2 NFATc1对肺腺癌细胞增殖的影响
MTT结果显示,与shCtrl组相比,从第2天开始,shNFATc1组细胞增殖受到抑制(F交互=1 001,P<0.001)(图2A)。克隆形成实验结果显示,与shCtrl组相比,shNFATc1组细胞形成的克隆数目减少(t=25.950,P<0.001)(图2B)。
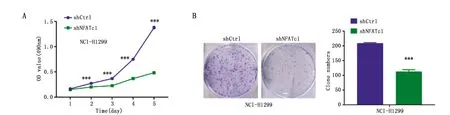
图2 NFATc1对肺腺癌细胞增殖的影响
2.3 NFATc1对肺腺癌细胞迁移和侵袭的影响
迁移实验结果显示,与shCtrl组相比,shNFATc1组发生迁移的细胞数目变少,细胞的迁移能力受到抑制(t=131.700,P<0.001)(图3A)。侵袭实验结果显示,与shCtrl组相比,shNFATc1组发生侵袭的细胞数目变少,细胞的侵袭能力受到抑制(t=165.100,P<0.001)(图3B)。

图3 Transwell检测细胞迁移和侵袭能力(200×)
2.4 NFATc1对肺腺癌细胞凋亡和周期的影响
细胞凋亡结果显示,与shCtrl组相比,shNFATc1组细胞凋亡比例增加(t=30.090,P<0.001)(图4A)。细胞周期结果显示,与shCtrl组相比,shNFATc1组细胞周期阻滞在G0/G1期(t=19.110,P<0.001),S期(t=9.076,P<0.001)和G2/M期(t=10.240,P<0.001)细胞比例减少(图4B)。

图4 流式检测细胞调亡和周期情况
2.5 NFATc1对凋亡、EMT相关蛋白和MAPK信号通路的影响
Western blot结果显示,与shCtrl组相比,shNFATc1组凋亡相关蛋白Bax(t=4.414,P=0.012)和Cleaved caspase-3(t=3.068,P=0.037)表达增加,CDK4(t=3.056,P=0.038)和c-Myc(t=6.952,P=0.002)表达降低(图5A)。EMT相关蛋白E-Cadherin(t=3.648,P=0.022)表达增加,N-Cadherin(t=12,P<0.001)表达降低(图5B)。MAPK信号通路蛋白ERK(t=8.688,P=0.001)和p-ERK(t=3.521,P=0.024)表达降低(图5C)。

图5 凋亡、EMT和MAPK信号通路相关蛋白的表达
3 讨论
肺癌是全球范围内最常见的恶性肿瘤之一,也是我国发病率较高的肿瘤,其致死率在所有的恶性肿瘤中位居榜首[5]。肺癌的早期症状不明显,当患者出现症状时,一般已经进入晚期阶段或已出现转移[6],患者生存率较低,并且预后较差[7]。因此,寻找肺癌标志基因和预后基因,会为肺癌的诊断以及治疗提供可靠的理论依据。NFATc1作为一个重要的转录因子,在免疫淋巴细胞中起重要的作用。越来越多的研究表明,NFATc1在哺乳动物组织中均有表达,并且在各种恶性肿瘤细胞中起着重要的调控作用[8]。在乳腺癌和卵巢细胞中,当抑制NFATc1活性后,细胞的生长和细胞的存活率受到明显的抑制[2,9]。在肺癌以及乳腺癌细胞中,NFATc1的异常表达可以改变细胞的形态,并且使细胞的侵袭能力增强[10]。在临床研究中发现,NFATc1可以促进尿路上皮肿瘤的发生和膀胱癌细胞的生长[11-12]。在肝癌细胞中,敲减NFATc1会阻滞细胞周期于G1/S期,这与我们在肺癌细胞中的研究结果一致。我们的研究还发现,在肺癌NCI-H1299细胞中,当NFATc1的活性被抑制后,细胞的增殖、克隆形成、迁移和侵袭能力均下降,细胞的凋亡比率增高。
随着对肿瘤发生的深入研究,凋亡、EMT转化和MAPK信号通路相关蛋白在肿瘤发生发展中的作用越来越受到重视,NFATc1参与许多信号转导通路的调节。在卵巢癌中发现,NFATc1可以通过激活ERK1/2/p38/MAPK通路,从而激活c-Myc以及COX-2的表达[13],并且NFATc1可以募集于COX-2的启动子,对其下游基因起着调控的作用[14]。在前列腺癌细胞中,NFATc1可以通过调控c-Myc以及PKM2调控细胞的周期、侵袭以及转移能力[15]。本研究发现,抑制NFATc1表达可以抑制肺癌细胞的迁移与侵袭,激活肿瘤的EMT转化过程,促进细胞的调亡。在分子水平上,敲减NFATc1表达后凋亡相关蛋白Bax和Cleaved caspase-3蛋白表达增加,CDK4和c-Myc蛋白表达降低。EMT相关蛋白E-Cadherin蛋白表达增加,N-Cadherin蛋白表达降低。
MAPK/ERK信号通路在细胞增殖、分化、迁移、衰老和凋亡中发挥着重要的作用[16]。ERK家族蛋白主要参与调控细胞的增殖与分化,正常或药物引起的细胞调亡,会使p-ERK蛋白表达降低[17,18]。但在某些基因或mRNA表达被干扰的情况下,ERK蛋白表达也会发生明显的改变。Yang等[19]研究发现,当AQP5基因表达被抑制之后,ERK和p-ERK蛋白表达均降低。Xu等[4]研究发现,NFATc1可以激活ERK1/2/p38/MAPK细胞信号通路,在卵巢癌SKOV3和CaOV3细胞系中过表达NFATc1后,p-ERK1/2表达增加。我们研究发现,抑制NFATc1表达,不仅会使p-ERK蛋白表达降低,也会使ERK蛋白表达降低。
综上所述,在人肺腺癌的形成和增殖过程中,NFATc1发挥着至关重要的作用,这些作用可能与NFATc1参与调控MAPK信号通路蛋白相关。通过对NFATc1作用机制的研究,在理论上为肺癌的治疗以及愈后提供了一个潜在的治疗靶标。

