下调Lgr5表达对结肠癌细胞上皮-间质转化及血管生成相关因子的影响
路明,陈哲
(1.吉林市中心医院胃肠外科,吉林 吉林 132001;2. 吉林市人民医院口腔科)
结肠癌(Colon cancer, CC)是世界上最普遍的恶性肿瘤之一,远处转移和复发是患者死亡的主要原因,超过50%的CC相关死亡率是由于转移扩散到肝脏造成的[1-2]。上皮-间质转化(Epithelial-mesenchymal transition, EMT)是指上皮细胞转化为间充质细胞的生物学过程,癌细胞EMT与肿瘤的进展、转移、复发和不良预后密切相关,E-钙黏蛋白(E-cadherin),N-钙黏蛋白(N-cadherin)和波形蛋白(Vimentin)是EMT的重要指标[3]。富含亮氨酸重复序列G-蛋白偶联受体5(Lgr5)是癌症干细胞(Cancer stem cells, CSCs)上一种表面标记物,是一种7次α螺旋跨膜糖蛋白激素受体,在人大脑、胃肠道、乳腺及毛囊等处都有表达,在小肠和结肠隐窝基底柱状上皮细胞和胃黏膜腺体颈部细胞中表现出特异的干细胞活性,因而,Lgr5可以作为结肠和小肠干细胞特异性分子标记物。查阅文献发现,Lgr5在多种癌组织中高表达,如卵巢癌、肝癌和结肠癌中[4-6],同时发现Lgr5在肠黏膜组织不同病理情况下(正常黏膜组织、炎性增生性息肉、癌组织)表达水平不同,表明Lgr5同时可作为结肠癌预测的特异性指标[7]。本文旨在阐明Lgr5对结肠癌细胞侵袭、迁移的影响,并从EMT和血管生成方面研究Lgr5促进结肠癌细胞侵袭迁移的可能机制,为结肠癌细胞的治疗提供新思路。
1 材料与方法
1.1 实验材料
1.1.1 细胞
人正常肠上皮细胞NCM460和人结肠癌细胞(HT-29, SW620, LoVo)均购自中科院上海细胞库。
1.1.2 药品与试剂
转染试剂盒、Lip 2000试剂盒和引物购自上海吉玛基因有限责任公司;cDNA逆转录试剂盒、荧光定量PCR试剂盒均购自美国赛默飞有限公司;Lgr5、Vimentin、E-cadherin、N-cadherin、β-actin及二抗(兔/鼠)均购于上海艾博抗有限公司;ELISA试剂(VEGF、bFGF)盒购自南京建成生物科技有限公司。
1.2 实验方法
1.2.1 标本来源
收集吉林市中心医院因其他疾病切除的正常结直肠黏膜组织及结肠癌组织,所有患者术前均未接受内分泌、靶向或放化疗等辅助治疗。所有患者均签署知情同意书,实验方案由吉林市中心医学伦理委员会审核批准。
1.2.2 细胞培养
人正常肠上皮细胞NCM460和人结肠癌细胞(HT-29、SW620、LoVo)培养于含10%胎牛血清、100 U/mL青霉素、100 mg/L链霉素的DMEM培养基中,在37℃、5% CO2的恒温培养箱中进行细胞培养。
1.2.3 细胞转染分组
转染对象为LoVo细胞株,转染步骤严格按照说明书对LoVo细胞中Lgr5进行下调,实验按照如下分组:对照组(只转染Lip 2000)、si-NC组(转染Lip2000和无关序列)和si-Lgr5组(转染Lip2000和si-Lgr5序列),转染8 h,换成10 %胎牛血清的DMEM培养基中在37 °C、5 % CO2细胞培养箱中继续培养24 h。
1.2.4 总RNA提取及实时荧光定量PCR检测mRNA的相对表达量
使用TRizol试剂从人正常肠黏膜细胞NCM460、人结肠癌(HT-29、SW620、LoVo)和各转染组细胞中提取总RNA,使用cDNA反转录试剂盒合成互补DNA模板;使用荧光定量PCR以检测各组细胞中mRNA的表达水平。 RT-PCR条件:94℃,5 min(初始变性),40个循环的变性(94℃,30 s),退火(55℃,30 s),延伸(72℃,30 s) , 72℃放置5 min(最终延伸)。引物序列如下表,实验重复3次。引物序列见表1。

表1 引物序列
1.2.5 细胞划痕实验检测细胞迁移能力
细胞分组同1.2.3,将转染24 h的各组细胞以每孔30×104个重新接种于六孔板,待细胞贴壁,使用钢尺和无菌一次性黄色枪头将细胞沿直线划伤,0 h记录各组划痕宽度,24 h再次记录划痕宽度,迁移抑制率(%)=(1-si-Lgr5组细胞划痕宽度/si-NC组细胞划痕宽度)×100 %,实验重复3次。
1.2.6 Transwell 检测细胞侵袭能力
细胞分组同1.2.3,每孔铺60 μL基质胶,在培养箱中凝固1 h,取转染24 h对照组、si-NC组、si-Lgr5组细胞,每组设3个复孔,使用无血清培养基以每孔1×104个重悬于小室中。于37℃,5% CO2饱和湿度培养条件下培养24 h;取出小室;PBS清洗3次,4%多聚甲醛固定20 min,结晶紫染色15 min;PBS漂多余染料,电子显微镜下计算透膜细胞数。侵袭抑制率(%)=(1-si-Lgr5组细胞侵袭移个数/si-NC组细胞侵袭个数)×100 %,实验重复3次。
1.2.7 酶联免疫吸附法测定下调LoVo细胞Lgr5表达后血管生成相关因子VEGF、bFGF含量
细胞分组同1.2.3,将各组细胞调整浓度为1×104个/孔接种于96孔板,置于培养箱中培养24 h,弃上清,1% BSA-PBS轻柔洗板一次,每孔加入200μL预冷的0.025%戊二醛静置15 min,PBS洗3次,每孔加入200μL 1% BSA-PBS,37℃下孵育2 h,然后进行包被和封闭;加入一抗,37℃温浴1 h;加入二抗,37℃温浴1 h;甩掉板上的液体,用洗涤液洗涤反应板(向每个孔中加入350 μL洗涤液),并除去水滴,重复洗涤5次。向每个孔中加入100 μL显色底物,轻轻混合10 s,37℃温浴20 min。向每个孔中添加100μL终止液,轻轻混合30s,并在30 min内读取450 nm处的OD值,实验重复3次。
1.2.8 Western blot检测Lgr5及EMT标记蛋白表达
将各组细胞裂解后提取蛋白,使用BCA法检测蛋白质浓度,各组取等量蛋白样品电泳,PVDF膜进行转膜,脱脂牛奶封闭4 h,一抗(Vimentin、E-cadherin、N-cadherin、Lgr5、β-actin)按1∶2000稀释,置于4℃条件下摇床上摇晃过夜。TPBS 溶液漂洗3次,二抗1∶5000 稀释,冰上孵育4 h,TPBS溶液洗3次,曝光显影,实验重复3次。
目的蛋白的相对表达量=目的蛋白的灰度值/β-actin的灰度值。
1.3 统计学分析
2 结果
2.1 正常肠黏膜组织和结肠癌组织中Lgr5的相对表达量
正常肠黏膜组织与结肠癌组织中Lgr5表达量分别为(0.37±0.03)、(0.72±0.04)。与正常肠黏膜组织相比,结肠癌组织中Lgr5表达量增加,差异有统计学意义(t=-12.124,P<0.001)。见图1。
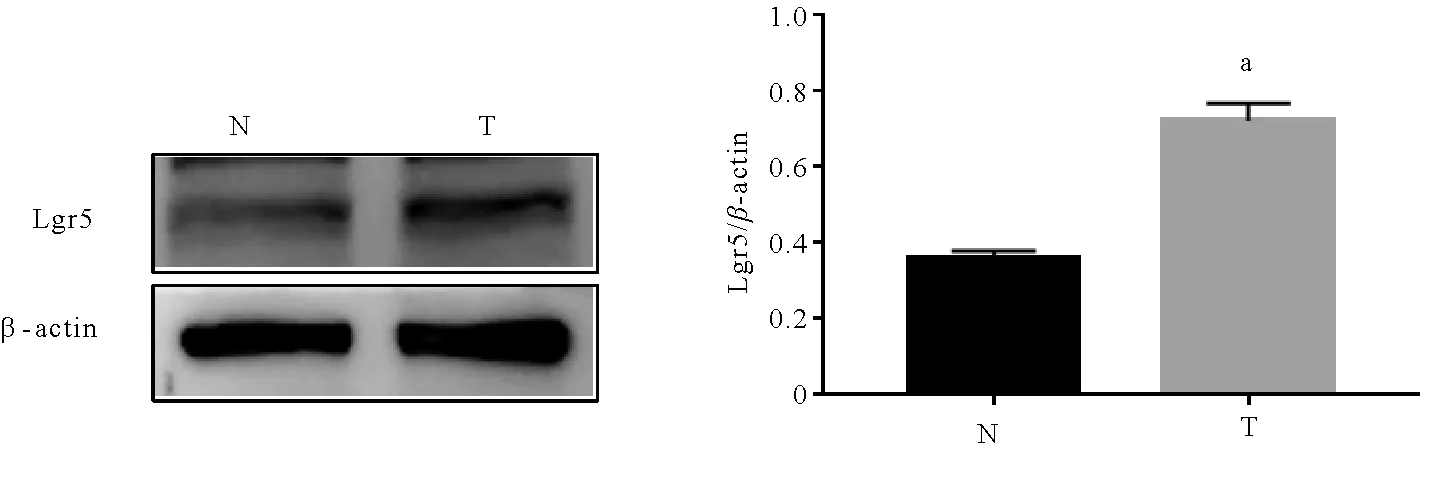
注:N代表正常肠黏膜组织,T代表结肠癌组织,aP <0.05
2.2 筛选CC细胞株Lgr5相对表达最高的细胞株
实时荧光定量PCR检测显示,NCM460细胞、HT-29细胞、SW620细胞及LoVo细胞中Lgr5 mRNA表达量分别为(1.00±0.01)、(1.04±0.02)、(1.28±0.06)及(1.53±0.04)。与NCM460细胞相比,Lgr5在LoVo中mRNA表达量最高,差异有统计学意义(F=32.643,P<0.001)。Western blot检测结果显示,在上述细胞系中Lgr5蛋白相对表达量分别为(0.37±0.02)、(0.41±0.02)、(0.54±0.03)及(0.79±0.05)。与NCM460细胞相比,Lgr5在LoVo细胞中mRNA及蛋白表达量最高,差异有统计学意义(F=26.267,P<0.001)。因此,选择LoVo细胞进行后续实验研究细胞株。见图2。
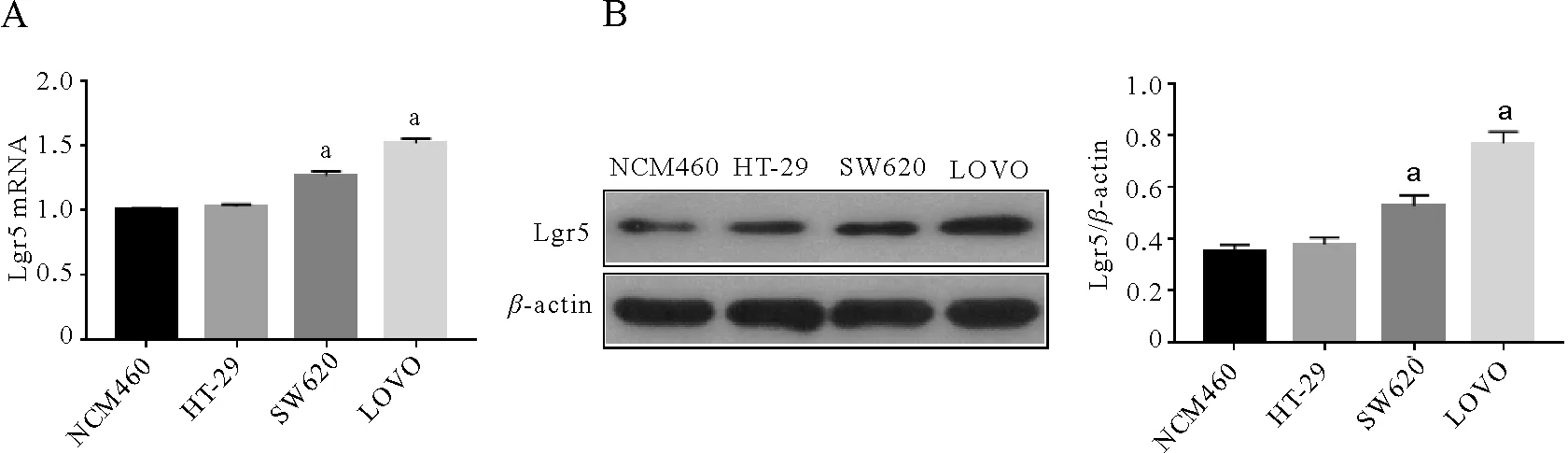
注:aP <0.05;A:RT-PCR法检测多种CC细胞株中Lgr5 mRNA相对表达量;B:Western blot检测各细胞株中Lgr5蛋白表达
2.3 下调Lgr5表达对LoVo细胞侵袭、迁移的影响
对照组、si-NC组及si-Lgr5组细胞侵袭率分别为(100±0.53)%,(98±2.3)%,(65±1.2)%(图3A),根据各组划痕宽度计算出对照组、si-NC组及si-Lgr5组细胞迁移率分别为(100±2.2)%,(96±1.3)%,(55±2.1)%(图3B)。与对照组及si-NC组比较,si-Lgr5细胞侵袭率及迁移率降低,差异有统计学意义(F迁移=18.33,F侵袭=31.75,P< 0.05)。见图3。
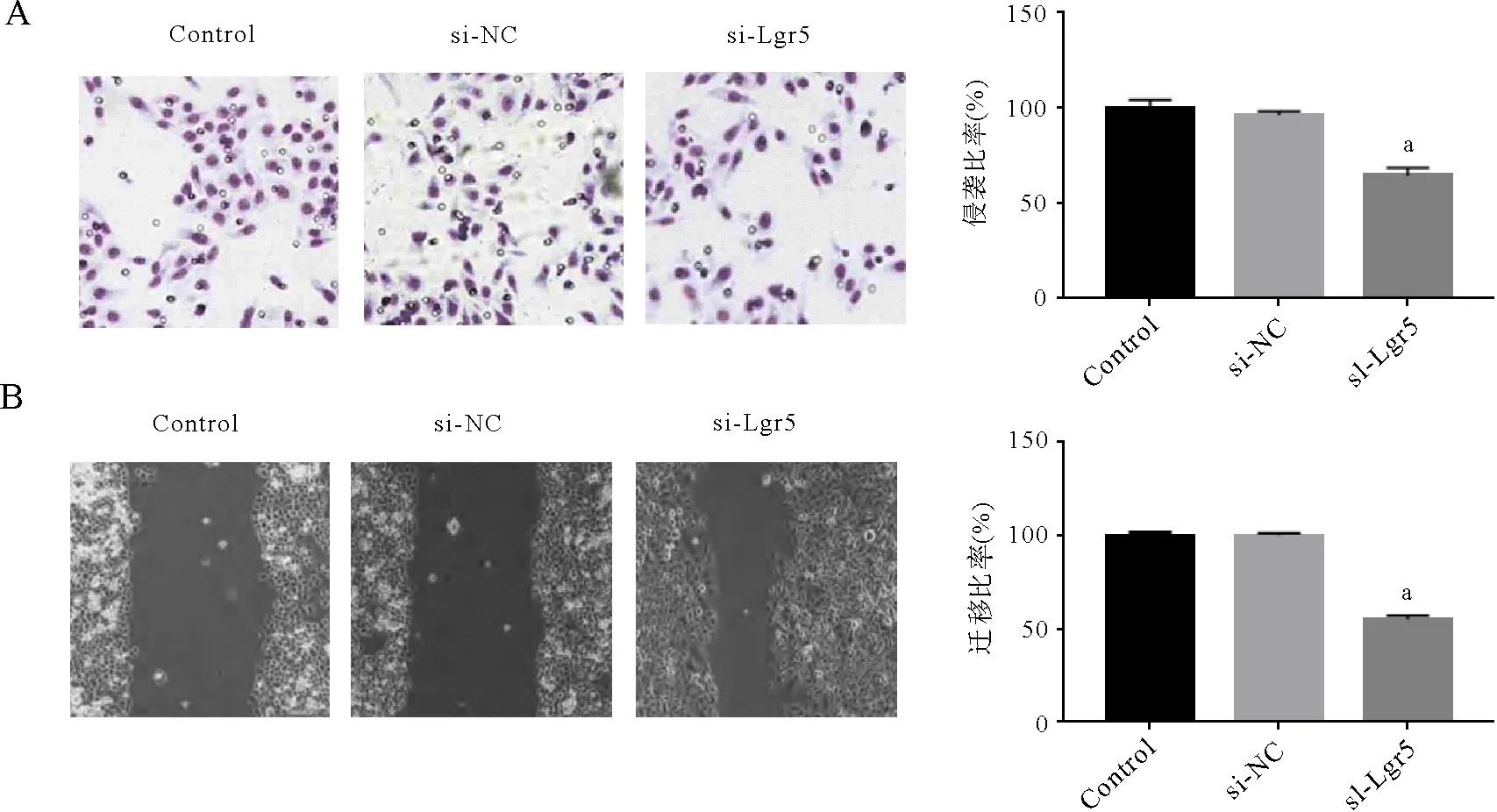
注: aP<0.05;A:Transwell小室检测细胞侵袭能力;B:划痕实验检测细胞迁移能力
2.4 下调Lgr5表达对LoVo细胞血管生成的影响
VEGF在对照组、si-NC组和si-Lgr5组中含量分别为(7.62±0.57)、(7.76±0.62)、(4.16±0.08)pg/mL(图4A),bFGF在上述各组中含量分别为(17.02±1.34)、(18.67±1.25)、(12.33±1.27)pg/mL(图4B)。与对照组和si-NC组比较,si-Lgr5组细胞中VEGF、bFGF含量降低,差异有统计学意义(FVEGF=9.63,FbFGF=14.85,P<0.05)。见图4。
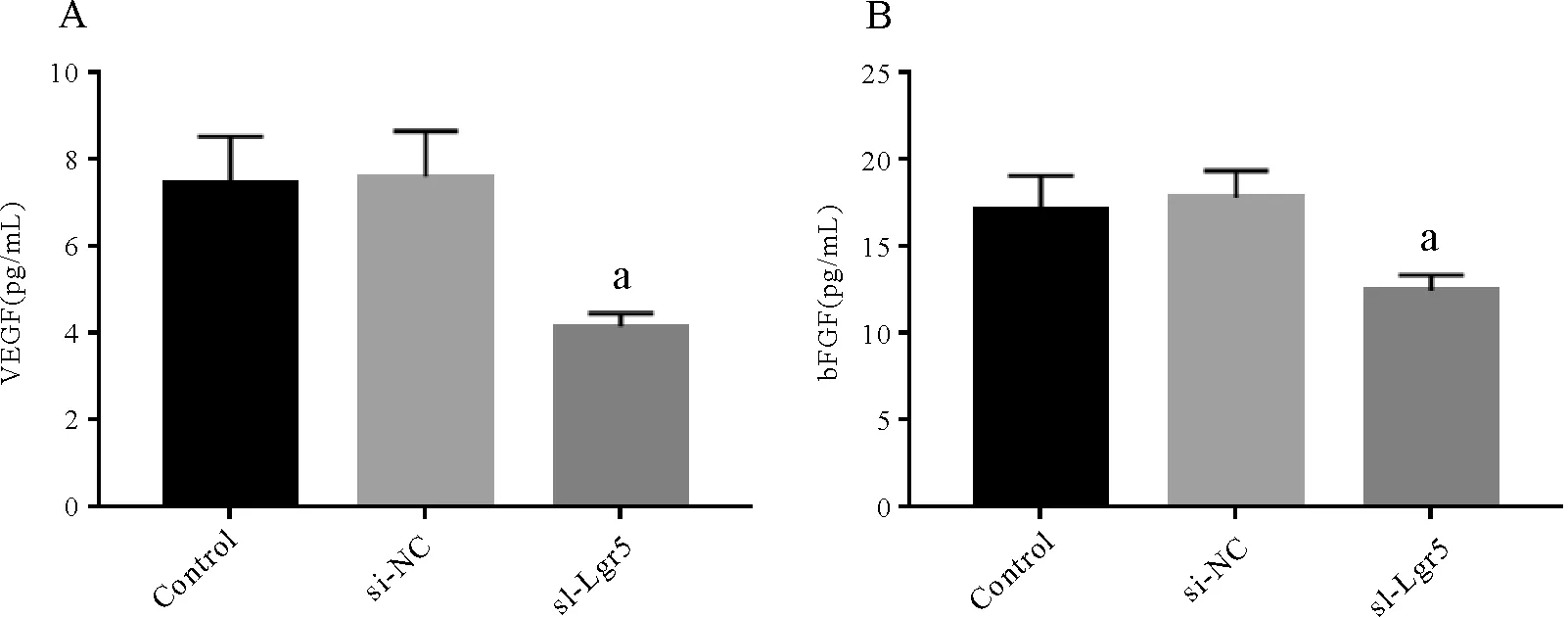
注:aP <0.05
2.5 下调Lgr5表达抑制LoVo细胞侵袭迁移机制的研究
与对照组和si-NC组相比,si-Lgr5组细胞中Vimentin、N-cadherin表达降低,E-cadherin表达升高,差异有统计学意义(P<0.001)。见图5、表2。
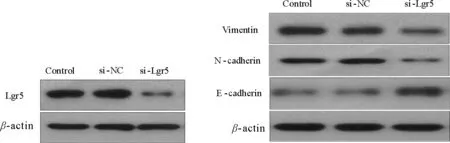
图5 各组细胞Lgr5、Vimentin、N-cadherin及E-cadherin蛋白电泳图
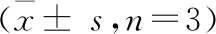
表2 各组细胞Lgr5、Vimentin、N-cadherin及E-cadherin表达变化
3 讨论
EMT是形态发生的基本过程,由此上皮细胞获得间质表型。研究表明,EMT在肿瘤进展中具有关键作用。在恶性肿瘤中,EMT通过许多致癌信号通路、缺氧和肿瘤微环境信号来启动和促进,导致上皮细胞丧失细胞极性和细胞间黏附力,获得迁移和侵袭特性。癌细胞通过EMT对化学疗法产生抗性并获得抑制免疫反应的能力,在许多类型的癌症中,已经观察到EMT激活后癌症干细胞的出现[8]。
研究发现,Lgr5增强下游Wnt/β-catenin信号传导,Lgr5的CC细胞表现出高集落形成、自我更新快、异常增殖的特性,同时,具有以下特征:间充质相关基因(例如Snail、Slug、Zeb1、Zeb 2和N-cadherin)的表达较高,而上皮相关基因(例如E-cadherin)的表达较低,总之,由于Lgr5表达的上调,能够促进CC细胞发生EMT,从而导致CC细胞转移能力增强[9]。本文结果发现,与正常肠黏膜组织相比,Lgr5在结肠癌组织中高表达,LoVo细胞中Lgr5表达量较NCM460细胞和其他CC细胞株(HT-29、LoVo、SW620)高,因而选择LoVo细胞作为后续实验研究对象。
肿瘤细胞的侵袭、转移是临床治疗最大的难题,一旦发生远处转移,往往预示着预后不良[10-11]。本文通过下调LoVo细胞Lgr5表达,并检测细胞侵袭、迁移的变化,结果发现,si-Lgr5组细胞侵袭迁移率小于对照组和si-NC组,结合对结肠癌组织中Lgr5检测结果,说明Lgr5呈高表达,可能是导致结肠癌易转移、浸润的原因之一,而降低结肠癌细胞中Lgr5表达,可能直接抑制LoVo细胞的肿瘤生物行为学能力,有可能成为未来治疗或辅助治疗结肠癌的治疗靶点。
血管新生、新血管的募集是肿瘤血管生成的重要组成部分和转移途径。血管生成通过提供比正常成熟血管少的基膜和更少的细胞间连接复合物,增加了肿瘤细胞进入循环的速度[12]。研究表明,EMT导致的侵袭可能会调节癌细胞的干性并促进肿瘤血管生成[13-14]。反之,越来越多的证据表明,抑制肿瘤细胞EMT,对肿瘤细胞的干性和血管生成可造成负面影响,从而达到控制肿瘤疾病进程的目的[15-16]。VEGF是促血管及促淋巴管新生的细胞因子,在肿瘤中高表达,是肿瘤细胞快速增殖的重要因素[17]。bFGF属多受体细胞因子,其高表达可促进肿瘤细胞侵袭、迁移,降低血管阻力,增加肿瘤组织血供[18]。Vimentin、N-cadherin及E-Cadherin均为肿瘤细胞EMT标志蛋白[19]。本文结果发现,与对照组和si-NC组比较,si-Lgr5组Vimentin、N-cadherin、VEGF和bFGF表达降低,E-Cadherin表达升高,说明下调Lgr5在LoVo细胞中的表达,能抑制肿瘤细胞EMT,能增强细胞间的黏附能力,降低细胞的运动能力,同时减少血管生成,减少其通过自生血管获得更多的“养分”,抑制肿瘤细胞过快增殖,使肿瘤细胞难以转移,这与Transwell小室和细胞划痕实验结果相一致。
综上所述,抑制CC细胞中Lgr5表达,能够抑制LoVo细胞侵袭、迁移,其机制可能与抑制EMT和血管生成有关,这些发现将为结肠癌的诊断和治疗提供新的思路。

