个体化饮食方案在胃癌术后患者中的应用效果研究
胡燕 闫亚敏 陆晶晶 叶艺 虞正红
(复旦大学附属中山医院护理部,上海 200032)
胃癌是消化道常见肿瘤之一,在我国,发病率仅次于肺癌,死亡率高居第3位,由于早期胃癌的诊断率较低,大多发现时已经处于进展期[1]。手术是其主要的治疗方法,但胃癌患者由于营养摄取吸收障碍以及恶病质的消耗,术后消化道的重建又使营养摄取和吸收能力进一步降低,导致术后营养相关并发症的发生率较高,影响生活质量[2-5]。术后早期经口进食,可以有效的促进患者康复,缩短住院时间[6-8],但手术方式及患者个体素质的差异使患者对食物类型的耐受程度不一,胃肠道功能的恢复时间也不完全一致。因此,同质化的饮食指导方案并不适用于所有的胃癌术后患者。个体化的饮食指导是根据患者个体的特异性,制定饮食指导方案,可帮助患者改善饮食习惯进而改善营养状况[8-9]。我科对胃癌患者术后实施个体化饮食指导后,取得较好的效果,现报告如下。
1 资料与方法
1.1一般资料 采用前后期对照的方法,选取2019年2-9月我院普外科行胃癌根治术的84例患者为研究对象。纳入标准:经胃镜检查或手术病理诊断为胃恶性肿瘤;首次行胃癌根治手术;有正常的听说和理解能力;有固定的联系方式,能接受长期随访;自愿参加本研究。排除标准:严重的肝肾功能损伤者;有精神疾病患者;同时患有其他恶性肿瘤。将2019年2-5月的42例患者设为对照组,6-9月42例患者为观察组,其中对照组退出研究3例(失访1例,过世1例,家属拒绝随访1例),最终纳入39例。本研究已获复旦大学附属中山医院伦理委员会批准(批准号:B2019-047R),患者均签署知情同意书。2组患者一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组患者一般资料比较 例
1.2方法
1.2.1对照组 采用常规饮食宣教,主要包括按胃癌护理常规中饮食指导内容进行宣教,于出院时发放各阶段饮食健康处方。出院后,患者每日起床排空二便后监测体质量。出院后1个月、3个月、6个月进行电话随访,了解患者目前进食种类、进食量及体质量情况。
1.2.2观察组 采用个体化饮食指导,主要包括,(1)根据患者体质量计算每日所需热量:待患者可进食后,发放由营养师、普外科医师和病房护士共同制定的营养指导手册,内容包括胃癌饮食种类科普文、饮食种类及参考食谱、每日所需能量计算方法等。(2)量化饮食量:每次进食时用带有刻度的量杯进行计算,进食量从50 mL/次开始统计,根据患者进食后有无不良反应,进行适当增减调整,做到量化饮食量。(3)一对一饮食指导:床位悬挂饮食日志,记录患者每次饮食种类,饮食量及有无不良反应。每日由高年资护士根据患者手术方式及日志记录情况,对患者进行个体化的饮食指导,以便帮助患者逐步过渡到最佳饮食状态。对于全胃切除患者,避免长时间进食流质,以免引起吻合口狭窄;远端胃切除术患者,避免进食过甜和过浓食物,进食后适当休息,避免引起倾倒综合症;进食后应下床活动,达到每日活动量,以免发生胃排空障碍。(4)术前签署知情同意书,向患者及家属解释研究目的及随访要求,出院前发放随访卡,指导患者及照护者如何正确记录每日饮食量及体质量,注明电话及随访日期。(5)患者出院后2周进行电话回访,指导患者进行饮食状态过渡,解答相关疑问,并分别于1个月、3个月及6个月进行电话随访,内容包括:患者目前饮食种类,每顿进食量、是否按要求进行饮食种类过渡、进食后有无不良反应、如何处理以及体质量变化。
1.3观察指标
1.3.1饮食过渡情况、进食食次数及进食量 2组患者随访时间均至术后6个月。在术后1个月、3个月及6个月3个时间点分别对患者当前的进食种类、进食次数及进食量进行分析评估。
1.3.2体质量及BMI变化趋势 在患者入院、出院、出院1个月、3个月及6个月5个时间点记录患者的体质量及BMI水平,分析患者体质量及BMI的变化趋势及2组患者的体质量丢失情况。
1.3.3营养风险评分 采用NRS 2002营养风险评估量表对患者进行评估,分析患者的营养风险。该量表于2002年欧洲肠内肠外营养学会(European Society of parenteral and enteral nutrition, ESPEN)由Kondrup为首的专家组在128个随机对照研究的基础上研制而成[10]。主要包括3方面内容:营养状况受损评分(0~3分);疾病严重程度评分(0~3分);年龄评分(年龄≥70岁者加1分),总分为0~7分。总分≥3分:患者有营养风险,需要制定营养支持计划;总分<3分:每周对患者进行风险筛查。
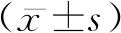
2 结果
2.12组患者饮食过度情况、进食次数及进食量比较
2.1.12组患者饮食过渡情况比较 出院时,2组患者的饮食种类均为流质或半流质,术后1个月,观察组患者21人(50.0%)过渡到软食或普食,而对照组仅7人(17.9%)。术后3个月,观察组有36人(85.7%)进食软食或普食,而对照组有26人(66.7%)进食软食或普食。术后6个月,2组均有90%以上的患者饮用软食或普食。见图1。

图1 2组患者饮食过渡情况
2.1.22组患者每日进食次数比较 随着时间的推迟,2组患者的饮食种类均逐渐过渡到软食或普食,故进食次数均逐渐减少。虽然观察组多于对照组,但2组之间的比较差异无统计学意义(P>0.05)。见表2。

表2 2组患者每日进食次数 次
2.1.32组患者每顿进食量比较 见表3。

表3 2组患者每顿进食量 g
2.22组患者体质量及BMI变化趋势比较 2组患者术后体质量和BMI均呈下降趋势,观察组患者下降幅度<对照组患者。对照组术后1个月时的体质量和BMI下降最为明显,之后逐渐回升,术后6个月时体质量与观察组持平。对照组患者BMI在术后1个月、3个月及6个月时均低于观察组。见图2。术后1个月时,对照组体质量丢失比>10%的占43.6%,明显高于观察组(28.5%)。术后3个月及6个月时,2组之间的比较差异无统计学意义(P>0.05)。随访期间,对照组患者在术后1个月是体质量丢失最为严重,平均为6.6 kg,之后稍有上升趋势;观察组患者体质量呈逐渐下降趋势,在术后6个月时,体质量丢失>对照组,差异有统计学意义(P<0.05)。见表4。

图2 2组患者体质量及BMI变化趋势

表4 2组患者随访期间体质量丢失情况 例(%)
2.32组患者NRS2002营养风险评分比较 见表5。

表5 2组患者NRS 2002营养风险评分比较 分
3 讨论
3.1个体化饮食方案有助于患者饮食过渡 胃癌术后加入成分营养并不能改善患者体质量减轻程度,日常饮食仍是患者营养的主要来源[11]。但随着胃癌患者的增多,床位周转率的提高,患者住院时间相应缩短,以至于患者出院时仍保持流质或半流质的饮食状态。常规的出院指导多强调患者饮食要循序渐进,少量多餐,而对于究竟什么时候可以过渡到下一阶段的饮食种类,往往只用“过一段时间”来解释,而没有一个明确的标准。胃癌术后患者及家属多存在营养知识缺乏,不能有效优化膳食结构,改善营养状况[12]。虽然居家营养支持可明显降低患者的营养风险,减轻体质量丢失,降低营养相关并发症的发生率[13-14],但由于对疾病认知有限和过度紧张,家属经常出现不敢给患者进普食的情况。
本研究通过对胃癌患者术后进行个性化的营养干预,探讨随访期间患者的饮食过渡情况及其对营养状态的影响。结果显示,观察组出院后1个月约有50%的患者完成了饮食种类的过渡,随着能量密度的增加,患者术后3个月的营养风险低于对照组。本研究中,术后1个月时,观察组患者21人(50.0%)过渡到软食或普食,高于对照组7人(17.9%)。术后3个月,观察组有36人(85.7%)进食软食或普食,高于对照组26人(66.7%)。避免出现患者长期使用流质及半流质的情况,降低因能量供给不足引发的营养问题,同时也降低胃瘫和吻合口狭窄等并发症的发生率。进食量方面,术后1个月时,2组患者每顿进食量的比较虽无统计学差异(P=0.053),但观察组患者的进食量高于对照组。术后3个月及6个月,观察组患者每顿进食量明显高于对照组患者(P<0.05)。
3.2个体化饮食方案有助于患者体质量维持 体质量减轻不仅可预测患者的总体生存率,同时可降低患者对化疗药物的反应,降低化疗效果[15]。在体质量持续降低同时接受姑息性化疗的群体中,患者整体生活质量和行为能力评分都有所下降[16]。本研究结果表明,2组患者术后体重均呈下降趋势,对照组患者以术后1个月时下降最为明显,观察组以术后6个月最为明显。这与国外学者Bowrey[13]团队研究结果较为一致。术后1个月时,对照组患者体质量丢失比在10%以上的占43.6%,明显高于观察组。本研究中,术后6个月时,观察组体质量丢失高于对照组,但两组之间患者体质量并无明显差异,推测原因可能与两组患者体质量变化特点不同有关。因此,建议未来仍需进行大样本、长周期的临床研究,深入探讨个体化营养指导对患者体重变化的影响。
3.3个体化饮食方案降低患者的营养风险 肿瘤患者营养风险的评估及干预可明显改善患者的营养状态,进而影响肿瘤患者的临床结局和对化疗的耐受程度[17-18]。通过营养风险筛查,根据患者的饮食习惯、营养状态及消化功能,为不同患者提供最佳合理的膳食方案,有望降低术后患者的营养风险。本研究中,术后3个月时,观察组患者营养风险评分低于对照组,差异有统计学意义(P=0.011)。
综上所述,个体化的饮食指导可以让患者及家属做好术后饮食管理,降低术后营养风险,改善患者的营养状态。本研究的局限性在于:样本量较少,没有进一步评价2组患者在不同时间点摄入的热量,因此,有待样本量更大、随访时间更长的临床研究进行验证。

