红花烟草叶片愈伤组织诱导与植株再生
董行健,余宗波
(1.华中农业大学 生命科学技术学院,武汉 430070;2. 武汉益锦祥生物环保有限公司,武汉 430070)
1 背景介绍
烟草是一种一年生或有限制性的多年生的草本植物,全株被细毛,基生稍木质化,在夏天和秋天开花。烟草原产于南美洲,在我国南方各省和地区种植广泛,主要用途是作为烟草工业的原料,以及用于农药,药用麻醉,催汗,镇定,催吐等。[1]烟草是研究细胞工程中细胞脱分化和再分化的理想材料,也是获得遗传变异和改善农艺性状的重要材料。与此同时,烟草愈伤组织也是细胞生物学,分子生物学和遗传学基础研究的重要实验材料。[2]细胞工程是生物工程的一个重要分支学科,是细胞生物学与遗传学的交叉领域,主要利用细胞生物学的原理和方法,结合工程学的技术手段预先设计,有计划地改变或创造细胞遗传性的特性。目前细胞工程主要的技术包括细胞培养,细胞融合,对染色体的操作,基因的转移等。[3]胼胝质又称愈伤组织,是植物中一种由实质细胞组成的一种不形成特定结构的组织,通常出现在植物的伤口部位。18世纪,法国植物学家亨利 路易斯观察了植物伤口的愈合过程,首次描述了愈伤组织的形成过程。来自未成熟胚胎诱导的愈伤组织可以多次再生,[4]而来源于成熟胚胎诱导的愈伤组织不可再生。基因、激素、光照均可以影响愈伤组织的再生。[5]在本实验中,建立了烟草愈伤组织的组织培养再生体系。
2 材料和方法
2.1 植物材料
红花烟草(Nicotianaxsanderae)由华中农业大学生命科学技术学院提供的种子。
诱导培养基:
MS 19.45 g/L
BA 0.20 mg/L
NAA 0.20 mg/L,
Agar 7.0 g/L
Sucrose 15.0 g/L
分化培养基:
MS 19.45 g/L
BA 0.80 mg/L
NAA 0.20 mg/L
Agar 7.0 g/L
Sucrose 15.0 g/L
1% NaOH或者1% HCL调节pH值至5.8-6.0
2.2 方法
2.2.1 配置烟草愈伤组织诱导培养基:
MS 19.45 g/L
BA 0.20 mg/L
NAA 0.20 mg/L,
Agar 7.0 g/L
Sucrose 15.0 g/L,
加入2/3至3/4体积的双蒸水,用NaOH和HCI搅拌溶解调节pH至5.8-6.0。将烧杯放置于电炉上,加入琼脂然后搅拌并加热5分钟使之完全溶解,然后用蒸馏水固定到500 ml的体积,继续加热几分钟并混匀,分装到12个三角瓶。然后用标记笔依次标记。在高压蒸汽灭菌锅灭菌已包装的培养基(灭菌条件为121摄氏度,1.1kg/cm2的压力)经过20分钟灭菌,将诱导培养基放置入灭菌室。
2.2.2 烟草愈伤组织分化培养基的配置:
MS 19.45 g/L
BA 0.80 mg/L
NAA 0.20 mg/L
Agar 7.0 g/L
Sucrose 15.0 g/L
加入2/3-3/4体积的蒸馏水,搅拌后溶解,加入NaOH和HCL 调整 pH至 5.8-6.0.将烧杯放置在电炉上, 然后搅拌加热约五分钟并加入琼脂至完全溶解再用蒸馏水定容至500 ml. 继续加热几分钟并搅拌均匀并均匀分装到12个三角瓶.然后用记号笔分别标记,在高压蒸汽灭菌锅灭菌已分装好的培养基。
(灭菌温度为121摄氏度,压强为1.1kg/cm2)经过20分钟灭菌,将分化培养基放置入灭菌室)
2.2.3 烟草叶片接种和培养条件
用75%乙醇擦洗超净台,将材料,工具,12瓶诱导培养基等放入台面。紫外灯灭菌15分钟后,打开风扇开始接种操作。关闭紫外灯,点燃酒精灯,通过酒精灯干热灭菌镊子和手术刀。取一无菌皿和一两片无菌的幼叶,在无菌皿中用灭菌的解剖刀将幼叶切割成5mm2左右的小片,然后将其接种于准备好的培养基上,每瓶接种5小片。快速封号瓶口,用记号笔写上姓名和接种日期。接种后的烟草6瓶放于黑暗培养,6瓶放于光照培养。光周期为12小时/每天,培养温度为24摄氏度。可以观察到愈伤组织的诱导过程。在外植体切割过程中,动作要快,以免失水而影响生长。每完成一次操作后,及时将镊子,解剖刀插入酒精瓶中,下次使用前需将酒精烤干消毒后再使用。
2.2.4 烟草叶片诱导情况的观察
仔细观察接种的烟草叶片的愈伤组织和不定芽的诱导情况,比较了光照和黑暗条件下愈伤组织诱导情况的差异,记录并分析原因。
2.2.5 将烟草叶片从诱导培养基接种入分化培养基
14天后,将愈伤组织从诱导培养基转到分化培养基。用75%乙醇擦洗超净台,将材料,镊子,解剖刀,培养基等放入超净台。紫外线灭菌15分钟后开始操作。双手消毒,进入超净台开始接种。关闭紫外灯,点燃酒精灯,在酒精灯下烘烤镊子和解剖刀。将烟草愈伤组织从诱导培养基转移到分化培养基。每瓶接种5片烟草愈伤组织,共接种12瓶。迅速密封瓶口,用记号笔写好姓名和接种日期。
接种后,所有愈伤组织每天以10小时/天的光周期培养,培养温度为24°C,培养63天,观察不同光照条件下诱导的愈伤组织的是否生成不定芽以及不定芽的数量和愈伤组织再分化的状态,并作出记录。
2.3 数据统计和分析
经过63天的再分化诱导,观察12瓶分化培养基中愈伤组织的状态先观察整体情况:是否出现污染,是否每一瓶分化培养基都有再生植株。最后,将再生外植体从分化培养基中取出并做如下工作:
(1)对再生植株数量的统计,收集在光照和黑暗诱导下的愈伤组织并做统计计算;
(2)统计每一瓶分化培养基中的再生植株数量并计算平均每一团愈伤组织的再生不定芽;
(3)比较在光照和黑暗条件下诱导的愈伤组织的差异。
3 实验结果
3.1 愈伤组织的诱导
先研究原始外植体诱导成愈伤组织的状态,原始外植体(幼叶)分别在光照和黑暗条件下诱导培养14天,愈伤组织的诱导情况如表1(Table 1)显示。我们首先观察了愈伤组织的形态,光照和黑暗条件下诱导的愈伤组织的颜色和大小有显著不同。在黑暗条件下诱导的愈伤组织普遍黄化(Fig.1 a),然而在光照条件下诱导的愈伤组织普遍是亮绿的 (Fig.1 b). 在光照条件下诱导的愈伤组织体积也比黑暗条件要大。
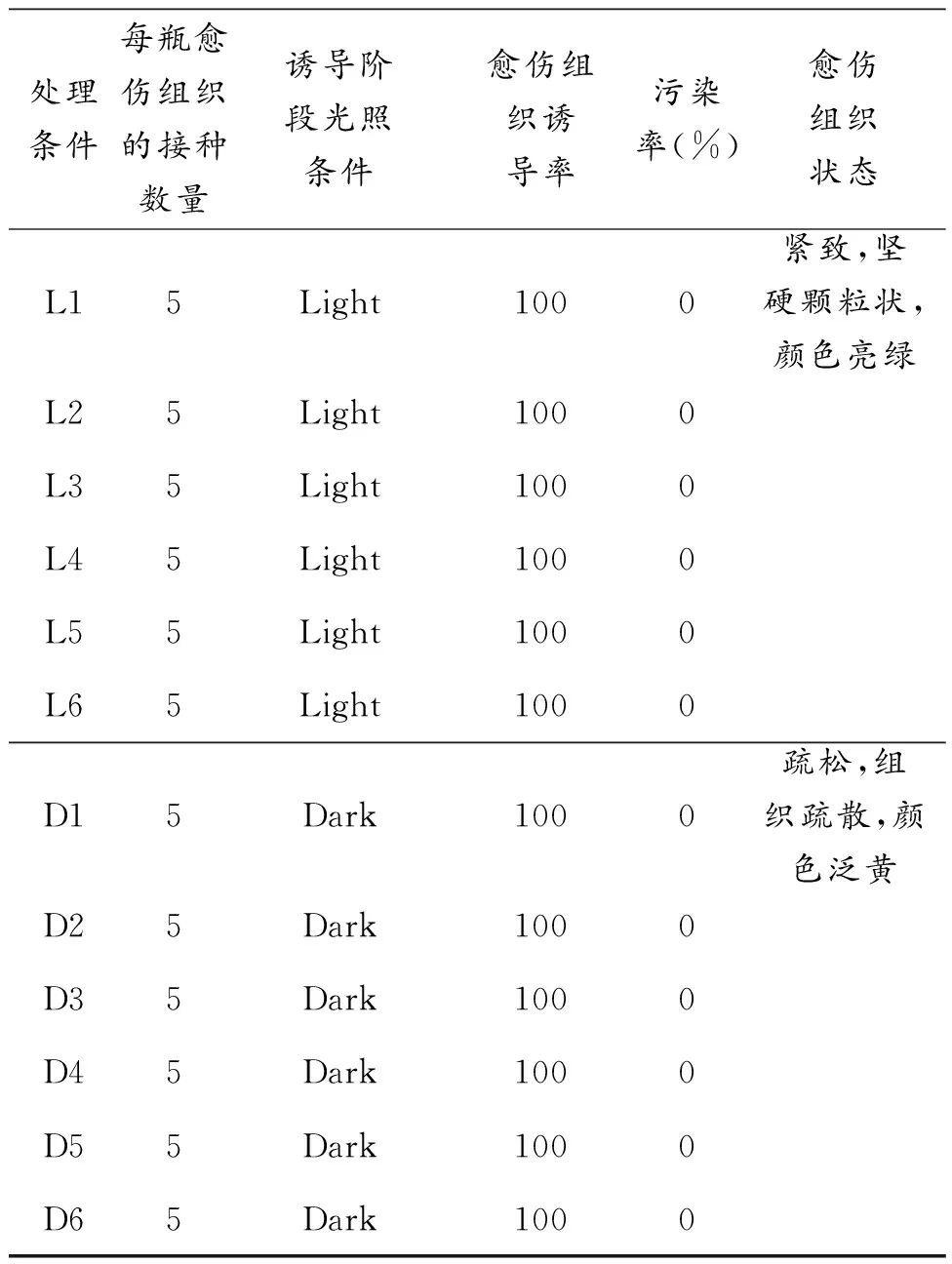
Table1 Results of callus induction from tobacco leaves

Fig.1 在不同条件下愈伤组织的诱导情况:a 一瓶典 型的烟草外植体在黑暗条件下诱导形成的愈伤组织;b 一瓶典型的烟草外植体在光照条件下诱导形成的愈伤组织。相比于光照条件,黑暗条件下诱导的愈伤组织普遍发黄并矮小,光照条件下诱导的愈伤组织普遍亮绿并体积更大,生长更加健壮
3.2 愈伤组织再分化及植株再生
把诱导培养基中的愈伤组织切除下来并在分化培养基中培养,愈伤组织进行增殖和植株再生。所有处理的试验数据在表2(Table 2)中展示。6周后将再分化的愈伤组织从分化培养基中收集并展示在图二(Fig.2) 。从外观上看,在光照和黑暗条件下再分化的愈伤组织略有不同,再生植株也在颜色和形状上略有差别(Fig.3)。

Table 2 烟草愈伤组织再生的统计结果
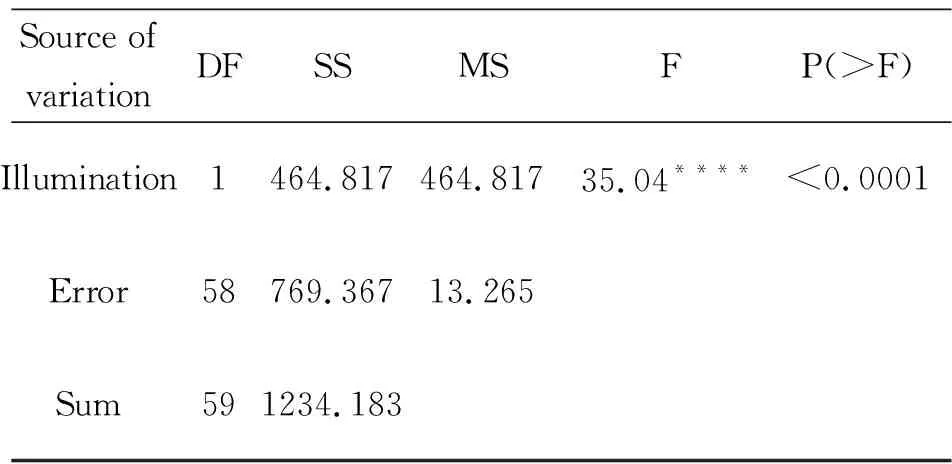
Table 3 Variance analysis

Fig.2 在第六周收集的再分化的愈伤组织:a一瓶典型的在黑暗中诱导的愈伤组织的再分化状况;b一瓶典型的在光照中诱导的愈伤组织的再分化状况。所以在早期就可以预测,在光照条件下诱导的愈伤组织长势比在黑暗条件下诱导的愈伤组织更好,因为在光照条件下诱导的愈伤组织更有活力

Fig.3 烟草愈伤组织的再分化情况:a 5团典型的在黑暗条件下诱导的愈伤组织的再分化情况;b 5团典型的在光照条件下诱导的愈伤组织的再分化情况。我们可以得出结论:在同样的光照再分化条件下,在黑暗条件下诱导的愈伤组织再分化后会泛黄,再分化的芽的体积较小,然而光照条件下诱导的愈伤组织再分化后体积更大,再分化的芽的数量更多。
为显示不同诱导培养条件下愈伤组织的差异,并鉴定最好的培养条件,利用方差分析ANOVA (Analysis of Variance)且借助SAS软件的帮助算出F值 (Fig.4)。 结果发现,在光照条件下诱导的愈伤组织的再生芽的平均数量是20.9,在黑暗条件下诱导的愈伤组织的的再生芽的平均数量为15.3,由此可见在光照条件下的愈伤组织的诱导毫无疑问比在黑暗条件下更成功。

Fig.4 数据的描述使用SAS来帮助处理原始数据。单因素ANOVA方差分析是实验的最好模型a SAS 单因素方差分析对原始数据分析的源代码b SAS程序方差分析的结果输出可视化c y的分布y: 每一团愈伤组织再生的不定芽数量 1:在光照条件下诱导2: 在黑暗条件下诱导,在光照条件下平均每一团愈伤组织的再生不定芽的数量为20.9, 标准差为4.326,在黑暗条件下平均每一团愈伤组织的再生不定芽的数量为 15.33 标准差为2.796. 在光照条件下诱导的愈伤组织的平均再生不定芽数量显著多余黑暗条件下诱导的愈伤组织。图片通过SAS语言代码实现可视化。
每一瓶培养基接种5团愈伤组织,共有12瓶诱导培养基 ,培养基上标注L和D,“L” or “D”. L: light condition, D: dark condition.
收集了12瓶愈伤组织,并描述了再生芽的数量,体积,颜色和坚硬度。在表中显示了原始数据. 培养基上被标记 “L” or “D”. L: light condition, D: dark condition.
F=464.817/13.265=35.04, P(>F) <0.0001, 得出结论在光照和黑暗条件下诱导的愈伤组织在不定芽再生过程中分化不定芽的数量有显著差别。
4 讨论
4.1 光照和黑暗对愈伤组织诱导的影响
实验分析了光照,黑暗条件对烟草叶片愈伤组织的诱导和植物再生的影响。首先,在光照和黑暗条件下诱导的愈伤组织在外观,颜色,形态,和体积方面都有显著差异。黑暗条件下诱导的愈伤组织一般呈黄色,体积小,光照条件下诱导的愈伤组织呈亮绿色,体积大。由此可见,光照条件更有利于植物愈伤组织的诱导和再生。先前的研究证明过光照可以促进愈伤组织的生长[6],实验结果与之前的研究一致。
4.2 连续光照有利于愈伤组织再分化的原因
另外,连续光照的条件有利于愈伤组织细胞再分化与维管组织的形成, 这可以解释在光照条件下的愈伤组织可以在没有外源激素刺激的情况下独立分化为芽与根的现象。[7]值得注意的是,高辐射强度的光也可能可以破坏维管组织,[8]并影响愈伤组织的生长。因此光培养室的光强度应该符合自然环境,以保护愈伤组织。在分化时,将所有的愈伤组合接种到分化培养基中,转入10h/天的光照条件。尽管在再分化阶段,所有的愈伤组织都是在相同的条件下培养的,但在黑暗和光照条件下诱导的愈伤组织生成的植株有显著差异: 在光照条件下诱导的愈伤组织在体积上更大,再分化的芽面积更大,更健壮,有的再生芽甚至长成了完整植株。[9]相比而言,在黑暗条件下诱导的愈伤组织再生的芽更矮小,绝大部分再生芽高度未超过2mm,再生芽的颜色也更偏黄。在数量上,光照条件下诱导的愈伤组织的再生芽也显著高于在黑暗条件下诱导的。早期研究曾经提出,光照会抑制不含叶绿素的愈伤组织的细胞的再分化,[10]在黑暗中诱导的愈伤组织积累了很少或没有积累叶绿素, 所以在被转移到光照环境下之后,它的生长可能收到限制,导致再分化的不定芽的数量显著少于在光照条件下诱导的积累了叶绿素的愈伤组织。另外, 光周期也是一个另外的影响愈伤组织再分化的重要因素,对于烟草愈伤组织的再分化而言,最适合的光周期是最接近自然情况的每天12-16小时。[11]昼夜节律和光周期长短不仅有利于愈伤组织再生的极性建立和模式形成,也与器官的分化相关。研究显示,在长的光周期和低浓度蔗糖的培养条件下,红花烟草倾向于发育成不定芽而不是生根,相比而言,短的光照周期和高浓度蔗糖的培养条件有利于愈伤组织生根和生成块茎。[12]
4.3 在烟草外植体组织培养中出现的问题及预防和解决方案
另外一方面,虽然大部分植株再生状况都很好,一小部分愈伤组织褐化和玻璃化是正常现象。一开始笔者认为外植体褐化是因为靠近酒精灯被灼烧的原因,但实际上褐化过程主要发生在外植体培养,愈伤组织继代培养,悬浮细胞培养,原生质体分离和培养的过程。外植体褐化不仅影响愈伤组织的诱导,而且还会影响愈伤组织的正常的生理生化反应,进而影响愈伤组织的再分化生长。众所周知,多酚氧化酶(PPO)和过氧化物酶(POD)是导致外植体和愈伤组织褐化的两种关键酶。[13]在正常条件下,细胞内酚类物质和醌类物质的浓度之间保持着动态的平衡。通常醌类物质的浓度很低,但酚氧化酶和酚类物质分布在正常组织的各个部位。酚类物质分布在各个细胞的液泡中,酚氧化酶则分布在各种质体和细胞质中。质膜隔离了酚类物质和酚类氧化酶造成了这种区域性的分布。但是,当外植体或愈伤组织遭遇类似于高渗透压,机械损伤,细胞损伤,老化,细胞膜结构或细胞器膜结构的损伤,均会导致酚氧化酶的合成和释放。 此时,在适宜的PH和温度条件下,酚类氧化酶,酚类,氧气会发生氧化反应,生成有毒害的醌类物质,导致组织褐化。导致愈伤组织褐化的原因有多种,其中一个重要原因可能是实验过程中操作不规范,导致细胞壁,细胞膜,液泡的损害,导致酚类物质和多酚氧化酶的接触。在植物中有活性的多酚氧化酶,在有氧环境下,催化酚类物质转化为醌类物质和水。同时,过氧化物酶也会催化生成气态的过氧化氢,加快酚类物质氧化成醌。醌类化合物与蛋白质或其他氨基/巯基化合物自发聚集,形成棕色的产物,导致其他酶促反应系统失活,生理代谢紊乱,从而导致外植体和愈伤组织的褐化。最终培养基中的温度过高或者光强过强,会促进褐化反应的发生。[14]同时,植物的物种,基因型,外植体的年龄,外植体在原有植株上的位置,外植体的大小,外植体培养方法都与外植体的褐化有关。为了抑制外植体的褐化并根除褐化对植物造成的伤害,可以采取一下措施;1.选择具有较强再分化能力的外植体; 2.选择适合的培养环境;3.缩短转瓶继代的时间周期;4.在培养基中加入活性炭来吸附酚类物质;5.在培养基中加入氰化钾作为抗氧化剂,来根除醌类和半醌类物质。[15]当然必须注意评估加入的化学物质是否对外植体的生长和愈伤组织再分化有害。对于玻璃化的问题,它会导致不正常的植物形态和大小:植株会变矮小,叶片会呈透明或半透明水浸状。解剖学特征包括:植株会矮小并肿胀, 没有结间或结间非常短,呈玫瑰花环状, 杆状或其他形状。该组织的主要表现是疏导组织发育不良,茎间分生能力较弱,芽发育状况较差,所以难以分化和生根。玻璃化的叶片往往呈半透明的亮绿色,皱缩。薄壁组织往往过度生长,叶肉被充满叶绿体的实质细胞充满,栅栏组织细胞层的数量减少,海绵状叶肉细胞之间的间隙变小,角质层缺失或仅存在薄薄的角质层,没有典型的表皮细胞和主叶脉。总而言之,如果植株发生玻璃化,植物的生长会遭受显著的影响,甚至会导致植物的最终死亡。[16]外植体的生理年龄,器官的类型,大小,培养条件,外植体的基因型都会对外植体的玻璃化产生影响。对于愈伤组织来说,可能是因为不佳的通气条件[17]和缺乏能显著降低玻璃化机率的紫外线造成的。[18]为了防止外植体的玻璃化,笔者提出以下解决方案:(1)控制光节律的每天光照时间为12-16小时/每天,如果每天光照时间超过18小时,玻璃化反应会自动发生;(2)适当提高培养基中的蔗糖和琼脂浓度;(3)适当地降低培养基中细胞分裂素和赤霉素的浓度4.提高外植体培养基中硝态氮比铵态氮的比例。[19]有些解决方案背后的机理仍需要我们去研究。
4.4 外植体再分化的其他影响因素
当外植体经历再分化的过程,也必须考虑一些其他的环境条件如水分。水分的影响包括培养基中的水分和外界环境中的水分。培养基中的水分受培养条件和密封薄膜的影响。经证实,如果密封膜过紧,外植体的生长会受抑制。在培养室中的水分含量跟在培养基中的水分含量一样重要,可以利用湿度调节器将培养室的相对湿度控制在70%-80%。[20]
特别鸣谢:这项研究是由华中农业大学隶属于生命科学技术学院生物实验教学中心所支持的(Biology Experiment Teaching Center of College of Life Science and Technology, Huazhong Agricultural University)。感谢华中农业大学生命科学技术学院的齐迎春教授,杜鹃副教授,陈浩副教授,谢婷婷副教授对本实验的指导;也感谢研究生助教为实验材料的提前准备的辛勤付出。

