酪蛋白糖巨肽酶解产物抗氧化活性及其对RAW 264.7细胞氧化损伤的保护作用
唐麒雯,吴泽仪,余宁翔,叶沁,孟祥河*,聂小华*
1(浙江工业大学 食品科学与工程学院,浙江 杭州,310014) 2(浙江省农业科学院 食品科学研究所,浙江 杭州,310021)
氧化应激是生物体内氧化与抗氧化作用失衡的一种状态,可造成脂质、蛋白质和DNA等氧化损伤而引起细胞凋亡,其已被证实与多种慢性疾病、衰老有着密切关系[1]。为此,应用抗氧化活性物质成为了降低生物体氧化损伤的一种策略。抗氧化肽源于食品蛋白质,由于具有资源丰富、稳定性好、安全性高等优势,逐渐备受关注。
酪蛋白糖巨肽(glycomacropeptide,GMP)是一种具有64个氨基酸残基的糖肽,富含缬氨酸、亮氨酸等支链氨基酸,但几乎不含苯丙氨酸、酪氨酸和色氨酸等芳香族氨基酸[2];其主要糖基为唾液酸[3]。正因为GMP独特的氨基酸构成,其酶解产物在结构与功能活性方面可能不同于其他蛋白酶解产物。近年来科研工作者开始关注GMP酶解产物,发现其具有益生、抗炎等功能活性,如GMP酶解产物可促进保加利亚乳杆菌和嗜热链球菌的生长[4];可通过阻断NF-κb信号通路,抑制脂多糖(lipopolysaccharide,LPS)诱导的巨噬细胞中一氧化氮(nitric oxide,NO)产生和炎症因子mRNA表达,发挥抗炎作用[5]。
目前国内外关于GMP酶解产物的抗氧化性研究报道较少,仅CHENG等[6]采用木瓜蛋白酶酶解GMP,发现其酶解产物对RAW 264.7小鼠巨噬细胞的氧化损伤有保护作用。基于此,本文拟采用碱性蛋白酶、中性蛋白酶和木瓜蛋白酶等商业酶制剂对GMP进行降解,比较其酶解产物的自由基清除能力与抗氧化损伤能力,为GMP酶解产物功能食品配料开发提供研究依据。
1 材料与方法
1.1 材料与试剂
GMP,丹麦Arla公司;中性蛋白酶、木瓜蛋白酶,上海瑞永生物科技有限公司;碱性蛋白酶,上海麦克林生化科技有限公司;RAW 264.7(小鼠巨噬细胞),中国科学院生物化学与细胞生物学研究所上海细胞库;2,4,6-三硝基苯磺酸(2,4,6-trinitro-benzenesulfonic acid,TNBS)、2,2,-联氨-双-3-乙基苯并噻唑啉-6-磺酸(2,2-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS))、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)等试剂均为分析纯,美国sigma公司;焦性没食子酸,国药集团化学试剂有限公司。
1.2 仪器与设备
MCO-17AC型二氧化碳培养箱,日本Sanyo 公司;CKX41型倒置光学显微镜、IX53型倒置荧光显微镜,日本Olympus公司;Synergy H1多功能酶标仪,美国Bio-TEK公司;ACB-4A1超净工作台,南京非同科学仪器有限公司。
1.3 实验方法
1.3.1 GMP酶解产物的制备
采用不同pH的0.1 mol/L磷酸盐缓冲溶液配制30 g/L GMP溶液,按100 U/g添加量分别加入中性蛋白酶、木瓜蛋白酶和碱性蛋白酶,酶解条件见表1,酶解0.5、1、2、4、6 h后取样,快速置于85 ℃下热处理20 min使酶失活;而后快速冷却至室温,离心(10 000 r/min,20 min),上清液冷冻干燥,备用;酶解产物分别命名为N-GMPH、P-GMPH和A-GMPH。

表1 GMP的酶解参数Table 1 Enzymatic parameters of GMP
1.3.2 水解度
参考ADLER-NISSEN等的方法[7]。0.1 mL样液中依次加入1 mL 0.2 mol/L磷酸盐缓冲液(pH 8.2)和1 mL 0.1% TNBS溶液,混匀,50 ℃下避光反应60 min,而后加入2 mL 0.1 mol/L HCl溶液以终止反应,快速冷却至室温,340 nm处测定吸光度。以L-亮氨酸为标准品做标准曲线,根据公式(1)计算水解度:
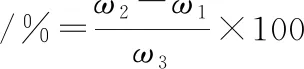
(1)
式中:ω1,水解前的氨基氮质量分数,mg/g (蛋白);ω2,水解后的氨基氮质量分数,mg/g (蛋白);ω3,GMP完全水解后的氮质量分数,mg/g (蛋白)。
1.3.3 抗氧化活性测定
1.3.3.1 ABTS阳离子自由基清除能力
参考WANG等[8]的方法。取0.1 mL样液与3.9 mL ABTS工作液混匀,室温下避光反应10 min,734 nm处测定吸光度。以蒸馏水为阴性对照,以维生素C为阳性对照。根据公式(2)计算其ABTS阳离子自由基清除活性,且以维生素C当量/mL来表示:
(2)
式中:A1,阴性对照吸光度;A2,样液或阳性对照吸光度。
1.3.3.2 DPPH自由基清除能力
(3)
式中:A1,阴性对照吸光度;A2,样液或阳性对照吸光度。
采用HOMAYOUNI-TABRIZI等[10]的方法。0.1 mL样液与2.8 mL 1 mmol/L Tris缓冲液(pH 8.2)混合,加入0.1 mL 30 mmol/L焦性没食子酸引发反应,室温下反应4 min。以蒸馏水为阴性对照,维生素C为阳性对照,320 nm处每30 s测定其吸光度。


(4)
式中:V1,阴性对照氧化速率,Abs/min;V2,样液或阳性对照氧化速率,Abs/min。
河道纵向剖面规划设计应保护河道与河道、河道与湖塘之间的连通性,不设或少设挡水建筑物及构筑物。对河道内已建的壅水、阻水或影响河道排涝能力的建筑物,应给予改(扩)建或拆除。不能拆除的应考虑通过改变运营方式等保持水流畅通,或修建跌水与鱼道工程。
1.3.4 对H2O2诱导RAW 264.7细胞氧化损伤的保护作用
1.3.4.1 细胞培养
RAW 264.7 细胞以RPIM1640(含10%胎牛血清,1%青霉素-链霉素双抗)为培养基,置于37 ℃、5% CO2的培养箱中进行培养。
1.3.4.2 细胞存活率的测定
将对数生长期的RAW 264.7细胞接种到96孔板(1×104/孔),在培养箱中37 ℃培养24 h后,分别加入100 μL样液使其终质量浓度为0.05、0.1、0.5、1 mg/mL,继续培养12 h,再加入100 μL 400 μmol/L H2O2共培养6 h。采用MTT法[11]测定细胞活力。对照组中未加H2O2和样液,其细胞存活率计为100%;双氧水组未加样液。
1.3.4.3 活性氧(reactive oxygen species,ROS)生成量的测定
将对数生长期的RAW 264.7细胞分别接种到96孔板(1×104/孔)和6孔板中(5×105/孔),在培养箱中37 ℃培养24 h后,加入样液使终质量浓度为0.5 mg/mL,培养12 h,然后加入100 μL 400 μmol/L H2O2共培养6 h。采用DCFH-DA法[12]测定细胞ROS生成量,同时使用倒置荧光显微镜观察细胞ROS荧光强度。对照组中未加H2O2和样液;双氧水组未加样液,其ROS生成量计为100%。
1.4 数据处理
所有实验至少重复3次,结果表示为平均值±标准差(SD)。采用GraphPad Prism 7.0软件对实验数据进行单因素方差检验(analysis of variance,ANOVA)及Tukey检验;P<0.05说明统计学上存在显著性差异。
2 结果与讨论
2.1 蛋白酶种类对GMP水解度的影响
蛋白酶种类对GMP酶解程度的影响如图1所示。随着酶解时间的增加,GMP酶解程度逐渐增加而后趋于平缓,其中中性蛋白酶对GMP的酶解作用明显优于木瓜蛋白酶和碱性蛋白酶,后二者之间并无明显差异。这可能是因为:(1)GMP分子中苏氨酸、谷氨酸、脯氨酸等氨基酸残基所占比例较高,基本不含酪氨酸、色氨酸和苯丙氨酸等芳香族氨基酸残基[2];(2)蛋白酶作用位点不同,其中碱性蛋白酶作用位点主要为酪氨酸、苯丙氨酸、色丙氨酸、亮氨酸、异亮氨酸等氨基酸残基,木瓜蛋白酶作用位点主要为赖氨酸、精氨酸、甘氨酸和半胱氨酸等氨基酸残基,而中性蛋白酶作用位点相对广泛,并可酶切苏氨酸残基[13]。
当酶解至4 h时,水解度基本趋于平缓,中性蛋白酶、木瓜蛋白酶和碱性蛋白酶等对GMP的酶解程度分别为(11.82±0.58)%、(9.77±0.92)%和(9.01±0.58)%。该水解度低于已有的研究,如O’SULLIVAN等[14]采用碱性蛋白酶酶解酪蛋白,水解度可达(18.01±1.59)%,这是源于GMP独特的氨基酸组成,其可供蛋白酶的作用位点较少。结果表明,中性蛋白酶对GMP的酶解程度较大。
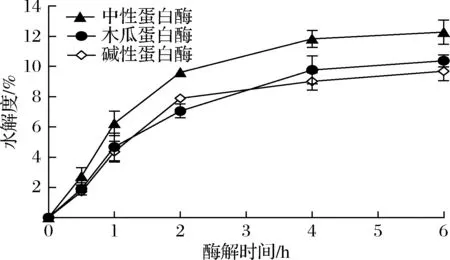
图1 蛋白酶种类对GMP酶解程度的影响Fig.1 Effects of protease type on enzymolysis degree of GMP
2.2 蛋白酶种类对GMP酶解产物自由基清除能力的影响
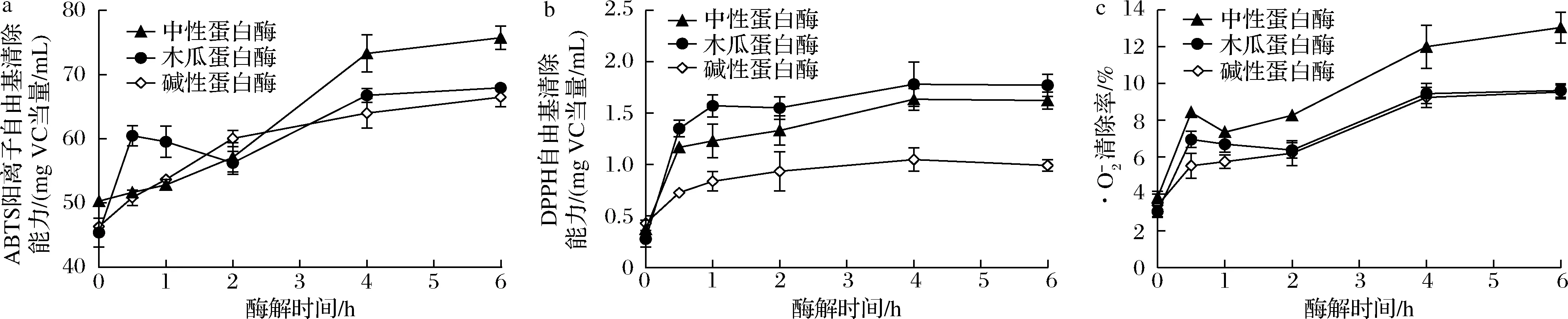
a-ABTS阳离子自由基;b-DPPH自由基;图2 蛋白酶种类对GMP酶解产物清除自由基能力的影响Fig.2 Effects of protease type on free radical scavenging ability of GMP hydrolysate


2.3 对H2O2诱导RAW 264.7细胞氧化损伤的保护作用
2.3.1 氧化模型的建立
H2O2进入细胞后可转化为·OH,具有较强的氧化能力,故常用H2O2建立细胞氧化应激模型。H2O2处理对RAW 264.7细胞存活率的影响如图3所示。结果表明,随着H2O2浓度的增加,细胞存活率下降,说明其诱导了细胞的氧化损伤。其中400 μmol/L H2O2可降低细胞存活率降至(54.72±0.45)%,因此选择400 μmol/L浓度进行实验。
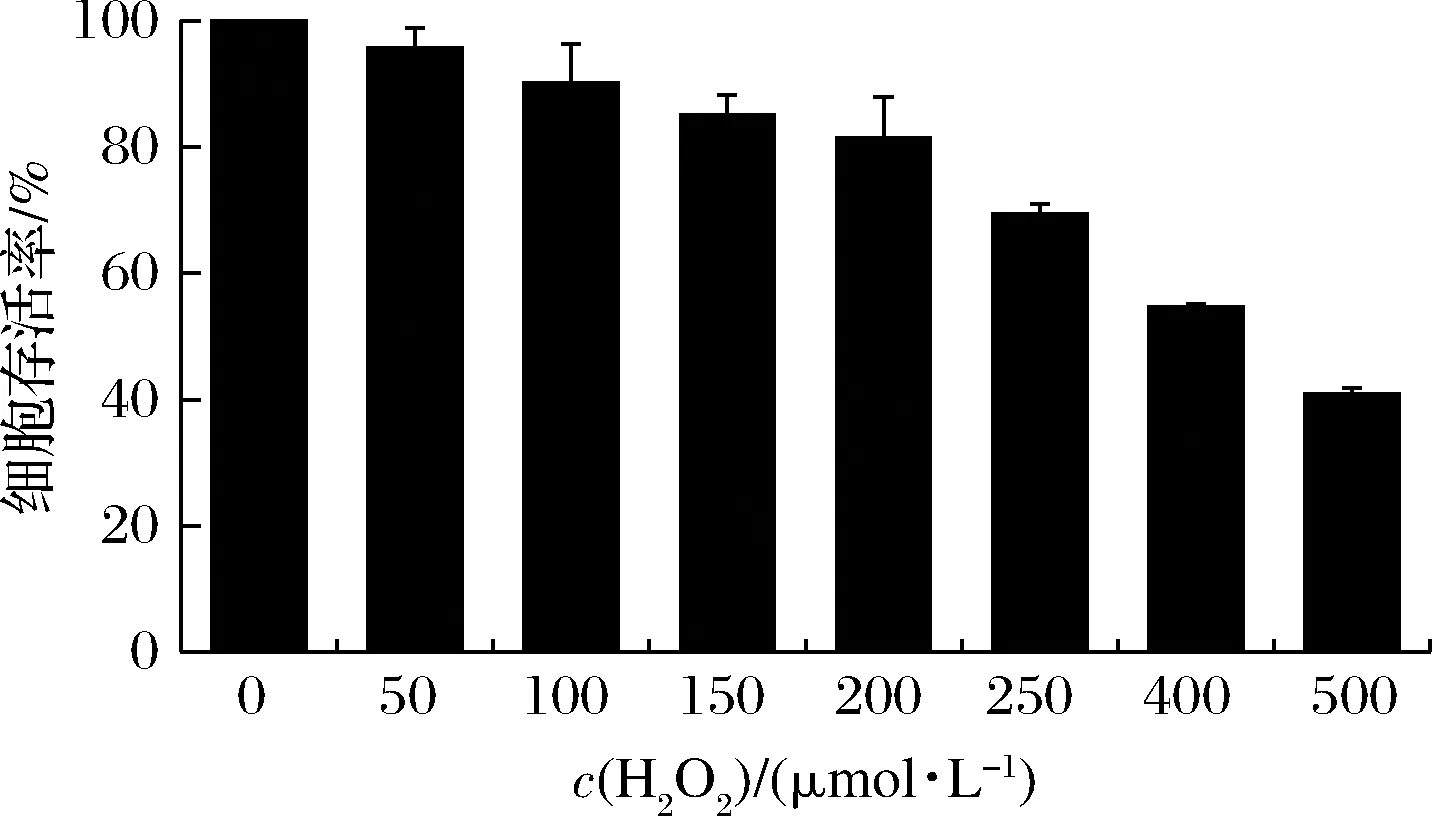
图3 H2O2处理对RAW 264.7细胞存活率的影响Fig.3 Effect of H2O2 treatment on RAW 264.7 cell viability
2.3.2 N-GMPH对H2O2诱导RAW 264.7细胞存活率的影响
GMP经中性蛋白酶酶解4 h后,其酶解产物N-GMPH对RAW 264.7细胞存活率的影响如图4所示。结果表明,GMP预处理对RAW267.4细胞存活率影响较弱,说明其对细胞氧化损伤基本无保护作用;而N-GMPH预处理可显著提高RAW 264.7细胞存活率(P<0.05),这是因为:(1)与GMP相比,N-GMPH本身具有更高的自由基清除能力(图2);(2)N-GMPH含有较多的小分子肽,其容易发生跨膜转运进入细胞内,淬灭H2O2在细胞内经代谢产生的ROS[19],从而发挥抗氧化损伤作用。凌玉芳[20]亦发现,使用双酶(胃蛋白酶-胰蛋白酶)对乳清蛋白进行酶解,其酶解产物显著提高细胞存活率,可改善H2O2所致的PC12细胞氧化损伤。
此外,N-PMPH对RAW 267.4细胞氧化损伤的保护作用呈现浓度正相关;当酶解产物质量浓度为0.5和1 mg/mL时,可将RAW 267.4细胞存活率提高至(79.32±1.85)%和(80.70±1.23)%,二者之间无显著性差异。因此,选用质量浓度为0.5 mg/mL N-GMPH进行后续实验。

图4 N-GMPH对H2O2诱导RAW 264.7细胞存活率的影响Fig.4 Effects of N-GMPH on H2O2-induced RAW 264.7 cells viability 注:不同小写字母表示差异显著(P<0.05)(下同)
2.3.3 N-GMPH对H2O2诱导RAW 264.7细胞内ROS生成量的影响
过量ROS会破坏细胞内氧化和抗氧化系统之间的平衡,导致氧化应激,从而进一步破坏细胞的结构和功能[21],所以ROS水平可用于反映细胞氧化损伤程度。GMP经中性蛋白酶酶解4 h后,其酶解产物N-GMPH对H2O2诱导RAW 264.7细胞内ROS生成量的影响如图5所示。H2O2显著提高了RAW 264.7细胞中ROS生成量,说明细胞氧化损伤主要源于ROS的大量增加。GMP可降低ROS生成量,但下降程度仅为(6.29±0.76)%,这在一定程度上可解释GMP对细胞氧化损伤无保护作用(图4);而N-GMPH显著减少细胞中ROS生成量至(44.50±2.29)%,该结果验证了其具有良好的抗氧化活性。
同时,荧光倒置显微镜可观察到(图6),对照组细胞呈现弱绿色荧光,H2O2处理后则显示出强烈的绿色荧光,意味着细胞中ROS水平明显增加,进一步证明H2O2诱导了细胞的氧化应激;与H2O2组相比,0.5 mg/mL GMP与N-GMPH预处理后细胞的绿色荧光强度均发生了不同程度的减弱,尤其是后者荧光强度显著降低,该结果与细胞内ROS生成量(图5)基本一致。杜梦霞[22]、马萍等[23]亦发现,豆类蛋白酶解产物可显著降低细胞内的ROS水平。由此推测,N-GMPH可通过消除细胞中ROS恢复胞内氧化还原平衡,从而减轻胞内脂质、蛋白质和DNA等生命物质的损伤,达到缓解H2O2诱导细胞氧化损伤的作用。

图5 N-GMPH对 H2O2诱导RAW 264.7细胞内ROS生成量的影响Fig.5 Effects of N-GMPH on ROS production of H2O2-induced RAW 264.7 cells

a-空白组;b-H2O2组;c-GMP;d-N-GMPH图6 N-GMPH对H2O2诱导RAW 264.7细胞内ROS水平的影响(200×)Fig.6 Effects of N-GMPH on ROS levels in H2O2-induced RAW 264.7 cells
3 结论


