不同浓度壳聚糖对S 型变形链球菌抑菌性能影响对比研究*
王从 刘新庆
(1 浙江省中西医结合医院 杭州310003;2 江西省人民医院 南昌330006)
在以往的抗龋制剂研究以及临床应用中,氟化物的抗龋作用已得到广泛认可[1~4]。临床上最常用的氟化物为氟化钠(NaF),但由于其生物活性不高,通常需要较大剂量才能达到临床防龋抑菌的效果。然而,高剂量的氟化物容易导致耐氟菌株的出现以及婴幼儿氟中毒[5]。因此,当务之急是找到安全有效的生物防龋制剂。
本实验主要研究纯天然生物制剂壳聚糖(CTS)的抑菌性。通过对比不同浓度CTS 与NaF 对S 型变形链球菌(S.Mutans)的影响,评估 CTS 对 S.Mutans的抑制作用,为CTS 作为口腔抑菌剂使用提供理论依据。现报道如下:
1 材料和方法
1.1 材料 实验菌株:S.Mutans ATCC25175 菌株由广东省微生物菌种保藏中心提供。主要实验试剂的配制:(1)脑心浸液肉汤(BHI)液体培养基的配制。用电子天平称取38.5 g BHI 粉末,而后溶于1 000 ml 蒸馏水,高压灭菌后备用。(2)CTS 溶液的配置。用乙酸溶液溶解CTS 粉末,用1 mol/L NaOH溶液调节pH 至5.4 并定容至100 ml,121℃高压灭菌15 min 进行二次稀释,得到浓度为0.01%、0.03%、0.05%、0.10%、0.30%、0.50%的 CTS 溶液。(3)NaF 溶液的配置。用5 g 无水NaF 粉剂和50 ml双蒸水配制10% NaF 溶液,二次稀释至0.01%、0.03%、0.05%、0.10%、0.30%、0.50%。S.Mutans 复苏培养:用75%酒精棉球擦拭S.Mutans 冻干菌种管表面,进行消毒,在无菌条件下打开,吸取0.5 ml BHI,并将所有冻干粉末加入裂解液冻干管中,重复移液几次以完全溶解并混合细菌粉末。用无菌移液管吸取溶解后的菌种悬液,接种于BHI 平板内,并在80%N2、20%CO2、10%H2条件下,37℃恒温箱中培养24 h,使之成为菌落。随后进行涂片,革兰染色,油镜下观察。S.Mutans 传代培养:将待复苏细菌鉴定为纯培养后,传33 代培养第一代细菌,通过转接2~3 代恢复冻干细菌的整个生命活力,此时细菌处于性能稳定的对数生长期,各项指标均可充分表达。S.Mutans 菌悬液制备:挑取第3 代菌落并接种到BHI 液体培养基中,常规环境培养48 h。离心细菌培养液,分离细菌,稀释至 5×106个 /ml,待用。S.Mutans 的长期保存:将0.85 ml 细菌菌悬液加入0.15 ml 高压灭菌甘油中,摇动混合液使二者混合均匀,并在-80℃下冷冻。
1.2 CTS 与 NaF 对 S.Mutans 增殖作用影响检测(1)细菌接种:根据不同的实验药物将实验分成两组,每组用96 孔板覆盖。首先,用药物种类和浓度标记孔板,然后按照设定的浓度梯度将S.Mutans 悬液依次加入孔板,每孔加入100 μl 菌液,确保细菌浓度的一致性。接种完成后,顺时针轻轻旋转并敲打孔板的边缘,静置4~5 min,在37℃恒温的无氧环境中孵育。(2)细菌培养与呈色:厌氧培养48 h 后,细菌进入对数生长期,加入噻唑蓝(MTT)20 μl,孵育4 h,离心,分离细菌。然后用移液管小心地从孔中取出液体,在黑暗中操作每孔加入150 μl 二甲基亚砜(DMSO),摇动 10 min,静置 10 min。(3)比色:在进行下一步实验操作前,确认每个孔中没有气泡。重复测3 次490 nm 波长下的光密度值(OD 值),取平均值,以浓度(横坐标)和OD 值(纵坐标)绘制S.Mutans 生长曲线。
1.3 CTS 与 NaF 对 S.Mutans 产酸能力影响检测(1)将 130 支 10 ml 无菌培养管分为 CTS 六组、NaF六组、对照组,每组10 支。将BHI 营养肉汤、细菌悬浮液和不同浓度的药液按比例添加到每个管中,摇动混合物,使各实验组培养液中CTS 与NaF 的浓度梯度均为 0.01%、0.03%、0.05%、0.10%、0.30%、0.50%。等量的无菌双蒸水作为对照组。(2)根据浓度梯度对各组进行编号,并用复合pH 电极记录每组的初始pH。(3)常规培养,测量每组的终末pH。计算pH 差值(ΔpH),评估细菌生长状况。
1.4 统计学分析 用SPSS17.0 软件进行数据分析。以P<0.05 表明差异有统计学意义。
2 结果
2.1 CTS 与 NaF 对 S.Mutans 增殖作用影响比较恒温培养48 h 后应用MTT 法检测不同浓度CTS与 NaF 作用于 S.Mutans 时的吸光度值(OD490)。结果显示在不同的浓度条件下,两种药物作用于S.Mutans 测得的OD 值不同。随着药物浓度增加,OD 值表现为下降趋势。药物干预下的细菌活性低于阴性对照组,抑菌效果呈浓度依赖性。OD 值比较,NaF 组与对照组相比,差异有统计学意义(P<0.05);CTS 组与对照组相比,差异有统计学意义(P<0.05);NaF 组与 CTS 组比较,差异无统计学意义(P>0.05)。见表 1、表 2 和图 1。
表1 不同浓度CTS 与NaF 对S.Mutans 增殖影响比较()
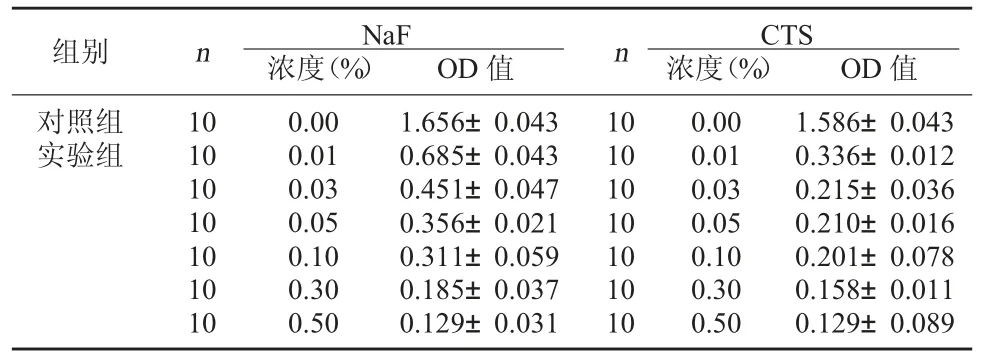
表1 不同浓度CTS 与NaF 对S.Mutans 增殖影响比较()
组别 n NaF浓度(%)OD 值nCTS浓度(%)OD 值对照组实验组10 10 10 10 10 10 10 0.00 0.01 0.03 0.05 0.10 0.30 0.50 1.656±0.043 0.685±0.043 0.451±0.047 0.356±0.021 0.311±0.059 0.185±0.037 0.129±0.031 10 10 10 10 10 10 10 0.00 0.01 0.03 0.05 0.10 0.30 0.50 1.586±0.043 0.336±0.012 0.215±0.036 0.210±0.016 0.201±0.078 0.158±0.011 0.129±0.089

表2 三组OD 值比较
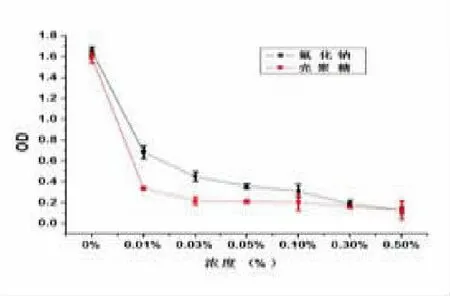
图1 CTS 与NaF 对S.Mutans 增殖作用影响趋势图
2.2 CTS 与 NaF 对 S.Mutans 产酸能力影响比较实验组ΔpH 通常小于对照组,表明对照组培养管内变形链球菌的数量较大而且产酸代谢活跃。在含有抑菌制剂的实验组中,培养管内变链菌的产酸能力受到显著抑制。见表3、表4 和图2。
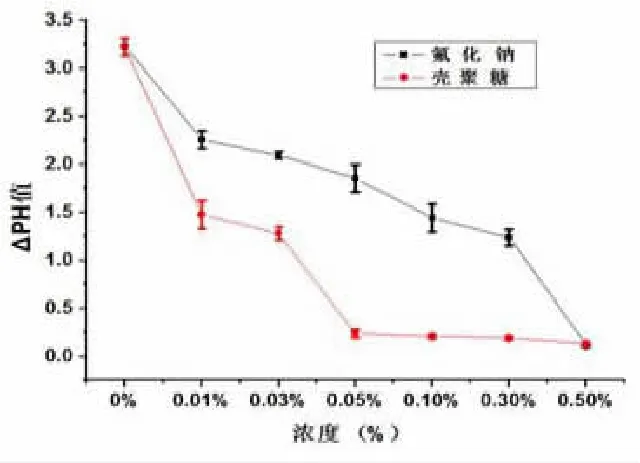
图2 CTS 与NaF 对S.Mutans 产酸作用影响趋势图
表3 不同浓度CTS 与NaF 对S.Mutans 产酸能力影响比较()
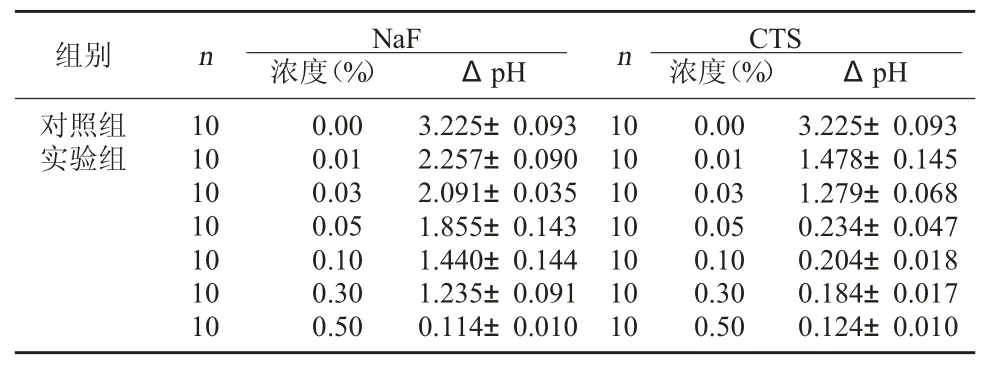
表3 不同浓度CTS 与NaF 对S.Mutans 产酸能力影响比较()
组别 n NaF浓度(%)ΔpHnCTS浓度(%)ΔpH对照组实验组10 10 10 10 10 10 10 0.00 0.01 0.03 0.05 0.10 0.30 0.50 3.225±0.093 2.257±0.090 2.091±0.035 1.855±0.143 1.440±0.144 1.235±0.091 0.114±0.010 10 10 10 10 10 10 10 0.00 0.01 0.03 0.05 0.10 0.30 0.50 3.225±0.093 1.478±0.145 1.279±0.068 0.234±0.047 0.204±0.018 0.184±0.017 0.124±0.010
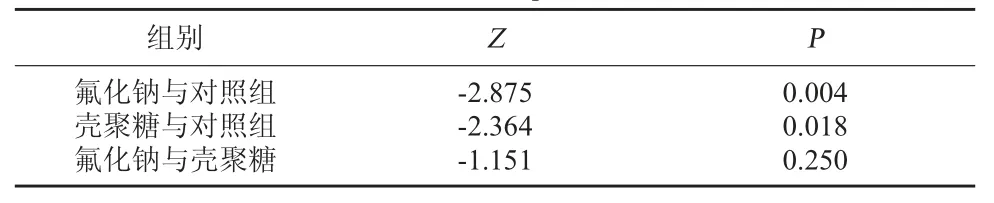
表4 三组ΔpH 比较
3 讨论
近年来,随着口腔保健意识的提高,接受正畸治疗的人群比例越来越高。然而正畸治疗会带来一系列并发症。托槽类正畸附件的存在影响正畸患者口腔卫生措施的实施,致使细菌数量显著增加,从而加大患龋风险。研究发现,一名患者戴固定矫治器一个月后牙面上牙菌斑中S.Mutans 的数量可增加至治疗前的2 倍[6~7]。细菌的聚集和持续存在会导致龋齿的发生,从而影响正畸治疗的效果和患者的健康。因此,选择一种天然无毒、安全有效的抑菌制剂已成为近年来的研究热点。
诸多国内外学者都试图从天然产物中分离和提取能够预防龋齿的有效成分,并取得了可喜的成果。例如从玉米、甘蔗和其他植物中提取木糖醇以制造糖替代品,但由于其使用方式与大多数糖醇相同,因此用量有限。目前主要应用在口香糖中,用作糖替代品[8]。然而,木糖醇的成功开发和应用也证实了使用天然产物作为生物制剂的可行性。
近年来,天然产物甲壳素及其衍生物CTS 逐渐成为多个领域的研究热点[9]。甲壳素来源丰富、方便获取,广泛存在于甲壳类动物、藻类和真菌细胞壁中,具有优异的性能,如无刺激性、不与体液反应、可生物降解性、生物相容性良好及对细胞具有亲和性等,因此特别适合于应用在医药保健领域[10]。近年来,关于口腔治疗方面的研究报告也逐渐增加。
本实验中选择同等浓度条件下的NaF 作为实验对照组,更有利于为CTS 作为抑菌剂使用可行性提供依据。通过MTT 法测定细菌吸光度值,测定ΔpH 的方法检测CTS 对S.Mutans 的影响,以综合评价壳聚糖的防龋作用。
MTT 法检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT 还原为水不溶性的蓝紫色结晶甲臜,并沉积在细胞中,而死细胞无此功能。在本次实验中,使用DMSO 溶解细胞中的甲臜,并且使用酶标仪在490 nm 波长下测定其OD 值[11]。基于测得的OD 值判断细菌数量。OD 值越大,细菌活性越强。MTT 结果显示,壳聚糖组的OD 值小于对照组,差异显著(P<0.05),壳聚糖组和氟化钠组OD值比较,无显著性差异(P>0.05)。这表明壳聚糖有一定抑制细菌繁殖作用。
细菌作用的一个主要特点为产酸继而使周围pH 值降低[12]。根据这一特点,本研究设计检测不同浓度药物作用后培养基pH 的变化,计算ΔpH,评估细菌活性从而判断药物抑菌作用。研究结果表明,CTS 和NaF 均能够抑制实验菌的产酸,抑制pH 降低,再次验证CTS 的抑菌作用。
本实验从基础研究层面证实了CTS 的抑菌作用,后期研究将会以此为基础研究口腔条件下不同浓度壳聚糖的抑菌效果。

