二代测序和荧光原位杂交在骨髓增生异常综合征中的临床价值
韩雪莹,王晓南,王静静,张 暋
(郑州金域临床检验中心有限公司分子医学实验中心,河南 郑州 450016)
骨髓增生异常综合征(myelodysplastic syndrome,MDS) 是一组起源于造血干细胞的异质性髓系克隆性疾病,该疾病的发生、发展、预后和治疗与基因突变和染色体的异常有较大关系[1-3]。对MDS及疑似患者进行分子鉴别诊断是一个重要的检验手段。本研究对郑州金域临床检验中心,同时送检二代测序(next-generation sequencing,NGS)和荧光原位杂交(fluorescence in situ hybridization,FISH)2种检测方法的137例MDS标本进行分析,以评估2种检测方法在MDS诊断、预后、治疗中优势和临床价值。
1 资料与方法
1.1 资料收集2019年5月至2020年3月同时进行NGS MDS检测套餐和FISH MDS四项检测的MDS标本137例,其中男64例、女73例,年龄40~80岁,中位年龄56岁。
1.2 方法
1.2.1 NGS实验方法 提取乙二胺四乙酸抗凝血DNA,DNA总量满足1 000 ng。DNA进行酶切打断,末端修复后加A尾和接头。磁珠筛选后用体积分数80%乙醇纯化,制备文库。用设计好的MDS相关基因探针进行文库杂交,并对靶基因进行捕获上机。数据分析时,需先就测序质量、同义突变、临床证实为良性及人群突变频率较高的位点进行过滤。其余位点根据分级证据进行临床意义分级,Ⅰ类突变位点具有强临床意义,Ⅱ类突变位点具有潜在临床意,Ⅲ类突变临床意义未明,Ⅳ类突变为临床意义良性或可能为良性的突变位点,并对分级位点进行临床注释。
1.2.2 FISH实验方法 吸取2 mL抗凝血,2 200 r/min,离心4 min弃上清,加8 mL氯化钾进行低渗处理;加8 mL 固定液固定(蛋白变性硬化,染色体形态固定下来);加固定液滴片,56 ℃烤30~120 min看细胞数量;洗杂质,加探针,75 ℃ 5 min,37 ℃ 18 h杂交;洗未结合的探针,加5 μL 125 ng/mL DAPI复染,最后进行显微镜计数。
1.3 统计学处理采用SPSS 21.0进行数据分析,计数资料比较用χ2检验,检验水准α=0.05。
2 结果
2.1 2种检测方法的阳性率和发单周期比较对137例患者的NGS和FISH检测结果进行分析,发现NGS阳性患者93例,占比为67.88%(93/137);FISH阳性患者30例,占比为21.90%(30/137)。FISA阳性检出率远远低于NGS,差异有统计学意义(χ2=58.553,P<0.001)。且在44例NGS阴性患者中,FISH检测结果有42例为阴性,2例为阳性。说明在NGS检测为阴性的情况下,FISH极少检测到阳性,该情况下阳性检出率为4.55%。这提示NGS技术在疾病的检测过程中具有更高的阳性检出率。对137例MDS标本的发单周期(标本接收至出具结果报告单的时间)进行统计,结果表明FISH发单时间为3~4 d,而NGS发单时间为9 d。
2.2 FISH检测阳性患者中的NGS基因突变类型分析结果对30例FISH检测阳性患者进行基因突变谱分析,结果表明检测到5q-的患者10例,其中8例合并有TP53基因突变。除5q-外,我们统计了检测到7q-患者共6例,基因突变谱(患者可存在多基因突变)为ASXL1 2例,TP53 2例、DNMT3A 2例、IDH1 1例、NRAS 1例、SETBP1 2例、EZH2 1例、ETV6 例、TET2 1例。FISH检测到20q-患者共9例,其中基因检测结果为ASXL1 2例,U2AF1 3例,TP53 4例,DNMT3A 1例,TET2 1例,GNAS 1例,BCOR 1例。FISH检测到+8患者有8例,其中合并的突变基因为ASXL1 3例、RUNX1、U2AF1、TP53 各2例,ETV6、PTPN11、PHF6、NRAS 各1例。见图1。
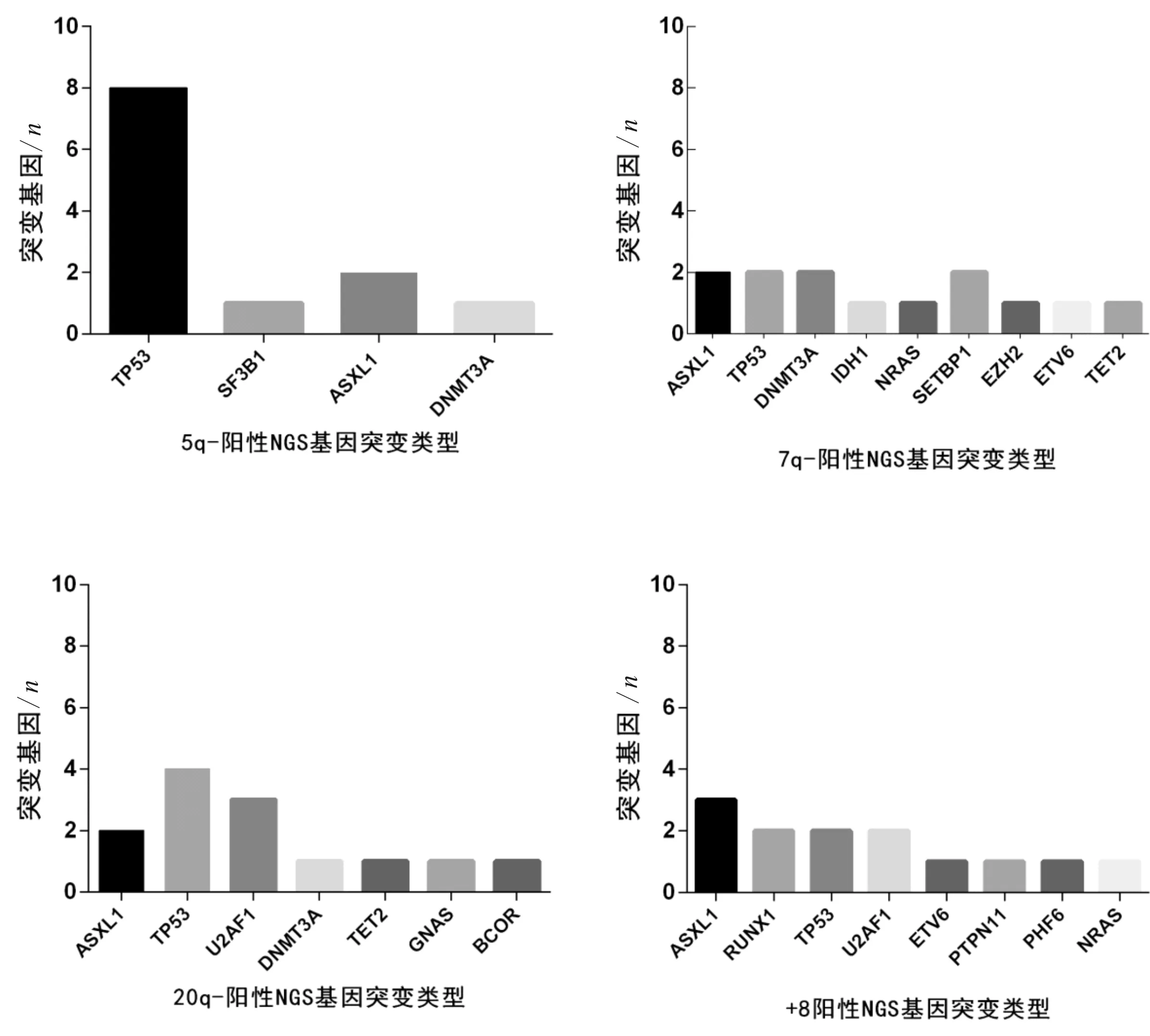
图1 FISH检测阳性患者中的NGS基因突变谱
2.3 FISH检测阴性患者中NGS阳性患者基因突变检出率我们针对FISH阴性患者中ASXL1、TET2、TP53、RUNX1、DNMT3A、EZH2、SF3B1的检出率进行了统计。分析结果表明:107例FISH检测阴性患者中,检测到含有以上7种基因突变患者共58例,FISH 检测阴性中NGS阳性检出率高达54.21%。其中58例患者中检测到的基因突变ASXL1 25例(23.36%)、TET2 16例(14.95%)、TP53 3例(2.80%)、RUNX1 5例(4.67%)、DNMT3A 17例(15.89%)、EZH2 5例(4.67%),SF3B1 7例(6.54%)。进一步收集郑州金域临床检验中心2018年1月至2020年12月NGS中MDS检测阳性2 082例,对7种基因的突变频次进行统计,比较FISH检测阴性NGS阳性患者和2 082例NGS阳性患者中7种基因突变频率的差异。2组TP53基因突变检出频率比较差异有统计学意义(χ2=5.273,P=0.022)。2 082例TP53突变基因检出频率是FISH阴性NGS阳性患者的3.33倍,原因可能是TP53主要出现在FISH检测到5q-阳性标本中,FISH检测阴性标本中TP53的阳性检出率大大降低,造成该数值偏小。见表1。

表1 7种基因在FISH阴性患者及2 082例NGS阳性患者中的突变频率比较
2.4 阳性检测结果在137例MDS中的分布情况我们比较了MDS患者及疑似患者中基因突变及细胞遗传学异常在性别年龄中的分布情况。在137例患者中,女性患者比例高于男性患者。但是男性NGS结果发生基因突变的频率要高于女性。从发病年龄上可以看出MDS发病人群主要集中在40~80岁(中位年龄56岁)。NGS检测结果显示,发病30岁以上人群发生基因突变的频率较高,61~90岁(中位年龄72岁)的患者被检测到突变的次数最高,说明突变的发生和年龄有较大的关系。FISH检测结果表明40~70岁(中位年龄55岁)的患者具有较高的阳性检出率,且51~60岁(中位年龄55岁)的阳性率最高。对NGS和FISH 2种检测方法阳性占比进行分析发现在41~70岁(中位年龄55岁)的患者中,检测到基因突变和细胞遗传学异常的概率较大。见表2。

表2 阳性检测结果在人群中的分布 n(%)
3 讨论
目前MDS的诊断和治疗依靠各种实验室检测技术的综合应用,除了传统的细胞形态、流式技术等,分子诊断技术被广泛运用于临床。MDS中国诊断与治疗指南中也将荧光原位杂交技术及基因突变检测列为MDS的主要诊断技术,为MDS的精准诊断和治疗奠定了基础。因此本研究对NGS和FISH在MDS中的临床价值进行了分析。
本研究对137例同时进行NGS和FISH等2种检测方法的患者进行分析。数据表明NGS阳性检出率为67.88%,FISH阳性检出率为21.90%,说明NGS在阳性检出率方面具有更大的优势。在137例患者中,NGS技术共检测到44例阴性,且在NGS为阴性的患者中仅有2例出现FISH阳性结果,表明NGS结果为阴性时,FHIS MDS四项为阳性的可能性较小,只有4.55%的概率。但是FISH检测周期短、发单周期快,可为临床获得更快的治疗时机。因此对疑似MDS者,无法进行核型分析(骨髓干抽、无中期分裂相、分裂相质量差或可分析中期分裂相<20个)时,可以选择FISH检测技术为临床更快提供预后评估及治疗方案。在30例FISH 阳性病例中,统计了检测到5q-、7q-、20q-、+8阳性患者中基因的突变情况,分析结果表明在检测到5q-时,TP53发生强临床意义突变(Ⅰ类突变)的可能性较高,如果临床上单独做FISH而没有进行基因突变检测,对临床的预后判定和用药都会产生重大的影响,因为TP53基因突变的出现会改变5q-患者预后较好及对来那度胺有效的临床反应[4-6]。目前针对MDS的分子研究受到了临床的普遍重视,ASXL1、TET2、TP53、RUNX1、DNMT3A、EZH2、SF3B1等基因加入了诊断和预后的评估标本中[7-9]。因此本研究对107例FISH阴性患者的基因突变情况进行了分析,发现仅针对这7个基因的阳性检出率就高达54.21%。其中7种基因在FISH阴性患者中的阳性率分别为ASXL1 23.36%、TET2 14.95%、TP53 2.80%、RUNX1 4.67%、DNMT3A 15.89%、EZH2 4.67%、SF3B1 6.54%。对比正常的NGS大群体突变频率发现TP53的检出率降低,再次证实TP53主要出现在FISH 5q-阳性标本中,因此在FISH阴性标本中TP53的阳性检出率较低。阳性检测结果在MDS人群中的分布情况表明,在137例MDS患者中女性患者偏多,但是男性患者NGS阳性检出率较高,更易发生基因突变。137例患者的发病年龄主要集中在40~80岁(中位年龄65岁),发病率随年龄呈现上升趋势。且30岁以上人群发生基因突变的频率较高,61~90岁(中位年龄72岁)的患者尤甚,说明突变的发生和年龄有一定的相关性,不排除和免疫力、肿瘤细胞清除、错配修复能力降低及突变积累相关[10-11]。40~70岁(中位年龄55岁)的患者更易检测到FISH阳性结果,且51~60岁(中位年龄55岁)的阳性率最高。41~70岁(中位年龄55岁)的患者中,检测到基因突变和细胞遗传学异常的概率较大,同时检测出NGS和FISH双阳性结果。
在临床检验中,任一单一的分子诊断技术都不能够确立MDS诊断,对于基因突变在MDS诊断中的价值应结合其他指标审慎判断。NGS和FISH在临床检测中都有自己的优势和临床辅助诊断价值,NGS通量高,可以检测未知的位点,但检测不到大片段的缺失重复且发单时间较长。尽管FISH具有较高的阴性率以及与疾病密切相关分子的漏检率,但可以在技术上弥补NGS的缺陷,可检测常见的大片段扩增、缺失及基因重排等,是一种检测结果的补充,不能被取代。针对本研究的分析结果,患者在检测到5q-时一定要参照NGS结果进行临床治疗方案的确定。在核型没有遗传学变异的情况下,建议MDS特别是年龄在41~70岁(中位年龄55岁)之间易产生检测双阳性的患者进行FISH和NGS联合检测,为临床提供更全面精准的评估和治疗指导。

