SARS-CoV-2棘突蛋白特异性多肽的筛选及初步验证
黄明柳,赖小敏
作者单位:510080 广州,中山大学中山医学院微生物学教研室/热带病防治研究教育部重点实验室/结核病研究所/海洋微生物功能分子广东省高校重点实验室/广东省重大传染病预防和控制技术中心
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19 )由新型冠状病毒(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)引起[1]。SARS-CoV-2 快速的传播能力让医务工作者筛查潜伏感染者面临着巨大压力。目前主要通过核酸检测来确诊病例,但核酸检测耗时长,患者病程、标本采集、病毒核酸提取过程都有可能干扰核酸检测结果,使核酸检测结果出现“假阴性”,易发生漏诊[2-5]。SARS-CoV-2 抗原/抗体检测方法,在某种程度上更方便快捷,且能弥补核酸检测漏检的风险。但市面上 SARS-CoV-2 抗原/抗体检测试剂盒都存在出现“假阳性”的问题,使其只能作为新型冠状病毒核酸检测阴性疑似病例的补充检测指标,不能用于一般人群检测。除了类风湿因子(rheumatoid factors,RF)、嗜异性抗体(heterophilic antibodies,HA)、补体等因素干扰,使抗原/抗体检测结果出现“假阳性”外,人冠状病毒之间的免疫交叉反应也可能是 SARS-CoV-2 抗原/抗体检测出现“假阳性”的重要原因[6-9]。
能引起人类感染的冠状病毒有 7 种,即人冠状病毒 229E ( human coronavirus 229E ,HCoV-229E)、人冠状病毒 HKU1(HCoV-HKU1)、人冠状病毒 NL63(HCoV-NL63)、人冠状病毒OC43(HCoV-OC43)、严重急性呼吸系统综合征冠状病毒( severe acute respiratory syndrome coronavirus,SARS-CoV)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus,MERS-CoV),以及此次引起全球大流行的SARS-CoV-2[10]。有分析指出,这 7 种冠状病毒的棘突蛋白(spike protein,S protein)和核衣壳蛋白(nucleocapsid protein,N protein)氨基酸序列同源性达 20%~90%,同时也有实验证明不同种的冠状病毒 N 蛋白或 S 蛋白存在免疫交叉反应[11-21]。这提示 SARS-CoV-2 抗原/抗体检测也可能受其他冠状病毒的影响。目前市面上 SARS-CoV-2 抗体检测卡上包被的主要是 SARS-CoV-2 S 蛋白、N 蛋白这类完整的大分子蛋白,其因不同种冠状病毒免疫交叉反应引起的“假阳性”结果的可能性更高,为了避免这种结果,需要寻找特异性更高的蛋白多肽来建立 SARS-CoV-2 特异性抗原/抗体检测试剂盒。
S 蛋白是冠状病毒诱导产生中和抗体的主要抗原,广泛应用于抗体检测。我们拟针对SARS-CoV-2 的 S 蛋白,基于生物信息学技术设计寻找 SARS-CoV-2 的 S 蛋白区别于 HCoV-229E、HCoV-HKU1 、 HCoV-NL63 、 HCoV-OC43 、SARS-CoV、MERS-CoV 的 S 蛋白的特异性多肽,通过 ELISA 初步验证这些特异性多肽,分析讨论这些基于生物信息学技术筛选出的特异性多肽在实际应用中是否有意义,为研发特异性更高的SARS-CoV-2 特异性抗体/抗原快速检测试剂盒建立基础。
1 材料与方法
1.1 材料
1.1.1 标本 普通呼吸系统疾病患者外周血血清21 例,收集自广州市胸科医院呼吸内科;11 例COVID-19 抗体阳性患者血清,患者血清经微磁力化学发光检测新型冠状病毒 IgG 抗体为阳性。患者或其家属知情同意并签署知情同意书。
1.1.2 实验动物 新西兰兔 5 只,3月龄,雄性,由广东省医学实验动物中心(三水基地)提供,普通级,许可证号 SYXK(粤)2019-0035。
1.1.3 主要试剂与仪器 8 周标准兔多抗制备佐剂为博奥龙公司产品;96 孔酶标板购自香港爱必胜公司;胎牛血清为 Gibco 公司产品;SARS-CoV-2、HCoV-HKU1、MERS-CoV S 蛋白兔多抗为义翘神州公司产品;HCoV-229E、HCoV-NL63、SARS-CoV S 蛋白兔多抗为 Abclonal 公司产品;HCoV-OC43 S 蛋白兔多抗为华美生物公司产品;健康新西兰兔血清为本实验室自主保存;辣根过氧化物酶(horseradish peroxidase,HRP)标记的羊抗兔 IgG抗体、HRP 标记的羊抗人 IgG 抗体为索莱宝公司产品;3,3,5,5-四甲基联苯胺(TMB)、1 mol/L H2SO4反应终止液为博奥森公司产品;特异性多肽与偶联KLH 的特异性多肽由陕西誉邦生物科技有限公司合成(由于多肽序列尚未申请专利,故本文暂不公布);S6-Linker-S7、SARS-CoV-2 S 蛋白均由本实验室制备,两种蛋白经纯化后,由 BCA 法定量。酶标仪 Sunrise 购自奥地利 Tecan 公司。
1.2 方法
1.2.1 S 蛋白特异性多肽设计方法 用SARS-CoV-2 Wuhan-Hu-1 病毒株( GenBank accession MN908947.3)基因组序列推测出的 S 蛋白氨基酸序列(序列编号 YP_009724390.1)分别与 HCoV-229E、HCoV-HKU1、HCoV-NL63、HCoV-OC43、SARS-CoV、MERS-CoV 的 S 蛋白氨基酸序列运用 BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)工具比对(GenBank 序列编号分别为:NP_073551.1、YP_173238.1、APF29063.1、AIX10763.1、NP_828851.1、YP_009047204.1)。寻找 SARS-CoV-2 S 蛋白不同于其他 6 种病毒 S蛋白的氨基酸序列,缩小 SARS-CoV-2 S 蛋白特异性多肽的找寻范围。
运用可预测与主要组织相容性复合物(major histocompatibility complex,MHC)结合的抗原表位的 NetMHCpan EL4.0 软件(http://tools.immuneepitope.org/mhci)预测 SARS-CoV-2 S 蛋白不同于其他 6 种病毒 S 蛋白的特异性序列的潜在抗原表位,以及 HCoV-229E、HCoV-HKU1、HCoV-NL63、HCoV-OC43、SARS-CoV、MERS-CoV的 S 蛋白潜在抗原表位。然后,依据“抗原肽-MHC”复合物间的亲和力(通常,%rank <0.5被定义为强结合,%rank <2 为弱结合,其他为不结合)进行筛选,保留 %rank 在 0~2 的短肽作为候选结合表位。
应用 BLAST 工具,将 SARS-CoV-2 S 蛋白特异性序列的候选表位与其他 6 种冠状病毒 S 蛋白的候选表位进行同源比对,在结果中记录下所有同源表位的 E-value 和 Identity。根据 E 值(通常当 E 值小于 1E-05 时,表明两序列有较高的同源性)进行筛选,保留 E 值 <1E-05 的同源表位,分析多肽的特异性。
运用 ProtParam ( https://web.expasy.org/protparam/)软件预测筛选出的多肽的理化性质;ProtScale(https://web.expasy.org/protscale/)软件分析其疏水性;SOPMA 工具(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)分析预测其二级结构及各成分的占比。选择具有抗原表位,特异性高,亲水性好,具有无规则卷曲的多肽,送往生物技术公司合成。
1.2.2 ELISA 验证多肽抗原性试验 将合成好的多肽、S6-Linker-S7 融合蛋白、S 蛋白用碳酸盐缓冲液(0.05 mol/L,pH 9.6)稀释后,分为 S2、S3、S6、S7、S6-Linker-S7、S6 + S7、S2 + S3、S2 + S3+ S6-Linker-S7、S2 + S3 + S6 + S7、S 蛋白阳性对照组,共 10 组,每组设置 6 个复孔,其中 3 个复孔用作实验组,另外 3 个复孔用于阴性对照。前 9 组稀释成 5 mg/ml 浓度包被,S 蛋白组按30 μg/ml 浓度包被。以 100 μl/孔包被 96 孔酶标板,于 4 ℃ 放置 16 h。弃去包被液,用含 10% 胎牛血清的封闭液[PBS(0.01 mol/L)配制],4 ℃ 封闭过夜,弃去封闭液,室温晾干备用。实验组每孔加入 100 μl SARS-CoV-2 S 蛋白兔多抗(PBS 配制,稀释度 1:1000),阴性对照组每孔加入 100 μl健康新西兰兔血清(稀释度 1:1000),37 ℃ 孵育1 h,用 PBST(含 0.1% Tween 20 的 PBS)洗涤5 次,拍干,再加入用 HRP 标记的羊抗兔 IgG 抗体(稀释度 1:3000)100 μl/孔,37 ℃ 反应 1 h,用 PBST 洗涤 5 次,拍干,每孔加入 100 μl TMB显色液,37 ℃ 显色 20 min,每孔加入 100 μl 终止液终止反应,于酶标仪 450 nm 处测定OD450nm值。
1.2.3 ELISA 验证多肽免疫原性试验 分别将偶联 KLH 的特异性多肽 S2-KLH、S3-KLH、S6-KLH、S7-KLH、SARS-CoV-2 S 蛋白按照每针 50 μg 的剂量用生理盐水稀释成 100 μl 后,与 100 μl 8 周标准兔多抗制备佐剂混合,通过肌肉注射免疫新西兰兔,每只兔子注射 200 μl。第 21 天和第 42 天按照同样的方式分别加强免疫一针。第 52 天采血,取免疫血清。
SARS-CoV-2 S 蛋白用碳酸盐缓冲液稀释成2 μg/ml,按前面所述的 ELISA 实验方法,包被、封闭 ELISA 板。以 S2-KLH、S3-KLH、S6-KLH、S7-KLH 制备的免疫兔血清为实验组,未免疫的健康兔血清为阴性对照,免疫 SARS-CoV-2 S 蛋白的兔血清为阳性对照,以 1:500 的比例稀释兔血清分别与包被好 SARS-CoV-2 S 蛋白的酶标板反应,检测反应OD450nm值。
1.2.4 SARS-CoV-2 S 蛋白与 S6-Linker-S7 对比检测不同人群血清 IgG 抗体 S6-Linker-S7 融合蛋白、SARS-CoV-2 S 蛋白用碳酸盐缓冲液稀释成2 μg/ml,按前面所述 ELISA 实验方法,包被、封闭 ELISA 板。普通呼吸系统疾病患者血清以1:500 的比例稀释分别与包被好的 S6-Linker-S7融合蛋白、SARS-CoV-2 S 蛋白酶标板反应,二抗加入用 HRP 标记的羊抗人 IgG 抗体(稀释度1:3000),检测反应OD450nm值。COVID-19 抗体阳性患者血清经过 56 ℃、30 min 灭活后也重复此操作,该操作在广东省内新冠定点医院内进行。
1.2.5 ELISA 验证多肽的特异性 将 S6-Linker-S7融合蛋白、SARS-CoV-2 S 蛋白用碳酸盐缓冲液稀释成 30 μg/ml,按前面所述 ELISA 实验方法,包被、封闭 ELISA 板,HCoV-229E、HCoV-HKU1、HCoV-NL63、HCoV-OC43、SARS-CoV、MERS-CoV、SARS-CoV-2 S 蛋白兔多抗和健康兔血清,以1:500 的比例稀释后分别与包被 S6-Linker-S7 融合蛋白、SARS-CoV-2 S 蛋白的酶标板反应,检测反应OD450nm值。
1.3 统计学处理
使用统计学处理软件 SPSS 16.0 进行统计学处理,数据用±s表示,两组间比较采用t检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 BLAST 分析结果
应用 BLAST 工具,分析比对了 SARS-CoV-2 S 蛋白氨基酸序列与不同种冠状病毒间 S 蛋白氨基酸序列相似性:HCoV-229E(31.07%)、HCoV-HKU1(35.43%)、HCoV-NL63(30.57%)、HCoV-OC43(37.5%)、SARS-CoV(75.96%)、MERS-CoV S(35.1%)。其中与 SARS-CoV-2 S 蛋白氨基酸序列相似性最高的是 SARS-CoV,相似性最低的为 HCoV-NL63 S 蛋白。SARS-CoV-2 与其他冠状病毒 S 蛋白序列的相似性,表明以SARS-CoV-2 S 蛋白制备抗体/抗原检测试剂盒很有可能因为免疫交叉反应而出现“假阳性”结果。
2.2 SARS-CoV-2 S 蛋白特异性多肽软件筛选结果
根据 SARS-CoV-2 S 蛋白氨基酸序列与其他冠状病毒 S 蛋白氨基酸比对结果,发现S2、S3、S6、S7 这 4 条多肽氨基酸序列与其他 6 种冠状病毒 S 蛋白氨基酸序列相似性最低(因多肽尚未申请专利,故多肽氨基酸序列暂不公布)。
通过“ 抗原肽-MHC” 结合预测工具NetMHCpan EL4.0 预测,多肽 S2、S3、S6、S7、HCoV-229E 、 HCoV-HKU1 、 HCoV-NL63 、HCoV-OC43、SARS-CoV、MERS-CoV 的 S 蛋白得到的预测表位条数,以及根据 %rank 分值筛选出的 0~2 的能与 MHC 结合的候选表位条数,见表 1。

表1 多肽及 6 种人冠状病毒 S 蛋白的预测表位与候选表位条数Table 1 The number of predicted epitopes and candidate epitopes of polypeptides and six human coronavirus S proteins
多肽 S2、S3、S6、S7 的候选抗原表位与HCoV-229E 、 HCoV-HKU1 、 HCoV-NL63 、HCoV-OC43、SARS-CoV、MERS-CoV S 蛋白的候选表位进行同源比对,其同源表位条数,见表 2。根据 E 值 <1E-05 的标准筛选同源表位,多肽S2、S3、S6、S7 抗原表位与 HCoV-229E、HCoV-OC43、HCoV-HKU1、MERS-CoV、HCoV-NL63 S 蛋白抗原表位同源比对 E 值均大于 1E-05,同源结果不可靠。多肽 S2、S3、S6、S7 与 SARS-CoV S 蛋白抗原表位同源比对,E 值 <1E-05 的SARS-CoV S 蛋白同源表位序列汇总结果见表 3。
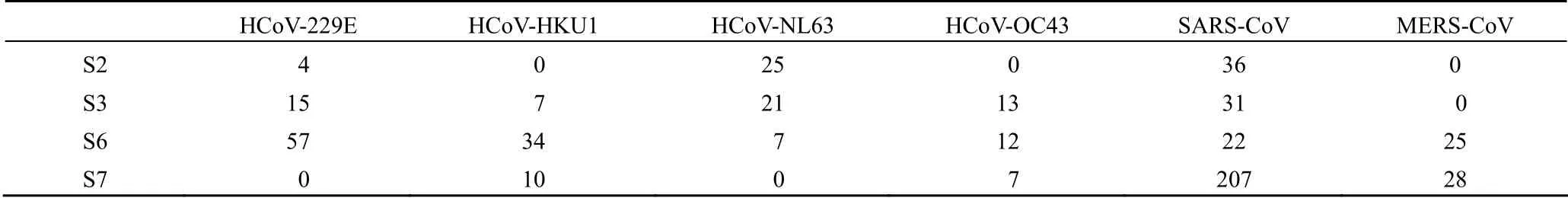
表2 多肽与 6 种人冠状病毒 S 蛋白同源表位条数Table 2 The number of homologous epitopes between polypeptides and six human coronaviruse S proteins
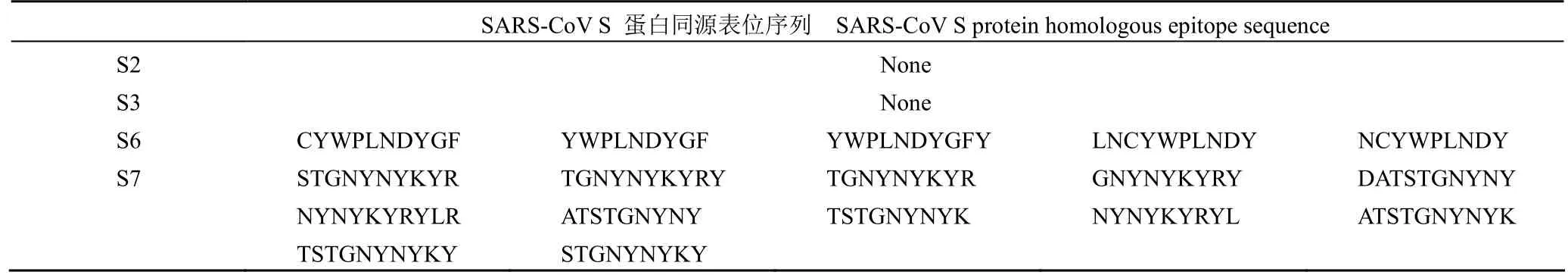
表3 SARS-CoV S 蛋白与多肽同源的表位序列Table 3 The epitope sequences of SARS-CoV S protein homologous with polypetides
综上,在生物信息学上多肽 S2、S3、S6、S7 具有抗原表位,也具有较好的特异性。
2.3 特异性多肽的理化性质、疏水性及二级结构分析
经 ProtParam 软件分析,多肽的理化性质,见表 4。由图 1 可知,多肽 S2 氨基酸序列第 5 位疏水性最大值为 1.114,第 7 位亲水性最大值为–0.843,整体亲疏水性预测显示,S2 为疏水性蛋白;多肽 S3 氨基酸序列第 8 位亲水性最大值为–2.478,整体亲疏水性预测显示,S3 为亲水性蛋白;多肽 S6 氨基酸序列第 17 位疏水性最大值为0.356,第 28 位亲水性最大值为–1.389,整体亲疏水性预测显示,S6 为亲水性蛋白;多肽 S7 氨基酸序列第 9 位亲水性最大值为–1.456,整体亲疏水性预测显示,S7 为亲水性蛋白。
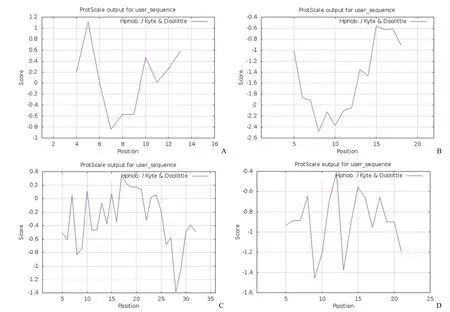
图1 特异性多肽亲水性及疏水性分析(A:S2;B:S3;C:S6;D:S7)Figure 1 Analysis of hydrophilicity and hydrophobicity of specific peptides (A:S2;B:S3;C:S6;D:S7)

表4 多肽理化性质Table 4 Physicochemical properties of peptides
经 SOPMA 软件分析,S2 的二级结构由100% 的无规卷曲组成;S3 二级结构由 18.18%的无规卷曲、13.64% 的 α-螺旋、45.45% 的延伸链(β-折叠)及 22.73% 的 β-转角组成;S6 二级结构由 66.67% 的无规卷曲、22.22% 的延伸链及11.11% 的 β-转角组成;S7 二级结构由 40% 的无规卷曲、36% 的 α-螺旋、24% 的 β-转角组成,见图 2。
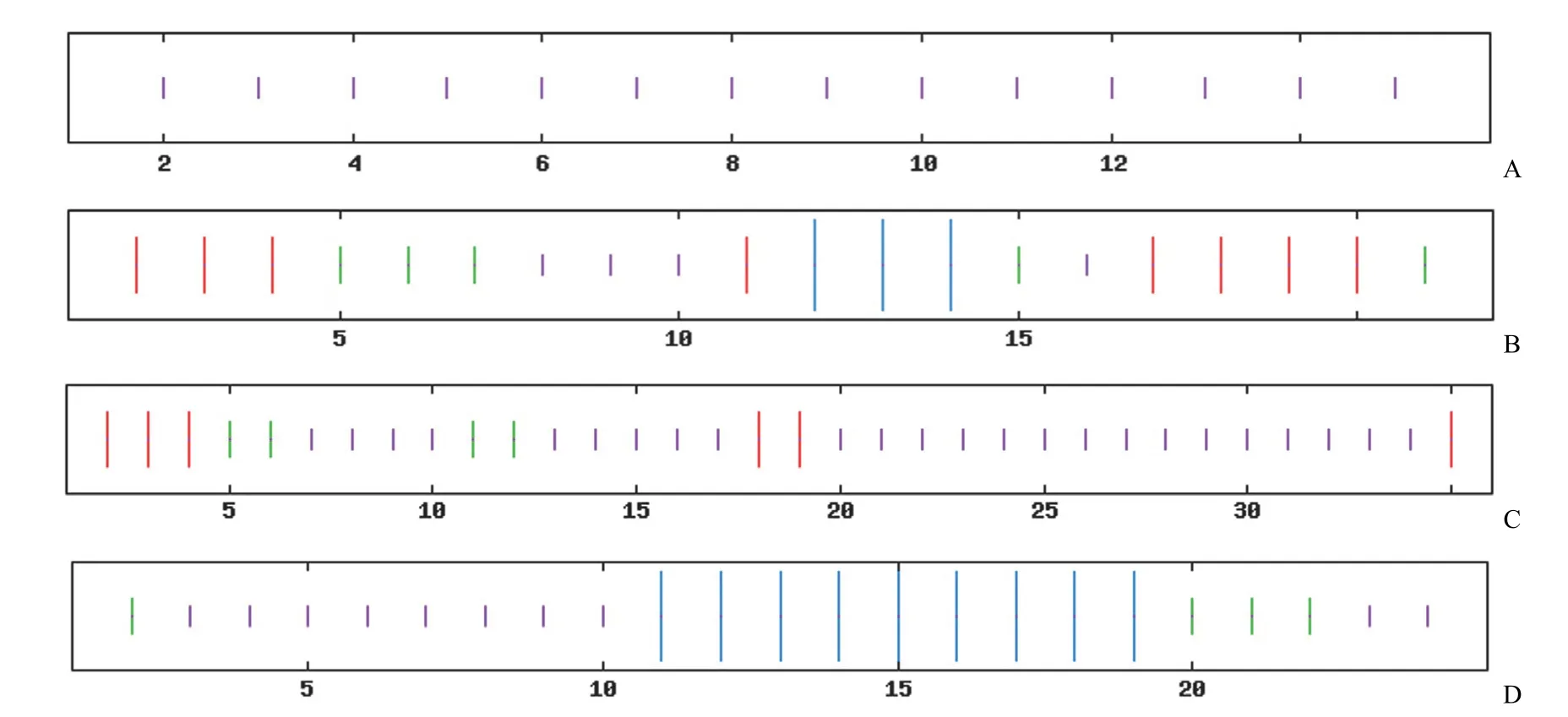
图2 特异性多肽二级结构分析(紫线代表无规则卷曲,蓝线代表 α-螺旋,红色线代表 β-折叠,绿色线代表 β-转角)(A:S2;B:S3;C:S6;D:S7)Figure 2 Analysis of secondary structure of specific peptides (The purple line represents random coil,and the blue line represents α-helix,red line represents β-sheet,green line represents β-turn) (A:S2;B:S3;C:S6;D:S7)
上述结果表明,在生物信息学上多肽 S2、S3、S6、S7 具有较大占比的无规则卷曲与 β-转角,多肽柔性较好,S3、S6、S7 具有亲水性。
2.4 SARS-CoV-2 S 蛋白特异性多肽免疫反应性验证结果
以 SARS-CoV-2 S 蛋白兔多抗作为阳性对照,健康新西兰兔血清为阴性对照,P/N ≥ 2.1 为判定阳性反应标准(用酶标仪测定被检溶液OD450nm值之后,计算出的实验组血清与阴性血清之比。当其比值 ≥ 2.1 时,实验组检测结果呈阳性),分别检测验证这几条多肽。结果显示 S2、S3、S6、S7 均被判定为与 SARS-CoV-2 S 蛋白兔多抗有阳性反应,表明这 4 种多肽均具有抗原性。抗原性强弱顺序依次是 S6 >S2 >S3 >S7。在筛选多肽之初,发现 S2 和 S3,S6 和 S7 在一级结构氨基酸序列上距离非常接近(特别是 S6 和 S7 距离小于10 个氨基酸),在 SARS-CoV S 蛋白上,它们之间有很大几率存在空间结构促进病毒与受体的结合。而且 S6、S7 位于 SARS-CoV-2 S 蛋白受体结合区,极有可能检测到中和抗体。故本课题组设计分组时,S2 与 S3,S6 与 S7 各分成一组,考虑到多肽 S6、S7 的位置以及潜在应用价值,将 S6、S7 用蛋白柔性 linker 连接起来,构建质粒,用大肠埃希菌表达该小分子融合蛋白(S6-Linker-S7),用 ELISA 验证其抗原性,发现 S6-Linker-S7 比其他多肽抗原性更强(表 5)。

表5 ELISA 法验证特异性多肽免疫反应性结果(OD450 nm)Table 5 Verification of specific peptide immunoreactivity by ELISA (OD450 nm)
2.5 SARS-CoV-2 S 蛋白特异性多肽免疫诱导血清ELISA 检测 IgG 抗体结果
以未免疫的健康新西兰兔血清为阴性对照,免疫 SARS-CoV-2 S 蛋白的新西兰兔血清为阳性对照,P/N ≥ 2.1 为阳性判断标准。表 6 结果显示,S2-KLH、S3-KLH、S6-KLH、S7-KLH 免疫的兔血清均能与 SARS-CoV-2 S 蛋白产生免疫反应,反应结果均为阳性,表明 S2-KLH、S3-KLH、S6-KLH、S7-KLH 具有免疫原性,能诱导机体产生特异性抗体。

表6 ELISA 法验证特异性多肽免疫兔血清 IgG 抗体检测结果(OD450 nm)Table 6 Test results of serum IgG antibody of rabbits immunized with specific peptide verified by ELISA (OD450 nm)
2.6 SARS-CoV-2 S 蛋白与 S6-Linker-S7 检测普通呼吸疾病患者、COVID-19 抗体阳性患者血清IgG 抗体的结果
本课题组将普通呼吸疾病患者、COVID-19 抗体阳性患者的血清分别与 SARS-CoV-2 S 蛋白和S6-Linker-S7 反应的OD450nm数值做配对t检验,分析这两种蛋白在检测同一群体时是否有差异性。结果显示 S6-Linker-S7 检测普通呼吸系统疾病患者血清 IgG 抗体平均检测值为(0.70 ± 0.34)。SARS-CoV-2 S 蛋白检测普通呼吸系统疾病患者血清 IgG 抗体平均检测值OD450nm为(1.33 ±0.54),差异具有统计学意义(P<0.001),其中有 11 位普通呼吸系统疾病患者 SARS-CoV-2 S蛋白与 S6-Linker-S7 的检测结果OD450nm值相差较大,见图 3。

图3 普通呼吸系统疾病患者 SARS-CoV-2 S 蛋白与S6-Linker-S7 蛋白血清 IgG 抗体检测结果(P <0.001)Figure 3 Comparison of serum IgG antibody detection results of SARS-CoV-2 S protein and S6-Linker-S7 protein in patients with common respiratory diseases (P <0.001)
S6-Linker-S7 检测 COVID-19 抗体阳性患者,血清抗体平均检测值为(2.20 ± 1.95)。SARS-CoV-2 S 蛋白检测 COVID-19 抗体阳性患者,血清抗体平均检测值OD450nm为(2.35 ± 0.57),差异不具有统计学意义(P>0.05)见图 4。
图4 COVID-19 抗体阳性患者 SARS-CoV-2 S 蛋白与S6-Linker-S7 蛋白血清 IgG 抗体检测结果比较(P >0.05)Figure 4 Comparison of serum IgG antibody detection results of SARS-CoV-2 S protein and S6-Linker-S7 protein in patients with positive COVID-19 antibody (P >0.05)
分析 S6-Linker-S7 分别检测普通呼吸系统疾病患者与 COVID-19 抗体阳性患者血清IgG 抗体检测值,做两独立样本t检验,发现 S6-Linker-S7在检测 COVID-19 抗体阳性患者时,血清抗体检测值OD450nm均值比检测普通呼吸疾病患者高 3倍,差异具有统计学意义(P<0.001),见图 5。
图5 S6-Linker-S7 蛋白对不同人群血清 IgG 抗体检测结果比较(P <0.001)Figure 5 Comparison of detection results of S6-Linker-S7 protein on serum IgG antibodies of different populations (P <0.001)
以上实验表明 S6-Linker-S7 具有在实际应用中检测 COVID-19 抗体阳性患者血清 IgG 抗体的能力。
2.7 多肽的特异性验证结果
以未免疫的健康新西兰兔血清为阴性对照,SARS-CoV-2 S 蛋白多克隆抗体为阳性对照,P/N≥ 2.1 为阳性判断标准,结果如表 7、表 8所示,SARS-CoV-2 S 蛋白与 HCoV-HKU1、HCoV-OC43、SARS-CoV S 蛋白多克隆抗体产生免疫反应,反应结果呈阳性,表明 SARS-CoV-2 S 蛋白与这三种病毒的 S 蛋白抗体具有免疫交叉反应。S6-Linker-S7蛋白与抗 HCoV-OC43、SARS-CoV S 蛋白多克隆抗体产生免疫反应,反应结果呈阳性。与SARS-CoV-2 S 蛋白相比,S6-Linker-S7 蛋白避免了与 HCoV-HKU1 S 蛋白多抗的免疫交叉反应,虽然其与 HCoV-OC43、SARS-CoV S 蛋白多抗还是具有免疫交叉反应,但从OD450nm数值上看,S6-Linker-S7 蛋白与 HCoV-OC43、SARS-CoV S蛋白多抗的反应值比 SARS-CoV-2 S 蛋白低。表明S6-Linker-S7 蛋白与 SARS-CoV-2 S 蛋白相比具有更高的特异性。

表7 SARS-CoV-2 S 蛋白特异性检测结果(OD450 nm)Table 7 Test results of SARS-CoV-2 S protein specificity (OD450 nm)

表8 S6-Linker-S7 蛋白特异性检测结果(OD450 nm)Table 8 Test results of S6-Linker-S7 protein specificity (OD450 nm)
3 讨论
面对 SARS-CoV-2 血清抗原抗体检测因免疫交叉反应产生的“假阳性”结果的问题,本课题组针对 SARS-CoV-2 的 S 蛋白,基于生物信息学技术,设计合成了区别于 HCoV-229E、HCoV-HKU1、HCoV-NL63、HCoV-OC43、SARS-CoV、MERS-CoV的特异性多肽,并通过动物实验和 SARS-CoV-2 S蛋白多克隆抗体检测初步验证了多肽的免疫原性和抗原性, 分析对比了 S6-Linker-S7 与SARS-CoV-2 S 蛋白在检测普通呼吸系统疾病患者与 COVID-19 抗体阳性患者血清 IgG 抗体检测值的差异,证明 S6-Linker-S7 在实际应用中的可行性,并用实验验证了 S6-Linker-S7 的特异性比SARS-CoV-2 S 蛋白高。为研发特异性更高的SARS-CoV-2 特异性抗体/抗原快速检测试剂盒建立了基础。
在筛选设计多肽之初,发现 S6、S7 在一级结构氨基酸序列上距离相近且位于 SARS-CoV-2 S蛋白受体结合区,S6-Linker-S7 极有可能检测到中和抗体。基于这一猜想,下一步将使用基因重组人血管紧张素转化酶 2(angiotensin converting enzyme 2,ACE2)作为包被抗原,HRP 标记 S6-Linker-S7蛋白,建立竞争抑制法并与市面上出售新冠中和抗体检测试剂盒对比检测已接种疫苗的人群,判断S6-Linker-S7 的临床应用价值[22]。

