不同氮磷营养条件对海黍子生长及抗氧化能力的影响
吕 芳,王翔宇,辛美丽,詹冬梅,丁 刚,吴海一
(1.山东省海洋生物研究院,山东省大型海藻资源保护与应用工程技术研究中心,山东青岛 266104;2.青岛市大型海藻工程技术研究中心,山东青岛 266104)
《2018年中国海洋生态环境状况公报》显示,我国近海海域水质主要超标要素为无机氮和活性磷酸盐,呈富营养化状态的海域面积达56 680 km2,氮、磷浓度在不同海域变化较大。由于大型海藻生产力很高,在生长过程中可大量吸收碳、氮、磷等生源要素,因此,栽培大型海藻是净化养殖废水、控制水域富营养化和保护生态环境的有效措施[1-3]。
海黍子(Sargassummuticum)属褐藻门,马尾藻科,是马尾藻属中一种重要的提取褐藻胶和多酚等活性物质的主要原料之一,具有巨大的潜在经济价值。此外,海黍子还具有适应性广、生长快、营养储存库大等特点,对海水中的富营养化物质和重金属等有较强的生物吸附能力[4-5],具有重要的生态价值和较好的应用前景,从而成为修复富营养化水域和构建海藻场的研究热点。氮、磷营养盐是海藻细胞生长的重要限制性营养元素,对海藻的生长具有显著影响[6-8],在一定的浓度范围内会使藻类的生长速率升高,光合作用增加,但浓度过低或过高时,则对藻类的生长产生抑制作用。大型海藻对氮、磷营养盐的吸收特性不仅因海藻种类存在差异,与海藻的生长环境和发育阶段也显著相关,尽管营养盐浓度对海黍子生长的影响已有一些报道[5,9],但高浓度氮、磷对海黍子藻体内各种生化组分的生成和消耗以及抗氧化系统的调节等仍鲜见报道,而这方面的研究对弄清海黍子在人工增养殖过程中养殖环境的选择及其在富营养化水域中进行生物修复所持续的时间和对环境的适应性等具有极其重要的意义。鉴于此,本研究通过实验生态学方法,探讨不同氮、磷营养条件对海黍子的生长、生理生化特性以及抗氧化能力的影响,旨在为丰富海黍子人工增养殖技术体系,进而为我国近海富营养化等环境污染的生物治理和可持续利用提供科学依据。
1 材料与方法
1.1 实验材料
实验用海黍子为2019年3月采集于山东荣成俚岛近岸海域(37°25′N、122°59′E)潮下带的野生群体。藻体采集后用保温箱迅速运回实验室,用海水反复清洗去除泥沙及杂质,置于循环水箱中充气暂养,培养条件为温度15℃,光照强度5 000 lx,盐度30.5,光周期12L∶12D,5 d后用于实验。
1.2 培养方法
实验在1 L的三角瓶中进行,选取健康藻体,每瓶放置(4.0±0.1)g。培养液以天然海水(海水盐度为基质,经0.45 μm滤膜过滤后,用NaNO3、NaNO2、(NH4)2SO4、KH2PO4加富氮、磷浓度,其中各试验组中溶解无机氮(dissolved inorganic nitrogen,DIN)的浓度比设为5∶5∶1。实验分组如下:T1(对 照 组,天 然 过 滤 海 水),T2P),T3(100μmol·L-1DIN+6.25μmol·L-1L-1DIN+37.5μmol·L-1每组设3个重复。培养条件同1.1,每隔一天更换培养液,实验周期为15 d,在实验的1、3、7、15 d分别取样进行测定。
1.3 相对生长速率(relative growth rate,RGR)的测定
观察藻体表观性状并称量鲜质量,按下式计算相对生长速率:
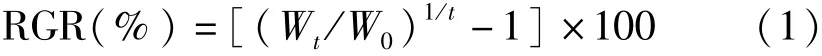
式(1)中,Wt为实验中期或结束时鲜藻体质量(g),W0为实验开始时鲜藻体质量(g),t为培养时间(d)。
1.4 氮、磷吸收速率测定
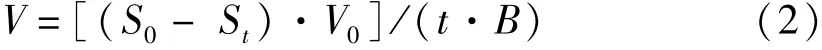
式(2)中,V为吸收速率[μmol·(g·h)-1],S0、St分别为取样时间间隔的起始和结束时培养液中氮、磷的浓度,V0为每次取样时间间隔起始的培养液体积(L),t为取样的时间间隔(h),B为实验开始时鲜藻体质量(g)。
1.5 光合色素[叶绿素a(chlorphyll a,Chl-a)和类胡萝卜素(carotenoid,Car)]含量测定
光合色素的提取和测定参照吕芳等[10]的方法测定。取0.1 g新鲜藻体在液氮中研磨成匀浆状,加入8 mL 80%丙酮,然后置于4℃黑暗处抽提24 h。于4℃、4 000 r·min-1离心10 min,弃沉淀,上清用80%丙酮定容至10 mL。以80%丙酮作为空白对照,分别测定665、652、510、480 nm波长处的吸光值。重复3次以上,计算平均值。按下式计算叶绿素a和类胡萝卜素的含量:
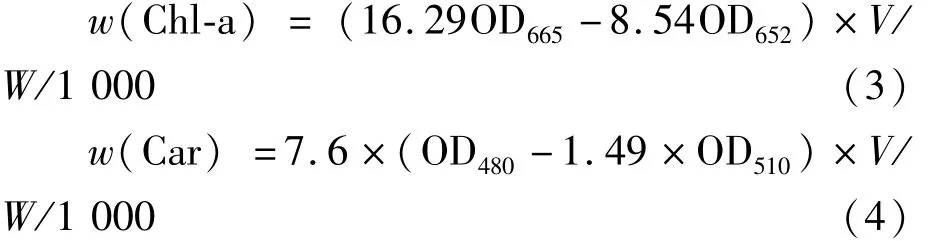
式(3)、式(4)中,V为浸提丙酮的体积(mL),W为鲜藻体质量(g),叶绿素a和类胡萝卜素含量的单位为mg·g-1。
1.6 可溶性蛋白含量测定
可溶性蛋白采用南京建成蛋白检测试剂盒-考马斯亮蓝法测定。取1.0 g新鲜藻体在液氮中研磨成匀浆状,加蒸馏水后离心定容到10 mL,作为待测溶液。
1.7 抗氧化系统相关指标的测定
超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、过氧化物酶(peroxidase,POD)的活性和丙二醛(malondialdehyde,MDA)含量均采用南京建成生物工程研究所试剂盒测定。取1.0 g新鲜藻体在液氮中研磨成匀浆状,加入4 mL提取液(50 mmol·L-1磷酸缓冲液,pH 7.0;0.1% Triton X-100;1% PVP),离心取上清作为待测溶液。
1.8 数据分析
采用SPSS 13.0进行数据统计分析,用单因素方差分析(one-way ANOVA)的Duncan法进行组间多重比较,当P<0.05时为有显著性差异。结果采用Origin 9.0进行分析绘图。
2 结果与分析
2.1 氮、磷浓度对海黍子生长的影响
比较不同氮、磷浓度对海黍子相对生长速率的影响发现,培养3 d时,藻体RGR随着氮、磷浓度的增加,呈现先增加后减少的趋势,除T6试验组与对照组无显著性差异外(P>0.05),T2、T3、T4、T5试验组的RGR随着氮、磷浓度的增加较对照组分别上升了30.7%、61.7%、47.0%和23.8%;培养7 d时,各试验组的RGR均较3 d时有所下降,其中T2试验组仍显著高于对照组,T6试验组则显著低于对照组(P<0.05),而其余3组均与对照组无显著差异(P>0.05);培养15 d时,仅T2试验组的RGR与对照组无显著差异,其他试验组均显著低于对照组,且随着氮、磷浓度的增加呈逐渐下降的趋势,其中T6试验组RGR出现负增长,这可能是因为氮、磷浓度过高对海黍子产生了毒害作用,抑制了其生长代谢过程(图1)。
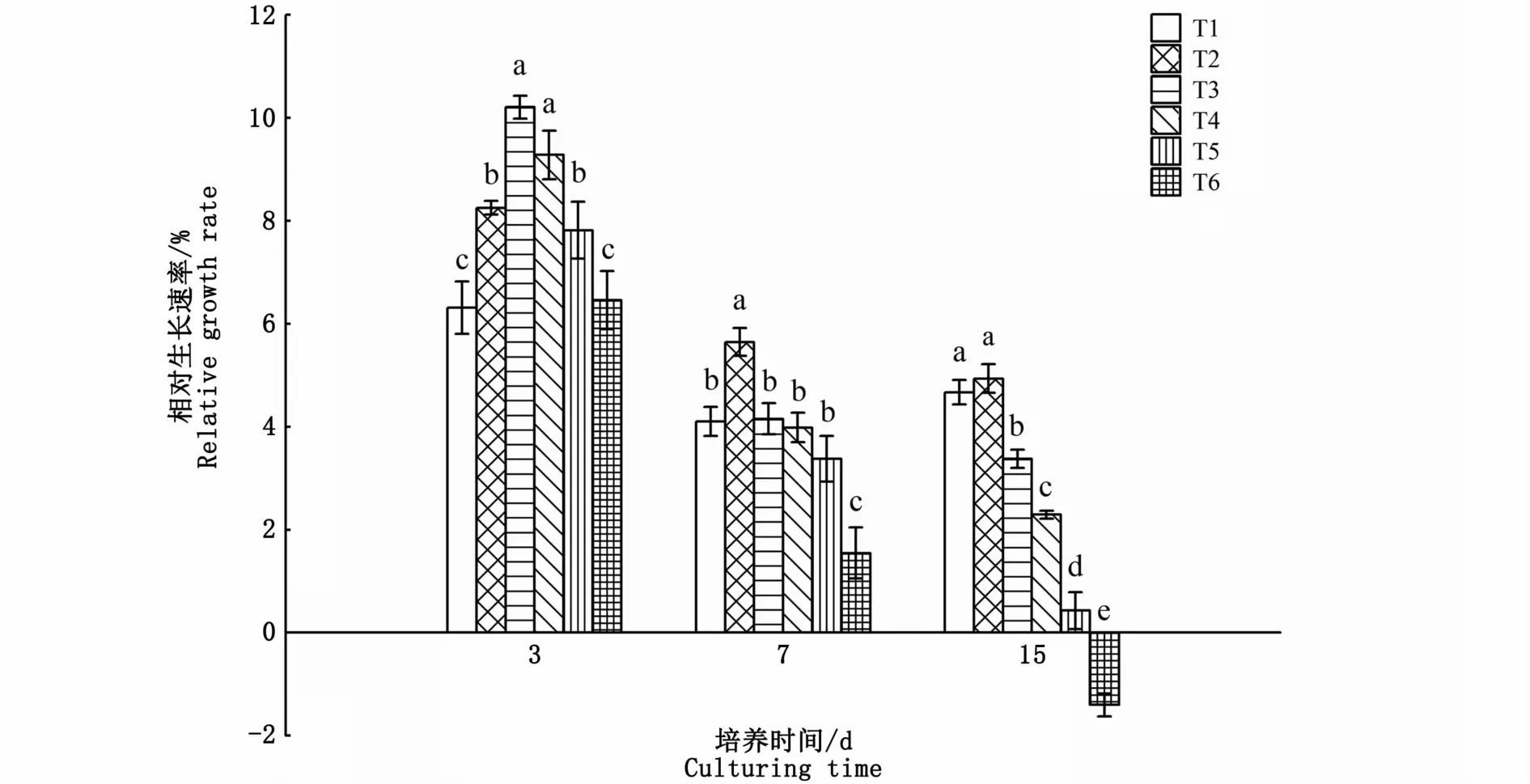
图1 不同氮、磷浓度对海黍子相对生长速率的影响Fig.1 Effects of different N,P concentrations on relative growth rate of S.muticum
2.2 氮、磷浓度对海黍子吸收速率的影响
加富不同氮、磷浓度培养3 d后,海黍子对3种形态氮和磷的吸收速率见图2。随着氮、磷浓度的增加,藻体对3种形态氮和磷的吸收速率均呈逐渐升高的趋势,且均较对照组存在显著性差异(P<0.05);比较3种形态氮的吸收速率发现,海黍子对NH+4-N的吸收速率略高于NO-3-N,但两者间差异不显著(P>0.05),而对NO-2-N的吸收速率则显著低于NH+4-N和NO-3-N。
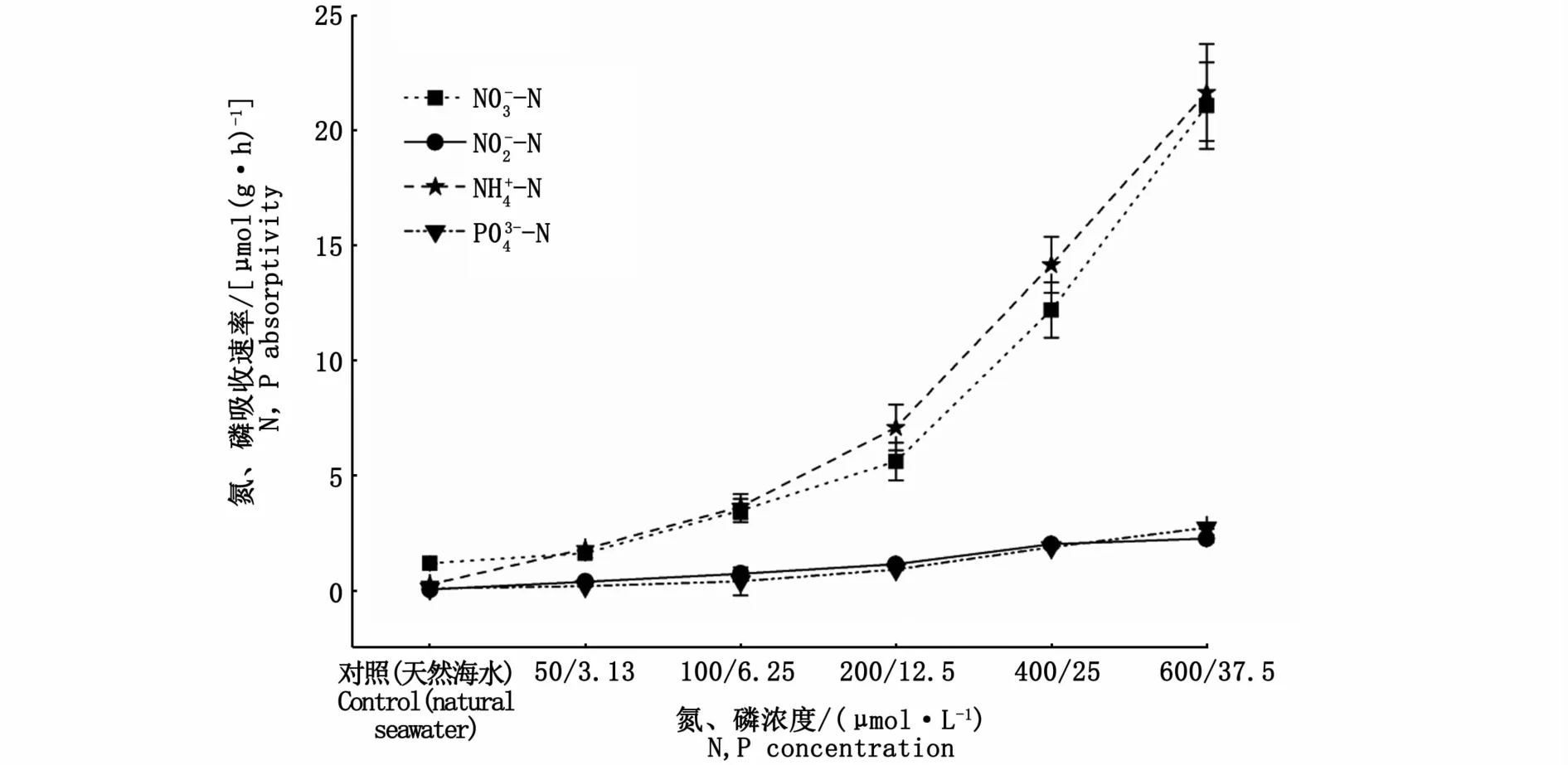
图2 海黍子对不同形态氮和磷吸收速率的比较Fig.2 Comparison of different forms of N and P absorptivity rates in S.muticum
2.3 氮、磷浓度对光合色素含量的影响
海黍子光合色素的含量均受到氮、磷浓度和培养时间的影响。在3 d时,T3、T4、T5、T6试验组叶绿素a的含量随着氮磷浓度的升高均有增加;在7 d时,藻体叶绿素a的含量随着氮、磷浓度的升高呈先上升后下降的趋势,在T4试验组中达到最大值,氮、磷浓度较低的4个试验组藻体叶绿素a的含量显著高于对照组(P<0.05);至15 d时,各试验组叶绿素a的含量均有所下降,除T1试验组与对照组无显著差异外,其余4组则显著低于对照组(P<0.05)(图3-A)。
在培养3 d时,各试验组类胡萝卜素的含量均显著升高,随着氮、磷浓度的升高,T2、T3、T4、T5、T6试验组分别比对照组高22.0%、26.1%、26.2%、39.5%和35.8%;培养7 d时,T3、T4、T5、T6试验组类胡萝卜素的含量仍显著高于对照组,其中T4试验组最高;培养15 d时,各试验组变化各异,其中T2试验组仍显著高于对照组(P<0.05),T3试验组与对照组差异不显著(P>0.05),T4、T5、T6试验组较对照组则显著降低(图3-B)。
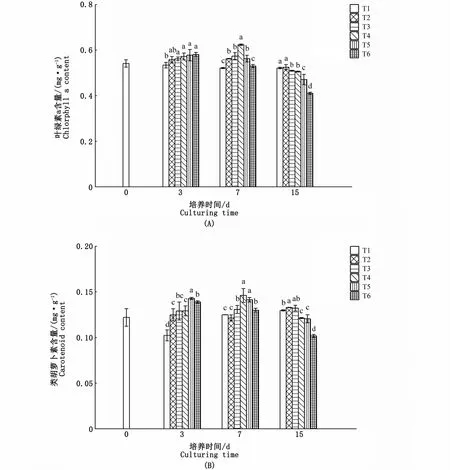
图3 不同氮、磷浓度对海黍子光合色素含量的影响Fig.3 Effects of different N,P concentrations on photosynthetic pigments of S.muticum
2.4 氮、磷浓度对可溶性蛋白含量的影响
氮、磷浓度对海黍子可溶性蛋白含量的影响比较显著,培养3 d时,T2、T3试验组与对照组无显著差异,而T4、T5、T6试验组显著升高,但3组间差异并不显著(P>0.05);培养7 d时,各试验组可溶性蛋白含量均显著高于对照组,且随着氮、磷浓度的升高呈先上升后下降的趋势,其中T5试验组最高;至15 d时,T2、T3、T4、T5、T6试验组可溶性蛋白含量分别是对照组的1.16、1.25、1.25、2.06和1.61倍,差异显著(P<0.05)(图4)。
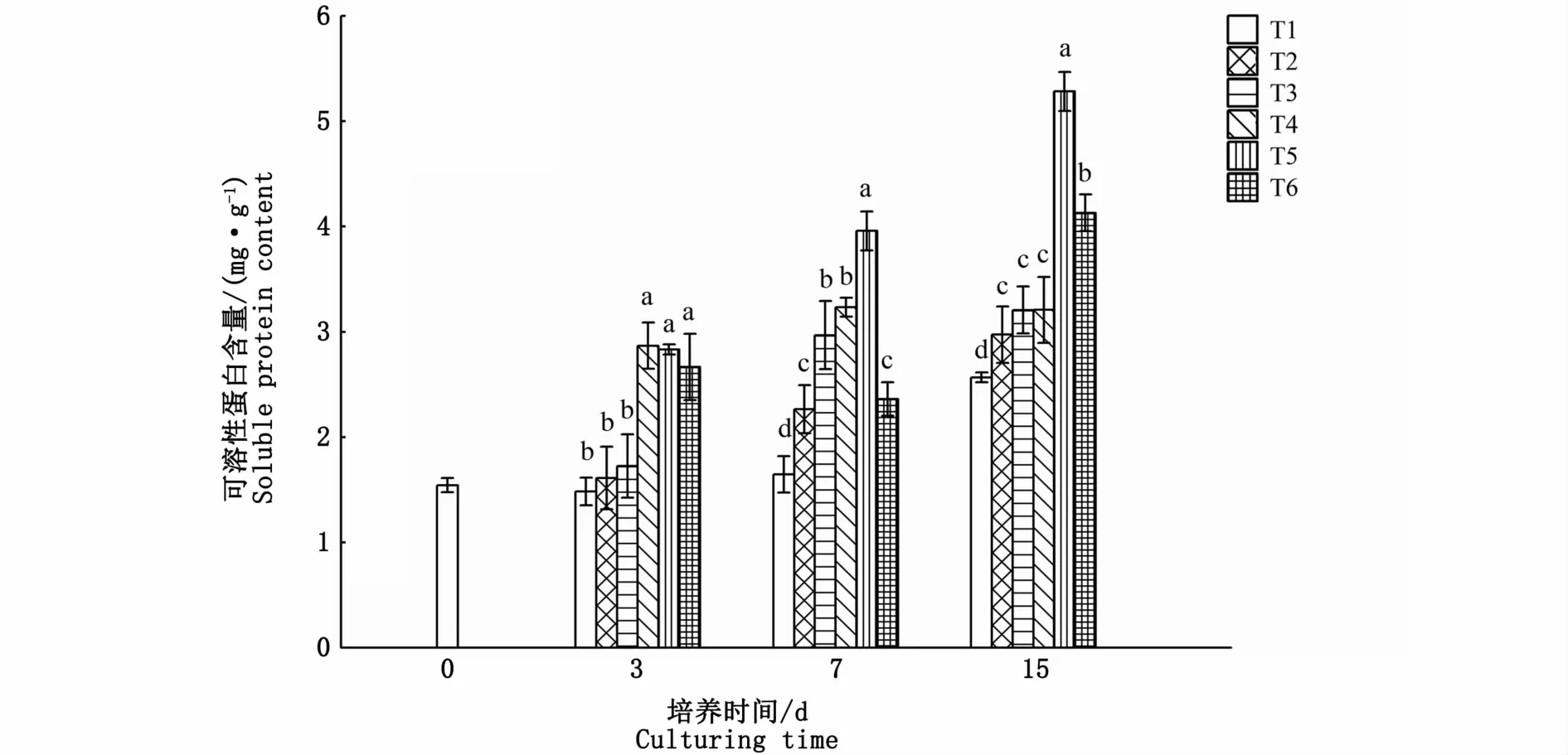
图4 不同氮、磷浓度对海黍子可溶性蛋白含量的影响Fig.4 Effects of different N,P concentrations on soluble protein content of S.muticum
2.5 氮、磷浓度对SOD、CAT、POD活性和MDA含量的影响
各试验组SOD活性的变化随氮、磷浓度的升高呈现差异性,其中T2试验组SOD活性在培养3 d时略有下降,7 d后与对照组无显著性差异(P>0.05);T3试验组在培养3 d时,其藻体SOD活性较对照组无显著差异,7 d时,较对照组上升了13.8%,15 d又降至对照组水平;T4、T5、T6组在实验期间SOD活性均保持在较高水平,15 d时分别比对照组高出15.3%、11.5%和12.8%(图5-A)。
实验期间,各试验组藻体CAT活性随氮、磷浓度的升高均呈先升高后下降的趋势。T2试验组CAT活性仅在培养7 d时略低于对照组,其他时间均与对照组无显著差异(P>0.05);T6试验组CAT活性在15 d内均显著低于对照组,其中15 d时仅为对照组的52.2%;T3、T4、T5试验组CAT活性则显著高于对照组,至15 d时较对照组分别高10.2%、26.4%和56.8%(图5-B)。
培养3 d时,POD活性试验组T2、T3、T4藻体与对照组无显著差异,而T5、T6组POD活性则显著高于对照组(P<0.05);培养7 d时,藻体POD活性随氮、磷浓度的升高呈逐渐上升的趋势,其中T4、T5、T6组较对照组分别升高22.2%、47.9%和56.1%;至15 d时,除T6组POD活性略有下降外,其余各试验组仍呈上升趋势(图5-C)。
MDA含量在实验期间均随着氮、磷浓度的增加呈逐渐上升的趋势,除T2、T3组在培养3 d时MDA的含量略低于对照组外,其余各组MDA的含量在实验期间较对照组均有不同程度的升高,尤其是T5、T6试验组MDA含量在培养7 d后急剧升高,至15 d时较对照组分别上升了127.1%和312.7%(图5-D)。
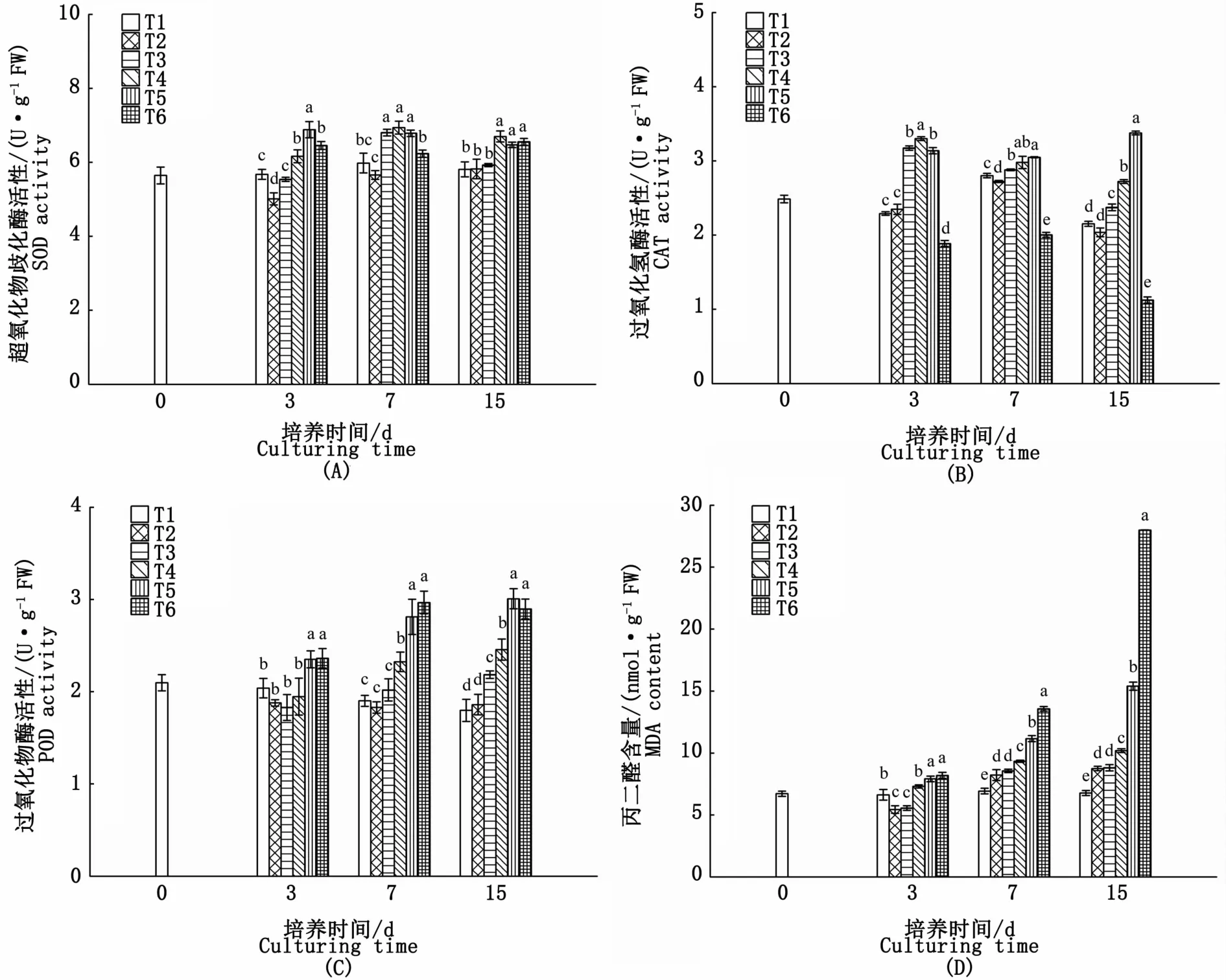
图5 不同氮、磷浓度对海黍子抗氧化系统的影响Fig.5 Effects of different N,P concentrations on antioxidant system of S.muticum
3 讨论
3.1 氮、磷浓度对海黍子生长的影响
海藻的生长受海水中营养盐的影响,其中氮、磷是主要的限制性营养元素。本研究结果表明,氮、磷浓度和培养时间显著影响海黍子的生长。氮、磷浓度在不高于400、25μmol·L-1下,培养3 d时,藻体的生长速率随着氮、磷浓度的升高而增加,这与YU和YANG[6]报道的龙须菜(Gracilarialemaneiformis)在氮、磷浓度较高的情况下生长速率增大的结果一致,其原因是海水中营养盐浓度的上升可使藻体利用营养生长的一系列生理过程的底物浓度升高,从而使海藻的同化作用增加,促进藻体生长。而当海水中氮、磷含量超过一定浓度后,其对藻类的生长则产生抑制作用,本研究也进一步证实了海藻生长存在临界营养盐浓度[11],超过该临界值反而不利于海藻的生长。当继续培养至7 d时,氮、磷浓度超过100、6.25μmol·L-1,随着氮、磷浓度的升高藻体生长速率有下降的趋势,可见该临界营养盐浓度与海藻的营养状态有关,当海藻处于营养亏损状态下,营养盐加富会导致海藻出现超补偿生长[12],当海藻处于营养过剩条件下,营养的持续加富会由促进作用转为抑制作用。因此海黍子在人工增养殖过程中养殖海区的选择尤为重要,氮、磷浓度在不超过400、25μmol·L-1时海黍子生长良好,当氮、磷浓度上升到600、37.5μmol·L-1时,海黍子的生长在比较短的时间内就会受到抑制。此外,氮磷比也是影响藻类生长的重要影响因素,这些都有待进一步的研究。
3.2 氮、磷浓度对海黍子吸收速率的影响
在培养3 d时,海黍子对氮、磷的吸收速率随着外界营养盐浓度的升高而增大,而同期藻体的生长速率却呈先升高后下降的趋势,原因可能是当氮、磷浓度达到海藻生长所需的临界营养盐浓度时,藻类生长达到饱和状态,而营养盐浓度过高则导致营养盐在藻体内积累[6]。研究表明,海藻从环境中吸收的氮主要是形式,其中首先要被还原为才能为藻体所同化,所以当环境中和等氮源共存时,绝大多数藻类总是优先选择吸收本研究发现,当和等量存在时,海黍子对两种氮源的吸收无显著差异,这可能与海黍子的生理状态和实验条件有关,也可能是不同形态氮之间的相互影响所致[14],具体的作用机制还有待进一步研究。
3.3 氮、磷浓度对海黍子生化特性的影响
海水中氮、磷浓度的高低在影响养殖海藻生长的同时,也对藻体内的各种生化组分(如色素、蛋白质等)的含量进行着调节。叶绿素作为藻类进行光合作用的主要色素,其含量的多少直接影响光合速率和光合能力,此外叶绿素也是藻体内一种重要的氮贮藏库。研究表明,在外界氮源丰富的条件下,藻体细胞可以将外界的氮源合成叶绿素积累于叶绿体中,而在缺氮情况下,叶绿素就会降解释放出氮以供应细胞的生长,进而起到调节氮源的作用[15],因此养殖海藻叶绿素含量的变化对研究海藻的生长特征具有重要意义。本研究中氮、磷加富培养3 d时,可促进海黍子藻体内叶绿素a的生成,但继续培养至15 d,氮、磷浓度高于100、6.25μmol·L-1时反而阻止了叶绿素a的生成,在其他一些大型海藻中也得到类似的结果[6,16],推测其原因可能是高浓度的氮、磷抑制了叶绿素相关合成酶的活性,从而阻碍了叶绿素的合成,导致藻体内叶绿素含量的显著下降。类胡萝卜素是光合作用的辅助色素,也是一种光氧化保护剂,本研究显示其含量在氮、磷加富3 d时显著升高,至15 d,氮、磷浓度高于200、12.5μmol·L-1时则显著降低,进一步说明过高浓度的氮、磷在长时间作用下会抑制海藻的生长。
藻体内可溶性蛋白是衡量藻类代谢水平的重要指标之一,其含量的升高有助于维持藻细胞的正常代谢,提高其抗逆性。NH+4或NO-3是藻体内蛋白质合成的底物,因此海水中氮浓度的变化对蛋白质的合成具有显著影响。培养7 d后,各试验组可溶性蛋白含量均显著升高,说明海黍子可能通过提高可溶性蛋白的含量来增加细胞渗透浓度和功能蛋白的数量,而启动自身保护机制以维持藻细胞的正常代谢,其中当氮、磷浓度为400、25μmol·L-1培养15 d时,藻体可溶性蛋白含量达到峰值,提示海水中氮、磷浓度超过该值后,进入藻体的氮、磷不能参与蛋白的合成和生长。
3.4 氮、磷浓度对海黍子抗氧化能力的影响
藻类在生长过程中,活性氧的产生与清除处于动态平衡状态。当藻类处于逆境胁迫下,动态平衡被破坏,造成活性氧自由基的大量累积,由此启动抗氧化酶类防御系统。SOD、CAT和POD是藻类细胞内清除活性氧的主要抗氧化酶,其活性被认为是藻类抗逆性的重要指标[17-18]。本研究表明,氮、磷浓度和培养时间可显著影响海黍子藻体的抗氧化酶系统。氮、磷浓度为50、3.13 μmol·L-1加富培养3 d时,CAT和POD活性没有显著变化,而SOD活性略有下降,表明该处理没有造成藻细胞活性氧的积累。当氮、磷浓度升高至200、12.5μmol·L-1以上时,SOD活性显著升高,而CAT的活性则在氮、磷浓度为600、37.5 μmol·L-1的试验组中显著降低,推测发生此种变化的原因可能是藻体受胁迫后产生活性氧(ROS)的量上升,从而激活更多的SOD来清除活性氧,而产生的超氧化物进一步歧化为H2O2,H2O2的大量积累导致CAT代谢失衡,活性下降。培养7 d后,SOD、CAT和POD 3种抗氧化酶活性变化各异,表明海黍子对海水中不同氮、磷营养条件的响应是一个复杂过程。对于作为衡量细胞膜脂损伤程度重要指标的MDA含量,氮、磷浓度在低于200、12.5μmol·L-1的试验组中培养3 d时出现了短暂的下降,进一步说明藻体内活性氧可能没有大量积累,膜脂过氧化程度较低,而持续培养7 d后,各氮磷加富试验组藻体MDA含量较之对照组均明显升高,表明藻体内活性氧增多,造成膜脂过氧化程度增强。这一现象说明,长期富营养化环境会使海黍子的抗逆性受到抑制,不但不能起到生物修复作用,反而受其胁迫,海黍子生长受到抑制。
4 小结
本研究探讨了不同氮、磷营养条件下海黍子的生长、生理生化特性以及抗氧化能力的变化情况,表明氮、磷浓度在一定浓度范围和培养时间内对海黍子生长起到明显的促进作用,而当氮、磷浓度超过一定值或培养时间时,海黍子的生长及藻体的各项生理生化指标开始受到抑制,并逐渐发生过氧化损伤,抗逆性受到抑制,该结果可为进一步完善海黍子的健康养殖技术和对富营养化污染水域的修复机制研究提供一定的理论参考。

