低氧和酸化胁迫对大黄鱼早期发育阶段消化生理的影响
陈 润,王鲁民,王亚冰,曾 姣,王 倩,王建钢,施兆鸿,彭士明
(1.上海海洋大学水产与生命学院,上海 201306;2.中国水产科学研究院东海水产研究所,上海 200090)
海洋是一个极其复杂的生态系统,海洋中环境因子的变化会对海洋生物的生命活动产生影响。根据政府间气候报告专门委员会评估报告(简称IPCC)预测,人类大量使用化石燃料排放出的CO2已经导致海水pH降低,并且酸化的情况正在加剧[1]。近年来,关于海洋酸化对海洋生物影响的研究受到研究人员的广泛关注。有研究表明,海洋酸化已经对珊瑚[2-3]、软体动物[4]、甲壳动物[5]等钙化生物的生命活动、鱼类的早期胚胎和骨骼发育造成不利影响[6],有些鱼类的感觉器官如耳石[7]也因此受损而变得行为迟钝[8-9]。在近海的水产养殖集中海区,由于养殖动物密度过大,缺氧情况时有发生。研究表明,当水环境中溶氧降低时,水生动物会出现行动迟缓、摄食下降等情况[10],从而影响到水生动物的正常生命活动,严重时可导致死亡。因此,近年来有关低氧和酸化胁迫对水生动物生命活动影响的研究逐渐引起关注。
大黄鱼(Larimichthyscrocea)隶属于石首鱼科黄鱼属,是我国重要的海洋经济动物,也是我国增养殖较为成熟的鱼种。据统计,仅2018年我国海水养殖的大黄鱼产量就达到19.8万t[13]。福建宁德官井洋是我国野生大黄鱼主要的产卵洄游海域之一,同时也是养殖大黄鱼的主要产区[14]。近年来,随着宁德海区内养殖户数量不断增加和养殖规模不断扩大,其高密度和粗放式的养殖模式不仅对养殖大黄鱼形成了潜在的威胁,而且对海区的生态环境也造成了严重的影响[15]。由于该海区养殖网箱数量多且网箱内养殖密度过大,严重影响了水流交换,导致养殖过程中产生的残饵、粪便等有机物逐渐沉积,无法被潮水带走,从而增加了水体的化学需氧量,极易出现溶氧降低的情况[16]。
近年来,受捕捞和环境的影响,大黄鱼野生种群资源已经濒临枯竭[14],低氧和海洋酸化等问题可能会对野生大黄鱼的生长与繁殖产生负面影响,从而不利于其种群资源的恢复。因此,本实验探究了低氧-酸化胁迫对大黄鱼早期发育消化生理的影响,以期为野生大黄鱼种群资源保护工作提供理论依据。
1 材料与方法
1.1 实验材料
大黄鱼受精卵的孵化及育苗实验在东海水产研究所福建福鼎研究中心进行,实验用大黄鱼受精卵取自附近大黄鱼育苗厂。大黄鱼受精卵运至福鼎研究中心后,先暂放于孵化桶中,待死卵沉淀分离后,取上层活性卵备用。
1.2 实验方法
根据已有文献记载,大黄鱼稚幼鱼的窒息点溶解氧(DO)为2.27 mg·L-1,因此设定低氧试验组DO=3.5 mg·L-1[17];根据资料预测,到2100年海洋酸化可能使海水pH下降0.31个单位[7],以及结合大黄鱼对pH临界值的相关文献报道[18],本研究设定酸化试验组pH=7.3。
养殖实验共设置4个组,分别为:对照组:DO=7.0 mg·L-1,pH=8.1;低氧组:DO=3.5 mg·L-1,pH=8.1;酸化组:DO=7.0 mg·L-1,pH=7.3;低氧-酸化组:DO=3.5 mg·L-1,pH=7.3。本实验控制DO和pH的方式如下:
1)向水体中充入N2来降低水体的DO值,通过YSI ProSolo实时监测DO值,当DO降到所需浓度后即可停止充入N2;养殖实验过程中严格控制低氧-酸化组和低氧组的气头出气量,使气头出气量与水体中耗氧量相持平。
2)向水体中充入CO2来降低水体的pH值,通过YSI 10实时监测pH值,当pH降到特定值后即可停止充入CO2。
除溶氧和pH不同外,其他参数均保持一致:水温23.0℃,海水比重为1.022。
每个处理组设置4个重复,共16个养殖桶,将受精卵放入各个养殖桶,每桶4.0×104粒,至水环境稳定后开始取样(记录为0 d),并在受精卵孵出后1 d、3 d、5 d、10 d、20 d、27 d取15尾仔稚鱼放入冻存管中,经液氮速冻后置于-80℃冰箱保存,以备后期检实验使用。
1.3 日常管理
实验开始后,每隔15 min测量1次DO和pH值,对参数浮动较大的及时做出调整,当DO和pH值稳定后改为每隔6 h测量1次。待受精卵全部孵化后,及时将沉底的死卵和死鱼虹吸出,以免破坏水质。当大黄鱼发育至仔鱼后可开始换水,每3 d换1次,每次换水量为养殖水体的1/3,换水前根据不同组别预调好与该处理组相对应的DO、pH值的水,再加入养殖桶中。
大黄鱼受精卵孵化后第3天开口,每天将300 g新鲜牡蛎(Ostreasp.)放入料理机打碎后用200目筛绢网反复涤荡过滤后,少量多次均匀泼洒于各个养殖桶中。第6天后开始投喂卤虫幼体,投喂密度约为45个·mL-1,根据养殖桶中的卤虫幼体密度每天投喂1~2次,直至养殖实验结束。
1.4 检测方法
大黄鱼早期发育的淀粉酶、脂肪酶和胰蛋白酶活性均使用南京建成生物工程研究所生产的试剂盒测定,具体的操作步骤参照试剂盒说明书。
1.5 统计分析
本次实验所得到数据采用SPSS26.0软件进行双因素方差分析、Excel进行柱状图表绘制,实验数据以平均值±标准差(mean±SD)表示。
2 结果与分析
2.1 生长发育结果
实验开始时各处理组受精卵处于尾芽期与心跳期之间,10 h后全部孵化出膜。卵黄囊在出膜后4~5 d消失,其中低氧-酸化组和低氧组大黄鱼仔鱼卵黄囊消失时间稍晚。出膜后19 d对照组和酸化组大黄鱼长成稚鱼,20、21 d低氧组和低氧-酸化组大黄鱼先后长成稚鱼。
2.2 低氧和酸化胁迫对淀粉酶活性的影响
如图1显示,对照组的淀粉酶活性呈现先升高后降低的趋势,在1 d和3 d显著升高后保持稳定,直到20 d显著下降。低氧-酸化组同样呈现出先升高后降低的趋势,淀粉酶活性在1 d显著跃升之后升高趋势逐渐平缓,5 d达到顶峰后酶活性开始逐渐降低,下降趋势平缓;低氧-酸化组淀粉酶活性在10 d显著低于对照组,在27 d显著高于对照组。低氧组淀粉酶活性在1 d显著升高后,在3 d显著降低,5 d显著上升保持相对稳定,其酶活性在10 d达到顶峰,10 d后开始逐渐下降;在3 d其酶活性显著低于对照组,在20 d则显著高于对照组。酸化组的淀粉酶活性同样呈现出先升高后降低的趋势,其酶活性在1 d、3 d和10 d显著升高并在10 d达到顶峰,15 d和20 d显著降低;但其各个时间点淀粉酶活性与对照组相比无显著性差异。

图1 低氧和酸化胁迫对大黄鱼早期发育阶段淀粉酶活力的影响Fig.1 Effect of hypoxia and acidification on amylase activity of Larimichthys crocea in early developmental stage
低氧和酸化对大黄鱼早期发育淀粉酶活性的胁迫效果如表1所示。低氧胁迫在10 d存在极显著性差异,在20 d和27 d存在显著性差异;酸化胁迫在各个阶段胁迫效果均不显著;低氧和酸化的双重胁迫则在3 d出现显著性差异,在5 d出现极显著差异。由此可见,低氧胁迫对大黄鱼早期发育过程中淀粉酶活性的影响主要发生在10 d以后,而低氧和酸化的交互作用在5 d之前较明显。
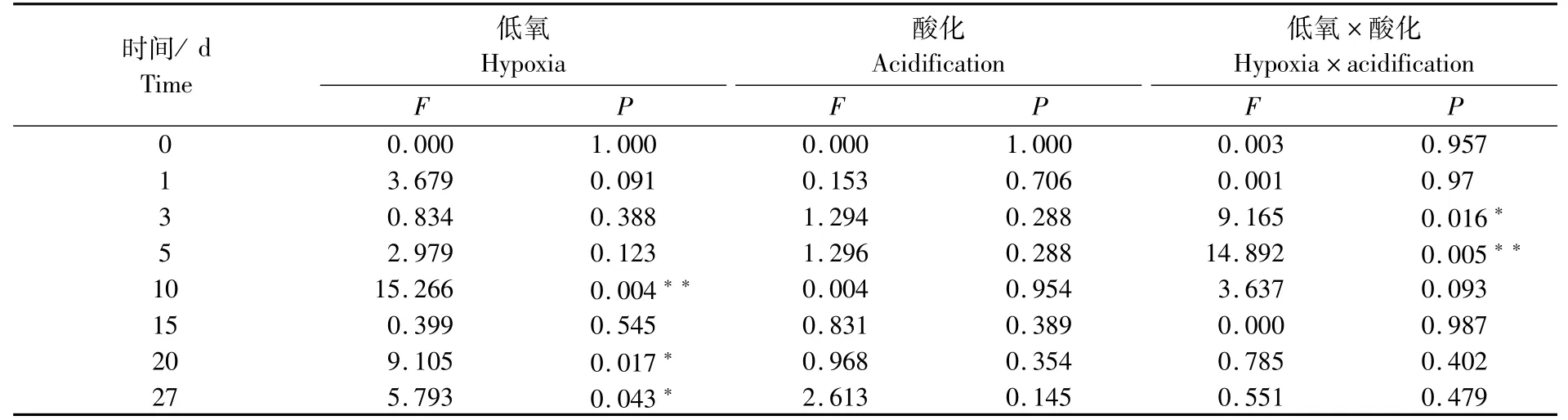
表1 低氧和酸化胁迫对大黄鱼早期发育阶段淀粉酶活力影响的双因素分析Tab.1 Two-factor analysis of effects of hypoxia and acidification on amylase activity of Larimichthys crocea in early developmental stage
2.3 低氧和酸化胁迫对胰蛋白酶活性的影响
如图2显示,对照组的胰蛋白酶活性总体呈现先降低后升高再降低的趋势,其中1~5 d无显著变化,10 d酶活性显著降低,15~20 d逐渐上升,27 d酶活性显著降低。低氧-酸化组的酶活性呈现出先升高后降低的变化趋势,其中1 d显著升高,5 d开始逐渐降低,10 d酶活性下降显著,15 d达到最低值,之后保持相对稳定;低氧-酸化组酶活性在1 d、3 d和27 d显著高于对照组,在5 d和10 d极显著高于对照组。低氧组的酶活性呈现出先升高后降低的变化趋势,1 d显著升高达到顶峰,3 d开始酶活性逐渐降低至15 d达到最低值,10~27 d胰蛋白酶活性无显著变化;低氧组酶活性在5 d和10 d显著高于对照组,27 d极显著高于对照组。酸化组的酶活性呈现先升高后降低的趋势,1 d开始逐渐上升,3 d达到顶峰后开始下降,在10 d达到最低值,15~27 d胰蛋白酶活性无显著变化;酸化组胰蛋白酶活性在5 d显著高于对照组。
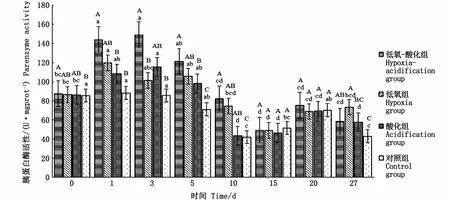
图2 低氧和酸化胁迫对大黄鱼早期发育阶段胰蛋白酶活力的影响Fig.2 Effect of hypoxia and acidification on parenzyme activity ofLarimichthys crocea in early developmental stage
低氧和酸化对大黄鱼早期发育胰蛋白酶活性双重胁迫的影响如表2所示。低氧胁迫在0 d、3 d和10 d的效果显著,在1 d、5 d和27 d的效果极显著,可见低氧胁迫对胰蛋白酶活性的影响主要表现在10 d之前;酸化胁迫在1 d和5 d的效果显著,3 d的效果极显著,表明酸化胁迫在5 d之前对胰蛋白酶活性有影响;低氧-酸化对胰蛋白酶活性的双重胁迫作用在27 d影响显著。
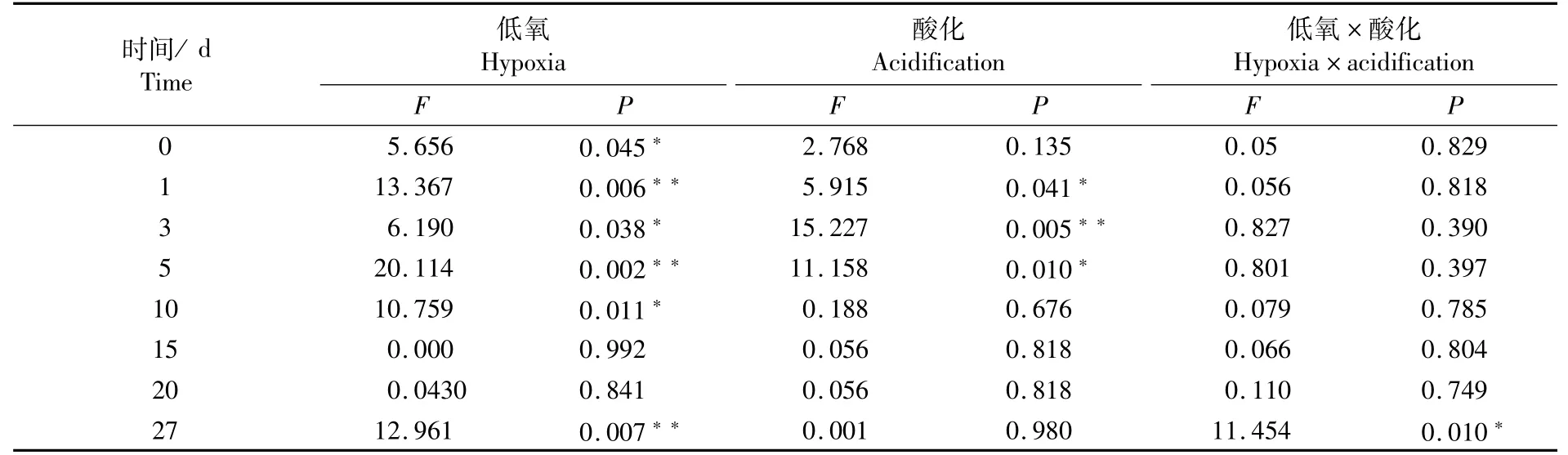
表2 低氧和酸化胁迫对大黄鱼早期发育阶段胰蛋白酶活力影响的双因素分析Tab.2 Two-factor analysis of effects of hypoxia and acidification on parenzyme activity of Larimichthys crocea in early developmental stage
2.4 低氧和酸化胁迫对脂肪酶活性的影响
低氧和酸化胁迫对脂肪酶活性的影响如图3所示。对照组脂肪酶活性从5 d开始显著升高并在10 d达到顶峰,15 d显著降低,0 d、1 d、3 d、15 d、20 d和27 d酶活性无显著性差异。低氧-酸化组的酶活性呈现出先降低后升高再降低再升高的变化趋势,在3 d开始下降但不显著,5 d且到达最低值,10 d开始上升但不显著,15 d有所下降后开始上升;低氧-酸化组在5 d、10 d和15 d,脂肪酶活性低于对照组,15 d时差异显著,5 d和10 d差异极显著。低氧组的酶活性在整个实验过程中有所波动但变化均不显著,低氧组酶活性在5 d、10 d显著低于对照组。

图3 低氧和酸化胁迫对大黄鱼早期发育阶段脂肪酶活力的影响Fig.3 Effect of hypoxia and acidification on lipase activity of Larimichthys crocea in early developmental stage
低氧-酸化对大黄鱼早期发育脂肪酶活性双重胁迫的影响如表3所示,低氧胁迫在10 d对脂肪酶活性的作用效果显著;酸化胁迫在5 d对脂肪酶活性的作用效果极显著;低氧-酸化的双重胁迫对脂肪酶活性的作用没有显著加剧。由此可见,低氧胁迫和酸化胁迫均在5~10 d这一时段内导致了脂肪酶活性的降低。
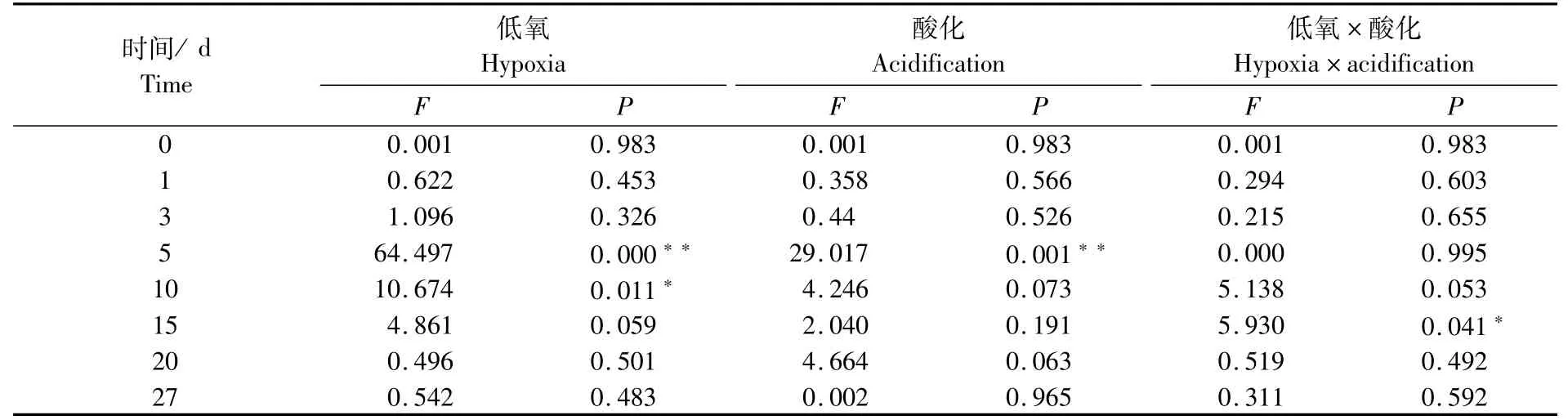
表3 低氧和酸化胁迫对大黄鱼早期发育阶段脂肪酶活力影响的双因素分析Tab.3 Two-factor analysis of effects of hypoxia and acidification on lipase activity of Larimichthys crocea in early developmental stage
3 讨论
鱼类早期消化系统发育具有明显的阶段性,仔稚鱼阶段是其中最重要的环节,不同的鱼类消化系统发育时间也有所不同。大黄鱼仔稚鱼发育阶段的消化生理暂未见报道,仅有席峰等[19]关于大黄鱼幼鱼阶段发育进程中消化酶活力变化的研究,因此,本研究主要以同为石首鱼科的日本黄姑鱼(Nibeajaponica)仔稚鱼发育阶段消化酶活力变化作为参考[20]。
低氧胁迫对水生动物生理生化影响的研究较多,但针对消化生理的研究相对较少。本次实验结果可以看出,大黄鱼早期发育阶段淀粉酶在实验前5~10 d其酶活性都有显著提高,但之后又逐渐下降,这与日本黄姑鱼孵化后13 d内消化酶活性变化规律相似[21-22],日本黄姑鱼在孵化后13 d内淀粉酶活性先升高后降低,13 d后淀粉酶活性再升高;15 d之后大黄鱼与日本黄姑鱼淀粉酶活性出现不同的变化趋势,原因可能是黄姑鱼此后开始投喂配合饲料而大黄鱼在整个实验过程都未使用配合饲料。值得关注的是,本实验低氧胁迫前10 d大黄鱼胰蛋白酶活性相较于对照组出现了显著性升高,这可能是因为鱼体受到胁迫后会提高胰蛋白酶活性以获得更多的蛋白来对抗恶劣环境,当机体对恶劣环境逐渐适应后,则不再需要额外的能量来对抗外界胁迫因子,胰蛋白酶的活性便恢复正常水平。孙敏等[21]研究认为,5 d之前由于机体还没开口或即将开口,这阶段属于内源性营养到外源性营养的转化,随着自身营养物质的消耗殆尽,脂肪酶活性也逐渐降低。本实验中,低氧-酸化组在前5 d脂肪酶活性降低,可能与恶劣环境中消耗过多内源性营养物质有关。此外,虽然低氧-酸化组的脂肪酶活性在5~15 d降低,但在20 d时开始恢复到与对照组相同水平,表明其可能在适应恶劣环境、恢复正常活性后出现补偿性代谢。大黄鱼的开口时间在3 d左右[12],此时可以摄入外源性营养物质,对照组在5~10 d脂肪酶活性显著升高,而其他3个处理组受到胁迫作用影响而脂肪酶活性却无显著变化,可能是由于胁迫作用抑制了脂肪酶的活性,因此可以推断低氧胁迫和酸化胁迫对大黄鱼早期发育过程中脂肪酶活性有抑制作用。
国内外酸化胁迫对鱼类消化生理影响的研究较少,因此本文参考部分海洋无脊椎动物的相关 研 究。KHAN等[4]对 厚 壳 贻 贝(Mytilus coruscus)的酸化胁迫研究发现,酸化条件下(pH=7.7)的厚壳贻贝淀粉酶、胰蛋白酶和脂肪酶等活性均受到显著抑制;ZHAN等[22]发现在酸化条件下(pH=7.55、7.68、7.82)虾夷马粪海胆(Strongylocentrotusintermedius)肠道中的脂肪酶活性也受到抑制。从本实验结果来看,大黄鱼酸化组与对照组淀粉酶活性总体上虽然没有存在太多的显著性差异,但酸化组各个时间点之间的变化趋势与对照组相比波动较大。脂肪酶活性除了在5 d、10 d与对照组有显著性差异外,总体上酸化胁迫对大黄鱼早期发育阶段消化酶活性的影响并不大。国内已有的关于pH对鱼类消化酶活性影响的研究,也可以从侧面为本实验做参考。有研究表明,鱼类各个器官的消化酶的最适pH值有所不同而且pH值差异较大,在鱼类早期的消化器官发育中,胃是最早形成的[21],而胃消化酶的最适pH值通常是中性或弱酸性[23-24]。由此推断,借助海水酸化的条件,鱼体可以更容易达到消化酶所需的最适pH值。王晓清等[18]通过对大黄鱼幼鱼进行急性胁迫实验得出,大黄鱼幼鱼在pH为5.2时可以生存1~8 h,可见大黄鱼对pH耐受性较高。此外,据报道,大黄鱼如今已经实现了淡水工厂化养殖[25-27],淡水的pH值通常低于正常海水,因此也可以从宏观的角度推断:以当前设定的海洋酸化所达到的pH值虽然不会对大黄鱼正常的生命活动造成危害,但对其消化生理会造成一定的影响。
许多研究表明,多环境因子胁迫对水生生物交互作用造成更大的不良影响,比如厚壳贻贝在低氧-酸化-暖化的胁迫下消化酶活性受到的抑制效果更为显著[4];太平洋鳕鱼(Gadusmorhua)在低氧-酸化胁迫下脂肪酸代谢发生改变、脂质稳态被破坏的效果显著[28]。HAMILTON等[29]研究了两种岩鱼(Sebastescaurinus、S.mystinus)在低氧和酸化胁迫下(pH=7.3、7.6、7.8;DO=2.2、4.1、6.0 mg·L-1)对其耳石发育的影响,发现酸化对耳石发育影响显著,低氧的影响较小。而本实验的结果表明,在本实验所设定的低氧-酸化环境胁迫下,双因子双重胁迫作用仅对淀粉酶活性产生更严重的影响,而对胰蛋白酶和脂肪酶活性造成的双重胁迫效果不显著。本实验出现这一现象的原因可能是试验组低氧值的设定虽然处于临界浓度(2.27 mg·L-1)和适宜浓度(4.70~5.38 mg·L-1)[17]之间,但更接近适宜浓度,因此大黄鱼在受到胁迫后消化酶活性可以逐渐恢复到正常水平。
4 小结
在本实验条件下,低氧胁迫导致大黄鱼早期发育过程中淀粉酶活性在10 d以后显著升高,而胰蛋白酶活性显著升高主要在10 d之前,脂肪酶活性在5~10 d显著性降低;酸化胁迫同样导致大黄鱼早期发育过程中脂肪酶活性在5~10 d显著性降低;低氧-酸化双胁迫对淀粉酶、胰蛋白酶、脂肪酶活性的影响要大于单一胁迫因子(低氧、酸化)。本研究揭示了低氧、酸化和双重胁迫下大黄鱼早期发育阶段消化酶活性的变化规律,为后续进一步开展低氧、酸化胁迫对鱼类生长、代谢影响机制的研究提供了基础数据。

