青海湖裸鲤幼鱼热激蛋白60基因克隆及其在碳酸盐碱度胁迫下的表达
刘一萌,包 锬,李 航,么宗利,孙 真,高鹏程,周 凯,王 菲,来琦芳
(中国水产科学研究院东海水产研究所,农业农村部东海渔业资源可持续利用重点实验室,上海 200090)
青海湖位于我国西北部,地处有着“世界屋脊”之称的青藏高原东北角[1-2],海拔在3 200 m左右,是我国最大的内陆封闭湖,也是最大的盐碱湖[3-4]。受蒸发以及淡水流入减少等因素的影响[5],青海湖的碱度(carbonate alkalinity,CA)逐年增 加,已达 到29 mmol·L-1(pH 9.1~9.5)[6-8]。在如此极端环境下,生活着唯一的经济鱼类青海湖裸鲤(GymnocyprisprzewalskiiKessler 1876)。不同于其他鲤科鱼类,青海湖裸鲤有生殖洄游的习性,可穿梭于淡水和盐碱水环境。幼鱼出生于河流等淡水水体中,待成长到一定阶段便随着水流游入青海湖中生活[9-10]。青海湖裸鲤幼鱼由淡水转入高碱度水域,能够快速适应环境,然而其中的分子机制目前并不清楚。
热激蛋白(heat shock protein,简称Hsp)是一类广泛存在于生物体内的热应激蛋白。当生物体受到环境中物理、化学、生物条件刺激时,会大量产生这类蛋白[11],参与到生物体生理代谢调节、正常生理活动维持中。热激蛋白包括Hsp90、Hsp70、Hsp60、Hsp40、Hsp10以及小分子量Hsp等6个家族[12]。其中热激蛋白60(heat shock protein 60,简称Hsp60)的主要功能是参与蛋白质的正确折叠、稳定大分子结构和装配以及转录调控[13-16],因此编码热激蛋白60的Hsp60基因在应激反应中存在一定的应答能力,以维持细胞、组织和器官内环境的稳态。青海湖裸鲤幼鱼从淡水水域进入高碳酸盐碱度的青海湖中,各组织器官中的Hsp60基因是否也会对碱度变化以及高碱度环境做出反应,其是如何表达的,这些方面的相关研究尚鲜见报道。
本研究克隆了青海湖裸鲤的Hsp60基因mRNA全长序列并进行生物信息学分析,通过模拟青海湖裸鲤幼鱼在由淡水进入青海湖高碳酸盐碱度水体这一过程中,鱼体受到高碱度胁迫时Hsp60基因在青海湖裸鲤幼鱼各组织器官的表达状况,揭示青海湖裸鲤Hsp60基因受到高碱度胁迫时发挥的作用,以期为探讨和研究高碳酸盐碱度胁迫条件下水生生物体内分子响应机制研究提供基础数据。
1 材料与方法
1.1 实验用鱼处理
本实验采用的青海湖裸鲤来自青海省青海湖裸鲤救护中心,为淡水池塘养殖的青海湖裸鲤幼鱼,空运回中国水产科学研究院东海水产研究所水产养殖技术实验室并暂养于鱼类养殖循环系统(盐度0~1,温度18℃,碳酸盐碱度1~2 mmol·L-1,pH 7.5~8)中,每日早、中、晚各投喂商业用鱼饲料1次,驯化3个月后进行实验。选取的实验用鱼体长为(13.45±0.65)cm,体质量为(11.21±0.83)g。为模拟青海湖裸鲤幼鱼由淡水进入高碳酸盐碱度的青海湖这一过程,配制与青海湖相似碳酸盐碱度[29 mmol·L-1,pH 9.3;实际为(26±0.57)mmol·L-1,pH 9.2~9.5]的实验用水(配制方法参考衣晓飞等[17])。设置暂养于淡水的青海湖裸鲤幼鱼为对照组,将裸鲤幼鱼进行急性碳酸盐碱度胁迫,并在胁迫1、3、6、9、12、24、48、72、96、168 h时取样,每个取样时间点取3条鱼样品做重复,每条鱼的取样组织为脑、鳃、肝、肠、肾、肌肉以及皮肤组织,样品置于液氮中冻存备用。
1.2 RNA提取及cDNA合成
采用TRIzol试剂(Invitrogen,USA)提取组织总RNA,并通过琼脂糖凝胶电泳确定RNA完整性,用Nanodrop 2000 spectrophotometer(Thermo Fisher Scientific,USA)检测并记录RNA浓度。根据各组织RNA浓度取约1μg总RNA,使用反转录试剂盒(PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit,Takara,Japan)将RNA反转为cDNA并储存于-20℃条件下。
1.3 GpHsp60全长基因的扩增和克隆
从NCBI数据库(美国国立生物技术信息中心)中下载青海湖裸鲤肾组织的转录组数据(SRA数据文件号:SRR1542353),利 用SRA Toolkit(https://trace.ncbi.nlm.nih.gov/Traces/sra/sra.cgi?view=software)软件将SRA数据文件转为fastq格式文件,用Trimmomatic v0.36[18]去接头以及低质量碱基序列,剩下高质量数据使用Trinity v2.6.5[19]进行de novo拼接,软件参数设置为默认选项。根据斑马鱼(Daniorerio)(NM_181330.3)和 金 鱼(Carassius auratus)(MT602074)的Hsp60基因序列,与拼接好的青海湖裸鲤序列文件进行本地Blast[20](Blast+v2.8.1)比对,根据获得序列片段设计引物(表1),以鳃组织的cDNA为模板,进行PCR扩增并克隆GpHsp60基因开放阅读框(open reading frame,ORF)。根据获得的GpHsp60基因ORF区序列片段,设计5′UTR和3′UTR的巢式引物(表1),采用cDNA末端快速克隆技术(rapidamplification of cDNA ends,RACE)依据试剂盒说明书(SMARTer RACE 5′/3′Kit,Takara,Japan),对GpHsp60基因的5′UTR和3′UTR进行扩增和克隆。克隆获得的所有序列均交由生工生物工程(上海)股份有限公司进行测序。

表1 GpHsp60基因相关引物序列Tab.1 Nucleotide primers used in the cloning of GpHsp60 gene
1.4 GpHsp60基因序列分析
使用在线蛋白质理化性质分析软件ProtParam(https://web.expasy.org/protparam/)计算蛋白质分子量、等电点和亲水性[21];利用Prosite(https://prosite.expasy.org)进行氨基酸结构域预测[22],用Swiss-model对氨基酸序列进行蛋白 质 三 维 结 构 预 测[23],采 用Blast软 件(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在NCBI数据库中进行相似性比较,下载抚仙金线鲃(Sinocyclocheilus grahami)、安 水 金 线 鲃(Sinocyclocheilus anshuiensis)、鲫(Carassius auratus)、鳊(Megalobramaamblycephala)、青鱼(Mylopharyngodonpiceus)、 草 鱼(Ctenopharyngodon idella)、大鳞副泥鳅(Paramisgurnus dabryanus)、泥 鳅(Misgurnus anguillicaudatus)和斑马鱼(Daniorerio)的Hsp60基因序列进行序列比较,选取鳜(Siniperca chuatsi)作为外群进行分析。利用Clustal W[24]对所有序列做排列,并用Mega 6.0软件[25]进行比对,设置Bootstrap值为1 000进行最大似然法(maximum likelihood)聚类分析。
1.5 GpHsp60基因荧光定量检测
根据获得样品的GpHsp60全长基因序列,在CDs区设计荧光定量引物(表1),分别以不同处理时间点的cDNA样品为模板,以生活于淡水中的青海湖裸鲤幼鱼各组织cDNA为参照,以青海湖 裸 鲤 的EF1a(elongation factor 1-alpha,GpEF1a)为内参基因[8],采用SYBR Green荧光染料法(北京全式金生物公司),进行实时荧光定量检测。反应体系为20μL,反应程序为预变性95℃3 min;95℃变性20 s,56℃退火20 s,72℃延伸20 s,共计40个循环。对下机数据使用ΔΔCT值法进行相对定量分析,以淡水组青海湖裸鲤幼鱼对应各组织表达量作为参照,采用SPSS V22软件进行t检验和单因素方差(one-way ANOVA)分析,使用Turkey检验进行多重比较差异显著性分析(P<0.05时差异显著),使用Origin 9软件作图。
2 结果与分析
2.1 GpHsp60基因的克隆与分析
克隆获得GpHsp60cDNA全长为2 995 bp(图1),ORF区为1 728 bp,5′UTR和3′UTR序列大小分别为137 bp和113 bp。在3′UTR上含有典型的真核生物mRNA六核苷酸多腺苷化加尾修饰位点“AATAAA”。将获得的GpHsp60基因序列在NCBI数据库中进行比对,显示与其他鱼类的Hsp60基因高度相似。GpHsp60基因编码氨基酸575个,分子量为61.34 kDa,理论等电点为5.38,总平均亲水值为-0.084,具有线粒体Hsp60基因高度保守的ATP结合结构域(199~206:ITVKDGKT)、标签序列(430~441:AAVEEGIVlGGG)以及C端“GGM”重复序列(559~573:GGMGGMGGMGGMGGM),判定所获青海湖裸鲤幼鱼的GpHsp60为Hsp60基因,并将GpHsp60基因提交到GenBank数据库中,获得收录号(GenBank accession)为MT602074。

图1 GpHsp60基因核酸以及氨基酸序列Fig.1 Nucleic acid and amino acid sequence of GpHsp60 gene
2.2 GpHsp60基因序列进化分析
使用Mega软件对11个来自鱼类的Hsp60基因序列扫描并应用最佳进化模型GTR+I构建系统发育树(图2)。系统进化分析显示,青海湖裸鲤(裂腹鱼亚科)的Hsp60基因与抚仙金线鲃和安水金线鲃(鲃亚科)Hsp60基因亲缘性相近。在鲤科鱼类中青海湖裸鲤先与鲃亚科和鲫聚为一类,而后再与雅罗鱼亚科和花鳅亚科聚类,说明裂腹鱼亚科、鲃亚科和鲤亚科Hsp60基因相似度较高。

图2 青海湖裸鲤与部分鲤亚目鱼类Hsp60基因进化发育关系Fig.2 Evolutionary and developmental relationship of Hsp60 gene between G.przewalskii and other carp suborder fishes
2.3 碳酸盐碱度胁迫下GpHsp60基因表达
通过qPCR技术对青海湖裸鲤鳃、心、脑、肝、脾、肾、肠和皮肤组织中GpHsp60基因定量分析显示,GpHsp60在以上各组织中都有表达(图3)。相较于对照组,碱度胁迫开始1 h后,GpHsp60在脑(1.95倍)和心脏(2.29倍)中出现表达量上升的现象,之后开始回落至对照组水平,并保持到168 h;在碱度胁迫1 h和3 h时,鳃和肝脏中的GpHsp60基因表达量较高,其中鳃中GpHsp60基因在1 h(1.99倍,P<0.01)和3 h(1.92倍,P<0.01)时极显著高于淡水组,之后胁迫组青海湖裸鲤鳃中GpHsp60表达量缓慢下降,直至48 h后进入稳定状态,表达量回落至淡水组水平。青海湖裸鲤肝脏中GpHsp60基因在碱度胁迫下最高表达量出现在3 h时,是对照组的3.52倍,在6 h时恢复到处理前水平并维持至168 h;肾脏和肌肉中GpHsp60基因在胁迫3 h时,开始出现高表达趋势,其中肌肉在6 h时达到最高值(3.535倍,P<0.01),之后开始回落,12 h后恢复至对照组水平;肾脏中GpHsp60基因在鱼体进入高碳酸盐碱度环境3 h后的5个取样时间点的表达量均维持在高水平(大于3倍对照组水平),直至48 h后恢复至对照组水平;肠和脾脏中的GpHsp60基因表达量则在裸鲤处于碱度环境1 h后,相对于对照组出现了下降,分别在6 h(0.257倍,P<0.01)和12 h(0.251倍,P<0.01)达到最低值,在碱度处理72 h后恢复至对照组正常水平;皮肤中GpHsp60表达量在胁迫前后无显著变化(P>0.05)。
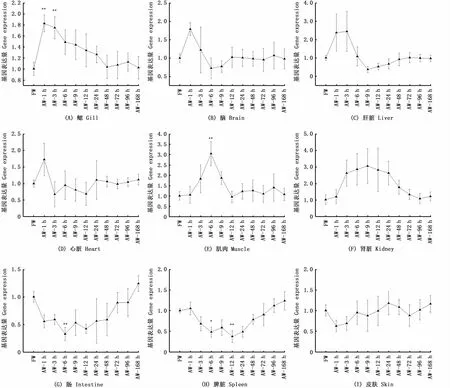
图3 青海湖裸鲤受碱度胁迫后9个组织器官中GpHsp60的表达量变化Fig.3 Expression of GpHsp60 in 9 tissues from G.przewalskii under alkalinity stress
3 讨论
本研究共获得GpHsp60基因序列mRNA全长共计2 995 bp,ORF可编码575个氨基酸,并含有Hsp60保守特征序列、GGM重复序列以及ATP结合结构域[26-27],与其他鲤科鱼类Hsp60长度和特征基本一致[28-32],确认获得的GpHsp60序列属于Hsp60基因家族。核苷酸序列分析显示,青海湖裸鲤的GpHsp60与鲃亚科鱼类Hsp60的相似度较高,这可能是因为裂腹鱼亚科祖先源于原始鲃类鱼[33]。本研究发现,鲃亚科、裂腹鱼亚科和鲤亚科的Hsp60基因序列聚为一类,雅罗鱼亚科和花鳅亚科聚为一类。陈湘粦等[34]通过鲤科鱼类解剖形态学研究证实,鲤科鱼类主要来源于鲃系鱼和雅罗鱼类,鲃亚科、裂腹鱼亚科和鲤亚科来自原始鲃系鱼,而雅罗鱼亚科和花鳅亚科鱼类是由原始雅罗鱼类进化而来。
青海湖裸鲤幼鱼在从淡水迁移至高碳酸盐碱度的青海湖过程中,Hsp60基因在体内多个器官组织中都会出现表达量升高。鳃是鱼类离子平衡、渗透压平衡和酸碱平衡调节的重要场所,是应答水环境变化的主要器官之一[35],包含在血碱平衡中起到重要调节作用的ATPase酶类VH+-ATPase和Na+/K+-ATPase以及Cl-/HCO3-交换蛋白等[36-38]。YAO等[8]发现,青海湖裸鲤在由淡水进入青海湖水中96 h内,会降低碳酸酐酶基因在鳃细胞中的表达,以弥补呼吸性碱中毒。本研究中青海湖裸鲤幼鱼在高碱度胁迫后,鳃中GpHsp60基因表达量在胁迫后1 h和3 h即出现明显升高,推测青海湖裸鲤幼鱼鳃器官受到了碱度急性胁迫影响,鳃上细胞在短时间内招募Hsp60参与调节信号通路等分子生物学过程,引导裸露的鳃对高碱度水体做出反应,以应对鳃细胞的碱中毒。鳃中GpHsp60基因在处理后6 h表达量开始下降,直到48 h达到胁迫前水平,并维持至实验结束。脑、肝脏、心脏和肌肉组织中的GpHsp60基因在机体进入高碱度环境后1~3 h,便出现高表达趋势,显示由GpHsp60参与的解毒作用在短时间内发挥了有效作用。但与对照组无显著性差异(P>0.05)(图3-B~E),表明环境碱度对青海湖裸鲤幼鱼内环境有着一定的影响,GpHsp60基因可能在短时间内先高表达,保证机体内环境各器官的正常功能,但随即恢复到正常水平,说明青海湖裸鲤幼鱼可能由自身其他机制保证了内环境的稳定,因此GpHsp60基因表达量随即下降。以上各组织细胞在受碱度胁迫后,其中的GpHsp60基因表达量作出了一定的调节,引导机体适应水体的高碱度,而在鳃、脑、肝、心脏和肌肉各组织中GpHsp60基因又能够很快恢复至处理前水平,显示Hsp60的作用过程用时短,说明了青海湖裸鲤可以在进入高碱度水体后快速适应环境的改变。但在肾脏中GpHsp60基因却出现长达48 h的高表达状态(图3-F),可能是因为受碱度环境的胁迫,青海湖裸鲤内环境被打破,而肾脏作为血液离子调节和代谢物质排泄的重要场所[39-40],参与了离子交换和代谢过程,以维持鱼体内酸碱和渗透平衡。环境碱度胁迫打破了内环境的平衡,肾脏长时间进行诸如氨氮代谢、酸碱调节等功能运行时受到影响,如YAO等[8,41]发现,碱度胁迫96 h内裸鲤肾脏中的碳酸酐酶基因呈低表达状态以应对肾脏碱中毒。而线粒体型GpHsp60基因在肠和脾脏出现表达下调(图3-G,H),推测原因可能是肠和脾脏受碱度胁迫后应激反应较弱,同时肠和脾脏细胞中的线粒体效率降低了,进而影响肠和脾脏的功能,显示青海湖裸鲤幼鱼在进入碱性环境初始阶段,将能量主要提供给用于离子调节、酸碱平衡、运动系统等功能的器官上,而对于消化和血液循环等功能的投入有所降低,以快速适应新环境。在具有防水和阻止离子进出功能的皮肤(图3-I)中,GpHsp60基因表达量无显著性变化,说明碱度胁迫可能对青海湖裸鲤幼鱼的皮肤组织影响不大。

