以拉氏拟柱胞藻和浮丝藻为主的蓝藻水华对中华绒螯蟹肠道和鳃及其养殖环境微生物群落结构的影响
马清扬,王 元,李传步,范培莉,周俊芳,房文红
(1.上海海洋大学,国家水生动物病原库,上海201306;2.中国水产科学研究院东海水产研究所,农业农村部东海渔业资源开发利用重点实验室,上海 200090)
中华绒螯蟹(Eriocheirsinensis)又名河蟹,是我国重要的淡水养殖经济蟹类[1],2018年全国养殖产量达75.7万t[2]。中华绒螯蟹养殖区域主要集中在长江、黄河和辽河流域[3-4],随着养殖规模扩大和放养密度增大,饲料大量投喂导致粪便和残饵蓄积,使得养殖水体极易暴发蓝藻(Cyanobacteria)水华[5],不仅会破坏养殖水的生态系统[6-7],有些藻类还会释放次级代谢产物,对水生动物产生毒害作用,影响水生动物的生存[8]。同人类及其他哺乳动物一样,水生动物的肠道中存在着数量庞大且结构复杂的微生物群体,这些微小生物会对宿主的生长发育、营养代谢和免疫应答等各方面发挥独特的作用[9-10]。
近年来,国内外学者利用16S高通量测序[11]、克隆文库和实时荧光定量PCR[12]、高通量测序[15]等技术对不同生存条件[12]、不同地理位置和性别[19]等条件下多种蟹肠道和生存环境[15]中的菌群进行了研究。结果表明,在不同生存条件下蟹体内的微生物是有差异的[11-15]。本研究采用高通量测序技术,可以克服大多数微生物不可培育的技术难题,全面地解析微生物菌群结构信息[16]。通过研究在暴发以拉氏拟柱胞藻(Cylindrospermopsis raciborskii)和浮丝藻(Planktothrixsp.)为主的蓝藻水华池塘中的中华绒螯蟹鳃与肠道及其养殖环境中池水、水草和底泥的菌群结构,以期为评价蓝藻水华对中华绒螯蟹微生态健康的影响提供参考。
1 材料与方法
1.1 样品采集
2018年9月对上海崇明东滩某一水产养殖专业合作社发生蓝藻水华的中华绒螯蟹池塘进行采样,同时采集相邻的未发生蓝藻水华池塘的样本作为对照。蓝藻池和对照池池塘面积均为10 000 m2,池水水深1.0~1.4 m,蟹种、水源、饲料和养殖管理技术等均一致。蓝藻池池水水温(25.8±0.1)℃、溶解氧(4.05±0.22)mg·L-1、总氮(1.96±0.13)mg·L-1、总磷(0.45±0.03)mg·L-1、亚硝基氮(NO-2-N)(0.011±0.003)mg·L-1、pH 8.8,对照池池水水温(25.9±0.1)℃、溶解氧(4.12±0.31)mg·L-1、总氮(1.72±0.15)mg·L-1、总磷(0.43±0.03)mg·L-1、亚硝基氮(0.007±0.003)mg·L-1、pH 8.7。采集蓝藻水华池和对照池的池水、伊乐藻(Elodeanuttallii)、底泥和中华绒螯蟹的鳃和肠道。每种样品4个重复(中华绒螯蟹的肠道和鳃取自4只雄蟹和4只母蟹),水样为上、中、下3层水混合。将采集的池水、底泥、伊乐藻和中华绒螯蟹保存于4~8℃低温样品箱,带回实验室处理。
1.2 样品前处理
1.2.1 浮游植物定性和定量分析的样品处理
采集的池水在现场采用鲁哥氏溶液(鲁哥氏溶液为1∶2比例的碘和碘化钾水溶液)固定,1 L水样添加15 mL鲁哥氏溶液;静置沉淀,以虹吸法吸去上清液,浓缩成50 mL后,再加1 mL甲醛溶液。
1.2.2 微生物多样性分析的样品处理
称取底泥2.00 g、剪碎的伊乐藻2.00 g分别置于5 mL无菌EP管中;取100 mL水样,使用抽滤装置(0.22μm水系滤膜,紫外消毒15 min)过滤水样,将滤膜放入5 mL无菌EP管中,将所有样品保存于-80℃冰箱备用。
取酒精棉球擦拭中华绒螯蟹体表,打开头胸甲取两侧的第3片鳃于无菌EP管中;取出肠道,去除肠道内容物,放入无菌EP管中,保存于-80℃冰箱备用。
1.3 浮游植物定性和定量分析
浮游植物种类鉴定主要参照《中国淡水生物图谱》[17]和《淡水微型生物》[18];定量计数时,取摇匀样品0.1 mL,置血球计数板内全片计数,每个水样计数2片取其平均值,若2片计数结果之差大于15%,则取第3片计数,取3片的平均值。
1.4 微生物多样性分析
1.4.1 基因组DNA提取、PCR扩增及测序
池水、底泥、伊乐藻、中华绒螯蟹肠道和鳃分别采用PowerWaterⓇDNA提取试剂盒(MoBio,美国)、土壤DNA提取试剂盒(MP Biomedicals,美国)、植物基因组DNA提取试剂盒(TIANGEN,中国)、DNA提取试剂盒(Omega,美国)。DNA提取后用1%琼脂糖凝胶电泳检测DNA样品质量。将检测合格后的样品交送上海美吉生物医药科技有限公司采用Illumina PE300测序平台进行细菌V3+V4区高通量测序。
1.4.2 数据分析
根据PE reads之间的overlap关系将成对的reads进行拼接。与此同时,对reads的质量和拼接效果进行质量控制。采用RDP classifier贝叶斯算法对OTU进行分类学分析,并在合适的分类水平进行分析,通常情况下,细菌数据库匹配采用Silva数据库。
对注释过的信息进行Alpha多样性分析、物种组成分析、NMDS分析(将样本中包含的物种信息以点的形式反映在多维空间上)和样本层级聚类分析(使用UPGMA算法构建树状结构,可呈现不同样本的差异)等,具体方法参照王元等[19]以及肖汉玉等[20]研究。
2 结果与分析
2.1 蓝藻水华池塘和对照池浮游植物种类与生物量
表1 为蓝藻池与对照池浮游植物种类组成、丰度和生物量。蓝藻池浮游植物有21种,其总丰度为(9.18±0.94)×108个·L-1,生物量为(103.944±11.367)mg·L-1,而对照池浮游植物仅有12种,丰度为(1.22±0.60)×106个·L-1,生物量仅为(0.545±0.056)mg·L-1。蓝藻水华池塘的浮游植物生物量是正常池的190倍。蓝藻水华池塘以蓝藻门的浮丝藻和拉氏拟柱胞藻为优势种,其生物量分别为55.879 mg·L-1和39.544 mg·L-1,两者生物量之和占总生物量的91.8%。对照池塘的优势藻为隐藻门的卵形隐藻(Cryptomonasovata)和啮蚀隐藻(Cryptomonaserosa),其生物量分别为0.273 mg·L-1和0.126 mg·L-1。
2.2 高通量测序结果
2.2.1 Alpha多样性分析
根据barcode和引物提取有效的序列,进行去杂和修建,得到Trimmed序列。对其进行统计分析发现,一共得到3 396 275个序列,落在401~500 bp长度上的序列有3 393 885条(99.9%),表明测序片段大小正常。经过物种注释与分类,样品中的微生物涉及到52个门、106个纲、205个目、373个科、674个属、1 163个种、2 302个OTU(相似性大于97%的序列归为一个OTU)(表2)。
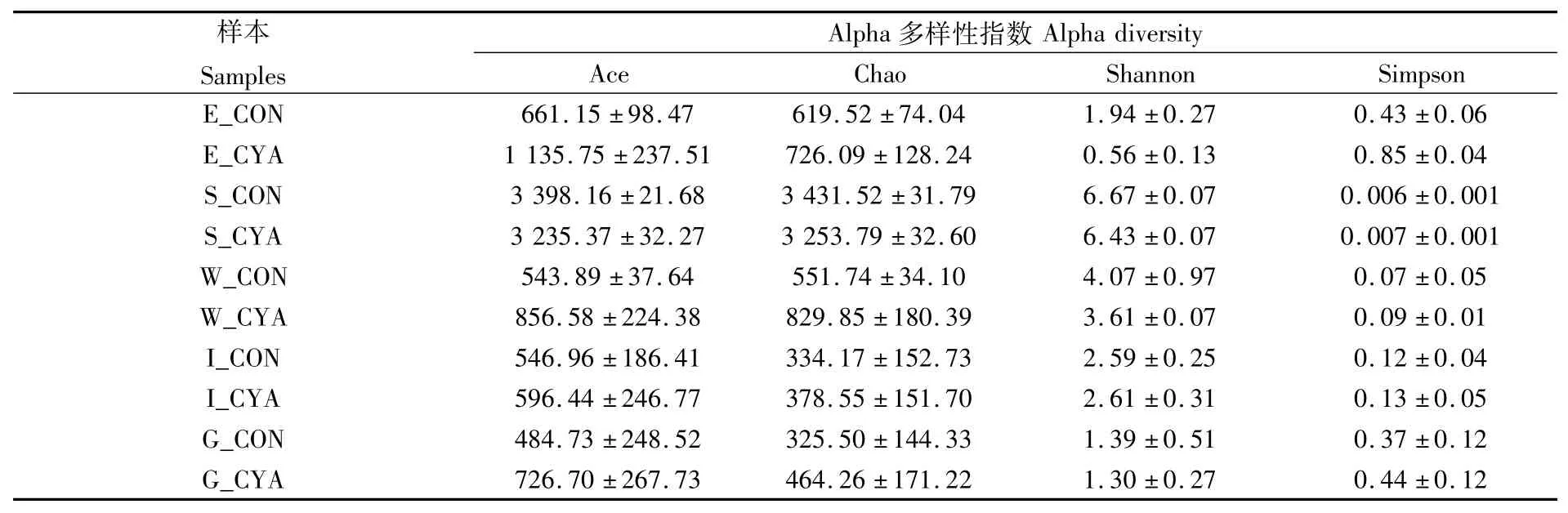
表2 Alpha多样性分析Tab.2 Alpha diversity analysis
结合Shannon指数和Simpson分析微生物多样性。环境样品微生物多样性由高到低分别为底泥、池水和伊乐藻。池水和底泥中的微生物多样性对照池高于蓝藻池,水草的微生物多样性蓝藻池较对照池低。肠道和鳃的微生物多样性低于池水和底泥,肠道的微生物多样性高于鳃。
结合Ace和Chao指数分析物种丰富度。肠道和鳃的群落丰富度总体上低于环境样品(底泥、池水和伊乐藻)。底泥微生物最丰富,其次是伊乐藻和池水。水草和池水的群落丰富度蓝藻池高于对应的对照池中的样本,而底泥的群落丰富度蓝藻池低于对照池。
2.2.2 菌群结构分析
2.2.2.1 门水平的优势菌群分布特征
如图1所示,基于门水平下的菌群分类,蓝藻池和对照池的池水、底泥、伊乐藻中的细菌物种组成差异较大,分别呈现了不同的优势菌群分布特征。但相同的是,都从中发现了变形菌门(Proteobacteria)的生物。并且,未发生蓝藻水华的对照池的样本中也检测到了一定量的蓝细菌门生物。蓝藻池水中优势菌群为蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)、变形菌门和疣微菌门(Verrucomicrobia),相对丰度分别为38.29%、27.38%、12.98%和7.05%;对照池水的优势菌群为变形菌门、放线菌门和拟杆菌门(Bacteroidetes),相对丰度分别为52.17%、21.88%和13.24%。底泥的优势菌群一致,蓝藻池和对照池均为变形菌门、绿弯菌门(Chloroflexi)以及拟杆菌门,只是在相对丰度上有少量差别。水草中微生物多样性很低,绝大部分为蓝细菌门,蓝藻池蓝细菌门相对丰度在90%以上;对照池在80%以上;除蓝细菌门的生物,水草中其余菌群为变形杆菌门,蓝藻池中还含有疣微菌门的菌群。

图1 门水平上的细菌种群结构与丰度(n=4)Fig.1 Microbial community structure and relative abundance at phylum level(n=4)
蓝藻池和对照池中华绒螯蟹鳃中均以放线菌门、拟杆菌门和变形菌门为优势菌,但在物种相对丰度上存在差异;中华绒螯蟹肠道均以拟杆菌门、柔膜菌门(Tenericutes)、变形菌门、厚壁菌门(Firmicutes)为优势菌。在中华绒螯蟹肠道样本中,蓝藻池中优势物种同对照池相比,变形杆菌门生物的相对丰度增多,相应的柔膜菌门生物的含量减少,厚壁菌门的生物替代拟杆菌门的微生物定植中华绒螯蟹的肠道中。另外,蓝藻池蟹鳃和肠道的样品中都出现了一定丰度的Saccharibacteria门的生物。
2.2.2.2 属水平的优势菌群分布特征
基于属水平(图2)分析各样品的优势菌群分布特征,结果显示,池水、伊乐藻和底泥中的细菌种类均很丰富,尤其是底泥。
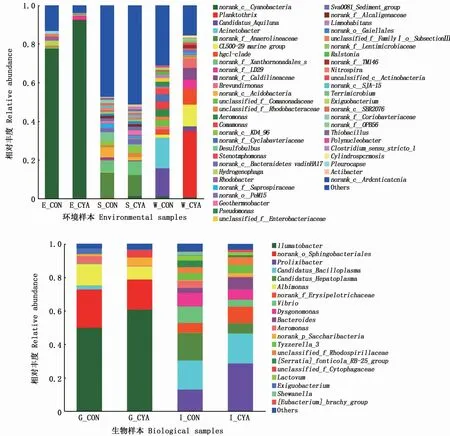
图2 属水平上的细菌种群结构与丰度(n=4)Fig.2 Microbial community structure and relative abundance at genus level(n=4)
蓝藻池和对照池池水中优势菌群结构相差较大,蓝藻池池水的优势菌群为浮丝藻属(Planktothrix)、CL500-29_marine_group属和hgcI_clade属,相对丰度分别为34.52%、11.28%和7.05%;对照池水中的优势菌群为不动杆菌属(Acinetobacter)、Candidatus_Aquiluna属和hgcI_clade属,相对丰度分别为15.59%、14.67%和2.30%。池塘底泥细菌种类丰富,蓝藻池底泥优势菌群结构与对照池的差别体现在相对丰度上。对照池和蓝藻池的底泥中优势属为norank_f_Anaerolineaceae属和norank_f_Xanthomonadales_Incertae_Sedis属。对照池和蓝藻池中伊乐藻的优势菌群为norank_c_Cyanobacteria属,蓝藻池中该菌属的相对丰度高达92.42%。
对照池蟹肠道中优势物种为Candidatus_Bacilloplasma属、Candidatus_Hepatoplasma属和Prolixiibacter属,相对丰度分别为17.38%、16.60%和12.95%。蓝藻池中华绒螯蟹肠道中优势物种为Prolixiibacter属,相对丰度为28.59%,大 约 是 对 照 池 的2倍。其 次 是Candidatus_Bacilloplasma属 和norank_f_Erysipelotrichaceae属,相对丰度分别为17.84%、9.86%。在中华绒螯蟹肠道中还发现了一定丰度的气单胞菌(Aeromonas)和弧菌(Vibrio)。
对照池中华绒螯蟹鳃中优势物种为Ilumatobacter属,相对丰度为49.89%,其在蓝藻池含量更高,为61.90%;而后是norank_o_Sphingobacteriales属和Albimonas属,相对丰度分别为22.90%和12.75%,蓝藻池中norank_o_Sphingobacteriales属和Albimonas属的相对丰度相应都低了5%,分别为17.99%和7.82%。
2.2.3 NMDS分析
图3 是蓝藻池和对照池中池水、底泥、伊乐藻以及人工养殖的中华绒螯蟹的肠道和鳃样品细菌群落多样性的NMDS分析。NMDS分析是根据样本中包含的物种信息,以点的形式反映在多维空间上,不同样本间的差异程度是通过点与点间的距离体现的。结果显示,环境样品(池水、底泥和伊乐藻)中,两个池塘中底泥样品间的距离最短,即菌落组成最相近,其次是伊乐藻,而池塘水样相差最大。蓝藻池和对照池的同一类环境样品未见重合,而两个池塘中养殖中华绒螯蟹的肠道和鳃样品有交集,其中肠道样品重合程度较鳃样品高,这表明中华绒螯蟹肠道的菌群结构较为稳定。另外,对照池和蓝藻池中鳃样品距离各自生活的池水更近,菌群组成更接近。

图3 不同样品中细菌群落多样性的NMDS分析Fig.3 NMDS analysis of bacterial community diversity
2.2.4 样本层级聚类分析
如图4所示,运用UPGMA对样本层级聚类分析。不同种类样品大致可以各自聚成一个分支。环境样品,例如伊乐藻、底泥和对照池池水,依据采样环境和样品种类呈现不同的分组。其中,蓝藻池中池水跟伊乐藻比较相近,可能是由于蓝藻池的水中富含大量蓝藻门的生物。对照池池水则和中华绒螯蟹的鳃样品的物种组成距离更近,甚至对照池的部分鳃样品(G4_CON和G6_CON)与对照池池水在同一簇内。池塘底泥与中华绒螯蟹鳃也在同一簇内,但处在不同分支下。不同池塘的肠道样品和鳃样品各自未呈现很好的聚类,对照池的分支内会出现一些蓝藻池的样品。其中肠道样品与环境样品不在一个簇内,自成一个分支。而池塘底泥的分支与中华绒螯蟹鳃的分支在一个簇内,部分池水样品与鳃样品被划到一个分支内。

图4 各样本的层级聚类分析Fig.4 Hierarchical clustering of samples
3 讨论
本次实验中引起蓝藻水华的是以蓝藻门拉氏拟柱胞藻和浮丝藻为主的藻类,两者生物量占总生物量的91.8%。蓝藻池蓝藻门的浮丝藻生物量最高,其次是拉氏拟柱胞藻,大约是浮丝藻的0.7倍。这与常孟阳等[21]报道的蓝藻暴发优势种为微囊藻的结果不同,可能是由于采样地点不同导致的结果差异。同微囊藻一样,拉氏拟柱胞藻也具备产生多种毒素的能力,并且该藻有较宽的温度适应能力,在11℃的低温和35~39℃的高温下,均长势良好[23-25]。有报道称拟柱胞藻已在中国广东、云南、湖北、福建及台湾等多个省份被发现[26-28]。在未来,拟柱胞藻可能会成为蓝藻水华的重要来源。
蓝藻水华对池塘微生物结构产生了一定影响。综合门水平和属水平注释的物种信息分析,蓝藻暴发极大地改变了水环境的微生物结构,特别在属水平上,这种差异尤其明显。并且在所有蓝藻组的环境样品中都检测到了一定量的蓝细菌门物种,且含量都比对照组的样品高。这印证了蓝藻水华会改变养殖池塘微生物组成这一论点。
相较于环境样品,蓝藻水华对养殖的中华绒螯蟹体内微生物的影响较小。其对中华绒螯蟹肠道中的微生物菌群有一定的影响,但基本不改变结构,只是改变各物种的占比。在金贝[31]的报道中,阳澄西湖的中华绒螯蟹肠道优势菌群为柔膜菌门、变形菌门、拟杆菌门、CK-IC4-I9和厚壁菌门,与本研究结果相似的是中华绒螯蟹肠道中的优势物种都出现了柔膜菌门、变形菌门和拟杆菌门。根据LI等[12]的研究,中华绒螯蟹中肠道优势菌群主要是变形菌门、拟杆菌门、放线菌门和疣微菌门。在狄盼盼等[32]的研究中,中华绒螯蟹肠道优势菌群为变形菌门、厚壁菌门、拟杆菌门等。基于门水平的物种注释分析,本研究中中华绒螯蟹肠道优势菌群特征与上述两文研究结果大致相似,不同之处可能是由于采样地点、时间不同以及研究方法的不同导致。在马文元等[34]研究中,中华绒螯蟹肠道优势细菌共计6种,属于4个菌属,分别为柠檬酸杆菌属(Citrobacter)、假单胞菌属(Pseudomonas)、气单胞菌属和摩根菌属(Morganella),本文结果与其不同,其原因可能是上述文章的中华绒螯蟹被投喂了虾青素,且运用的是传统分离培养的方法,而本文采用高通量测序的方法研究中华绒螯蟹肠道优势细菌组成。
另外,在中华绒螯蟹肠道中还发现了一定量的气单胞菌和Tyzzerella3,这和冯光志[33]在小龙虾肠道中发现的结果相似。此次实验在中华绒螯蟹的肠道中发现了一定量的弧菌和气单胞菌,但鳃中却几乎没有。
中华绒螯蟹鳃中的微生物结构与环境微生物有紧密的联系。本实验得到的中华绒螯蟹鳃中的优势物种为放线菌门、拟杆菌门和变形杆菌门,其中放线杆菌门和拟杆菌门也是蓝藻池和对照池中池水和底泥样品中的优势物种。本实验和马文元等[34]研究的中华绒螯蟹鳃中优势物种为变形菌门和厚壁菌门的结果不同,可能是因为其用传统的分离培养方法进行研究,而本文中中华绒螯蟹鳃中的优势物种也是其生存池水中的优势物种。
水生生物经历孵化后,在不同的发育阶段,外界的微生物会经历一段演替和适应的过程,部分或全部定植在生物体内[29-30]。所以不同的外界微生物会影响水生物体内的微生物结构。综上所述,环境的不同会改变中华绒螯蟹肠道和鳃的微生物结构。
结合NMDS结果看,中华绒螯蟹肠道的菌群组成较为稳定,鳃中的微生物结构与生活的池水的关系更近。相比于肠道,鳃中菌群结构差异更大,层级聚类分析结果也从侧面反映了这一点。中华绒螯蟹的鳃会接触外界环境,大量的水流入鳃室,入水孔周围列生着的许多刚毛虽然会阻挡一些外来物,颚足也会清理污杂物,但不能阻止微生物在鳃中定植[34]。中华绒螯蟹摄食过程中摄入了水,水中的细菌进入肠道定植下来,同时其部分的消化功能要依靠肠道微生物来完成,中华绒螯蟹肠道内有自身的微生物群落[34-36],对于外来微生物的入侵可能有一定的防御力,入侵后体内的微生物群落可能形成了缓冲,所以环境中微生物对肠道的影响相较于对鳃的影响要小。

