可控式集装箱养殖模式对乌鳢营养组成、组织形态及肠道菌群的影响
王雅丽,王语同,孙 晶,卢运超,陈天楠,王于众,舒 锐,吴丛迪,胡 鲲
(1.上海海洋大学,国家水生动物病原库,上海 201306;2.上海海洋大学,水产科学国家级实验教学示范中心,上海 201306;3.农业农村部淡水水产种质资源重点实验室,上海 201306;4.广州观星农业科技有限公司,广州 510006)
可控集装箱循环水养殖系统(以下简称“集装箱养殖”)由1个养殖集装箱体和3个生态处理塘组成。养殖排出水在生态塘中经过过滤、沉淀、增氧、净化、杀菌等过程后,再重新抽入箱体用于养殖,从而实现生态循环水养殖[1]。与传统土塘养殖模式相比,集装箱养殖可节约用水95%以上,节省土地75%以上,养殖全程实现自动化控制和精细化管理,具有节约资源、绿色生态、智能高效等优势[2]。集装箱养殖模式改变了传统养殖过程中的一系列缺陷,为中国水产养殖业绿色发展、转型升级注入新力量。
水产品的肉质、口感及营养价值是决定其市场价值的重要因素,而不同养殖模式对水产品的生长、肌肉品质和营养成分等影响显著[3-4]。李俊伟等[5]比较了室内循环水养殖和池塘养殖两种养殖模式下四指马鲅(Eleutheronema tetradactylum)的品质,认为池塘养殖环境下的鱼体变异系数较大,有利于良种选育,而室内循环水养殖则规格较均匀,有利于生产。刘克明等[6]对循环水养殖、池塘养殖和全流水养殖3种模式下北极红点鲑(Salvelinusleucomaenis)的肌肉品质进行了分析,认为3种养殖模式下肌肉营养成分组成差异显著,全流水养殖的北极红点鲑肌肉蛋白质和氨基酸含量最高,而循环水养殖北极红点鲑的脂肪酸含量尤其是二十碳五烯酸(eicosapentaenoic acid,EPA)+二十二碳六烯酸(docosahexaenoic acid,DHA)含量最高;周彬等[7]对循环流水槽养殖与池塘精养草鱼(Ctenopharyngodonidellus)的营养品质进行了对比,发现两者肌肉中脂肪酸和部分微量元素含量存在显著差异;高露姣等[8]研究发现,经过越冬养殖和海上网箱养殖的红鳍东方鲀(Takifugu rubripes)肌肉品质显著好于土池养殖的个体。综上所述,目前对于工厂化养殖模式下水产品的品质研究较多,但对可控式集装箱养殖模式下水产品的品质研究尚较少见。
乌鳢(Channaargus)是中国特有的淡水养殖品种之一,因其骨刺少、肉质鲜美、蛋白质含量高、脂肪含量低,且具有生肌补血、促进伤口愈合等功效,深受消费者喜爱[8-9]。
本研究以传统池塘养殖模式作为对照,比较了其与可控式集装箱养殖模式下乌鳢的肌肉营养价值、组织形态及肠道菌群多样性差异,以期对可控式集装箱养殖模式做出综合评价,为相关研究提供基础数据,并为传统养殖向新型养殖技术转型提供参考。
1 材料与方法
1.1 实验材料及养殖处理
供试乌鳢幼鱼购自广东海洋与水产高科技园,乌鳢鱼苗规格:体质量50 g,体长5~7 cm,于广东肇庆市鼎湖区沙浦镇观星农业数字化水产养殖示范基地(集装箱养殖,JW)和广东肇庆市鼎湖区沙浦镇乌鳢养殖塘(传统池塘养殖,TW)开展不同养殖模式实验研究。同批鱼苗分为2组,每组3个重复,2018年7月18日投放到3个规格为(6.1 m长×2.4 m宽×2.8 m高)集装箱和3个面积为1 800 m2、2 000 m2、2 000 m2,水深2.5 m的传统池塘中。养殖密度均为6 kg·m-3,养殖水温为25.5~29.5℃,溶解氧>5 mg·L-1。集装箱固定在池塘水源附近,养殖时抽取生态池塘中上层富氧水,经适当浓度的臭氧杀菌后让其流入集装箱内,进行流水养殖。养殖排出的尾水经过固液分离后导入三级生态池塘,经过生态净化和臭氧消毒后再抽回集装箱内进行循环利用;传统池塘水源为附近河水,进水前经筛网过滤。
每天向两种模式下的乌鳢投喂2次(9∶00、16∶00)同种膨化颗粒饲料(豆粕、鱼粉、鱼油、植物油等,粗蛋白质50.15%、粗脂肪13.27%、灰分12.99%,广州恒兴饲料),最初日投喂量约占鱼总体质量的3%,养殖过程中按照鱼体规格及前1 d的摄食量做适当调整,以投料后1 h内吃完为适宜。次年10月11日结束养殖,准备进行实验处理。
1.2 样品采集及取样
养殖乌鳢于实验开始前饥饿处理24 h,从2个养殖模式随机选取活力较好、大小均一的乌鳢个体,每个重复取2尾,每组6尾,共12尾,样本活体运回实验室。2组乌鳢在冰面上进行解剖,取长宽约1 cm左右的背部肌肉组织,用无菌水冲洗3遍后放入Bouin’s固定液(上海兰拓生物有限公司)中保存待用;取背部两侧肌肉组织在冰浴条件下用FW100组织捣碎机(天津市泰斯特仪器有限公司)搅拌混合成鱼糜,取10 g经真空冷冻干燥后置于-20℃冰箱中保存用于氨基酸、脂肪酸和微量元素的测定;从每个集装箱和池塘中随机挑选1尾乌鳢,每组3尾,共6尾,在无菌条件下取出肠道组织,将肠道组织内容物挤出并收集到2 mL无菌冻存管中,液氮预冷30 min后,-80℃保存,用于肠道菌群组成的测定;取前肠部分用无菌水冲洗3遍后放入Bouin’s固定液中保存待用。
1.3 肌肉常规成分检测
氨基酸含量的测定参照GB/T5009.124-2016进行。脂肪酸含量的测定参照GB5009.168-2016进行。微量元素(铅Pb、砷As、镉Cd、铜Cu、汞Hg、铬Cr、硒Se和锌Zn)的测定分别参照GB5009.12-2017、GB5009.11-2014、GB5009.15-2014、GB5009.13-2017、GB009.17-2014、GB5009.123-2014、GB12399-1996和GB5009.14-2017进行。
1.4 组织切片
将肌肉组织和肠道组织取出,分别经过浓度为70%、80%、90%、95%和100%的梯度乙醇脱水,并置于二甲苯(上海兰拓生物有限公司)中透明,最后包埋于低熔点石蜡中使用Lecia-RM2235型切片机(上海隆合实业有限公司)切片机横向连续切片,厚度为7μm,而后展片于清洁的载片上,采用苏木精-伊红(HE)染色,中性树胶封片。使用OlympusBX51(上海普赫光电科技有限公司)显微镜进行组织形态观察,用Image-pro plus 6.0(Media Cybernetics,Inc.,Rockville,MD,USA)图像处理软件进行比例尺和符号的添加。
1.5 肠道菌群的测定
1.5.1 DNA抽提和PCR扩增
微生物群落总DNA的提取参照E.Z.N.A.Ⓡsoil DNA kit(Omega Bio-tek,Norcross,GA,U.S.)的说明书方法进行,使用1%琼脂糖凝胶电泳检测DNA的提取质量,用NanoDrop2000分光光度计(美国)鉴定DNA浓度和纯度;对16S rRNA基因的V3~V4可变区进行PCR扩增,扩增引物为:338F:5′-ACTCCTACGGGAGCAGCAG-3′和806R:5′-GGACTACHVGGGTWCTAAT-3′。PCR总反应体系为:DNA聚合酶0.4μL,模板10 ng,5μmol·L-1上游引物0.8μL,5μmol·L-1下游引物0.8μL,5×TransStart Fast Pfu缓冲液4 μL,2.5 mmol·L-1dNTPs 2μL,加灭菌水补足至20μL。PCR扩增条件为:95℃预变性3 min,95℃变性30 s,55℃退火30 s,72℃延伸30 s,进行27个循环,之后72℃稳定延伸10 min。扩增产物置于4℃保存。
1.5.2 Illumina Miseq测序
用2%琼脂糖凝胶回收PCR产物,用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)对回收产物进行纯化,用2%琼脂糖凝胶电泳对纯化产物进行检测,使用QuantusTMFluorometer(Promega,USA)对回收产物进行定量测试。用NEXTFLEX Rapid DNA-Seq Kit进行建库:1)接头链接;2)用磁珠自连片段对接头进行筛选并去除;3)PCR扩增对文库模板进行富集;4)用磁珠回收PCR产物并构建文库。样品送至上海美吉生物医药科技有限公司进行测序。
1.6 数据处理与分析
实验结果以平均值±标准差(mean±SD)表示。用Excel 2010对原始数据进行整理,并用SPSS 21软件进行独立样本t检验,分析两组间测量参数的差异显著性,设置0.05为显著性水平。用Trimmomatic软件对原始测序序列进行质控,用Flash软件对去杂后的双端数据进行拼接。用UPARSE软件(version 7.1)按照97%的相似度标准对序列进行OTU聚类并剔除嵌合体。用RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,最后比对Silva数据库(SSU128),设置比对阈值为70%,对得到的菌群进行比对鉴定。
2 结果与分析
2.1 两种养殖方式乌鳢肌肉营养成分对比
2.1.1 氨基酸组成和含量对比
两种养殖模式的乌鳢肌肉氨基酸组成及含量检测结果如表1所示。结果显示,18种常见氨基酸中,未检测到色氨酸和半胱氨酸,检测到7种必需氨基酸(EAA)、2种半必需氨基酸(HEAA)及7种非必需氨基酸(NEAA)。TW组总必需氨基酸含量(∑EAA)显著高于JW组(P<0.05),总氨基酸含量(∑TAA)、总半必需氨基酸含量(∑HEAA)、总非必需氨基酸含量(∑NEAA)两组之间无显著差异(P>0.05)。JW组中单个氨基酸谷氨酸(Glu)、脯氨酸(Pro)和甘氨酸(Gly)均显著高于TW组(P<0.05);甲硫氨酸(Met)、赖氨酸(Lys)和天冬氨酸(Asp)显著低于TW组(P<0.05)。JW组总鲜味氨基酸(∑DAA)含量显著高于TW组(P<0.05),其中天冬氨酸(Asp)、谷氨酸(Glu)和甘氨酸(Gly)含量存在显著性差异(P<0.05),丙氨酸(Ala)含量无显著差异(P>0.05),说明JW组乌鳢更具鲜甜风味。TW、JW养殖模式的∑EAA/∑TAA和∑EAA/∑NEAA比值分别为41.59%、39.16%和84.59%、76.24%。
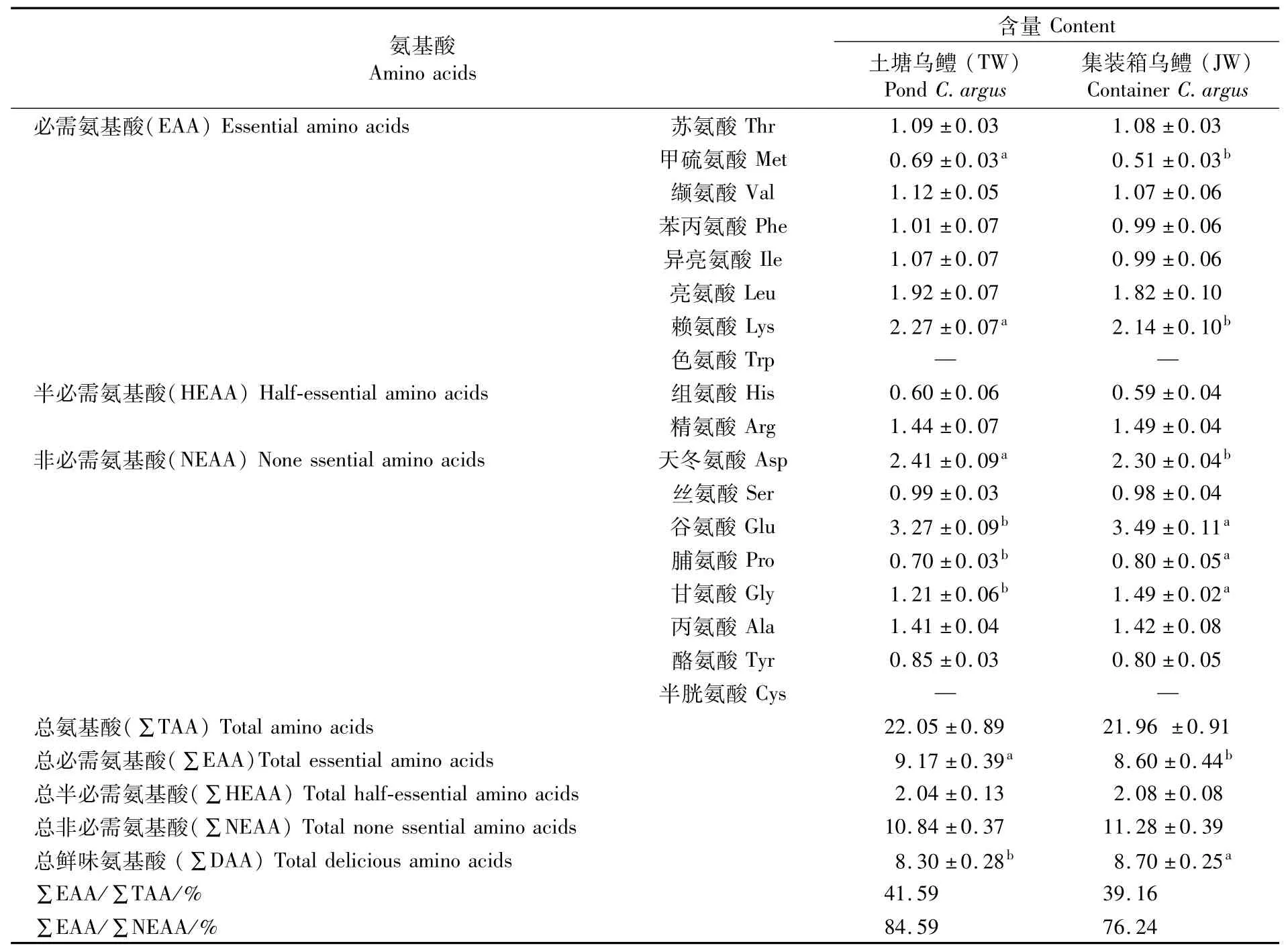
表1 两种养殖模式的乌鳢肌肉氨基酸组成及含量比较Tab.1 Comparison of amino acid composition and content in muscle of C.argus under two cultivation modes
2.1.2 脂肪酸组成和含量比较
两种养殖模式的乌鳢肌肉脂肪酸含量及组成如表2所示。结果显示:TW组乌鳢肌肉中检测到脂肪酸10种,包括3种饱和脂肪酸、3种单不饱和脂肪酸和4种多不饱和脂肪酸;JW组乌鳢肌肉中检测到脂肪酸11种,包括3种饱和脂肪酸、3种单不饱和脂肪酸和5种多不饱和脂肪酸。比较两组鱼的总饱和脂肪酸(∑SFA)、总单不饱和脂肪酸(∑MUFA)和总多不饱和脂肪酸(∑PUFA),发现∑SFA含量和∑MUFA含量无显著差异(P>0.05),∑PUFA含量TW组显著高于JW组(P<0.05)。TW组中只检测到二十二碳六烯酸(DHA),未检测到二十碳五烯酸(EPA);JW组中EPA和DHA均被检出,且JW组DHA显著高于TW组(P<0.05)。
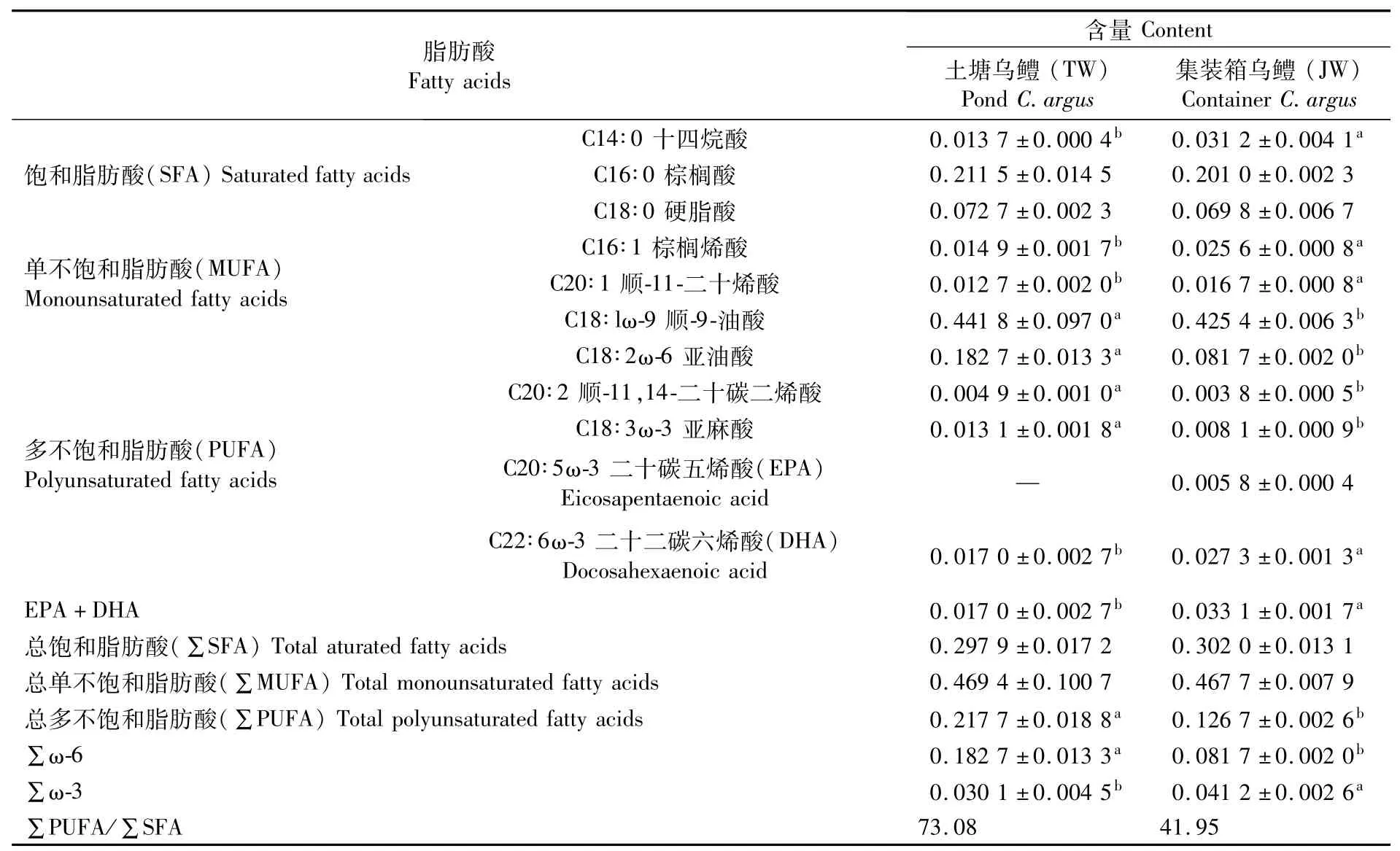
表2 两种养殖模式的乌鳢肌肉中脂肪酸组成与含量比较Tab.2 Comparison of fatty acid composition and content in muscle of C.argus under two cultivation modes
2.1.3 微量元素组成和含量比较
两种养殖模式的乌鳢肌肉中微量元素含量检测结果如表3所示。结果显示:5种有害金属(As、Cr、Cd、Hg、Pb)在TW组乌鳢肌肉组织中检出4种(As、Cr、Cd、Hg),在JW组鳢肌肉组织中检出5种(As、Cr、Cd、Hg、Pb)。根据食品安全国家标准(GB2762-2017),两种养殖模式下5种有害金属平均含量均低于标准限值,可以安全食用。3种微量元素(Cu、Se、Zn)在两组乌鳢肌肉中均被检出,其中JW组Se的含量显著高于TW组(P<0.05),Cu和Zn的含量在两组中差异不显著(P>0.05),但两组中Zn的含量均高于其他元素。
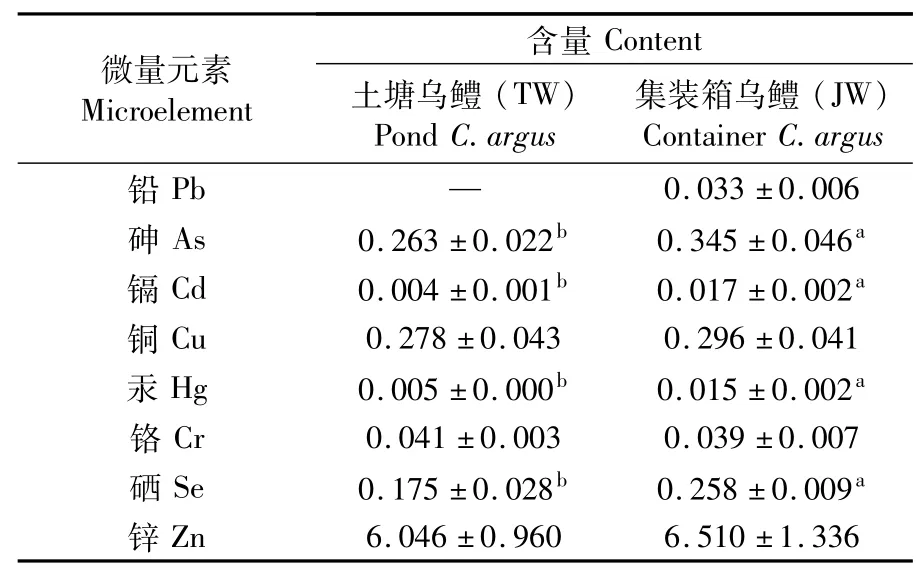
表3 两种养殖模式的乌鳢肌肉中微量元素组成与含量比较Tab.3 Comparison of micro elemnets in muscle of C.argus under two cultivation modes
2.2 肌肉与肠道的微观组织结构分析
两种养殖模式的乌鳢肌肉组织形态的比较见图1-a,b。两种模式乌鳢肌肉的肌纤维纹理清晰为不规则的多边形,基本结构无差异,肌浆中含有丰富的肌原纤维。TW肌间脂肪多于JW。JW肌纤维横截面积和直径大于TW。JW肌纤维出现明显的弯曲现象,肌纤维之间有间隙,且间隙较大。
两种养殖模式的乌鳢肠道组织形态的比较见图1-c,d。两组乌鳢的肠道组织切片可以看出,肠道绒毛结构完整、清晰,上皮细胞排列整齐,细胞核大且都位于细胞基部,梳状缘排列整齐。TW的杯状细胞数量明显少于JW,其梳状缘排列更紧密,而JW的肠道皱壁厚度更厚,隐窝更深。

图1 两种模式养殖的乌鳢的肌肉、肠道组织结构Fig.1 Muscle and intestinal tissue structure of C.argus under two cultivation modes
2.3 肠道菌群
2.3.1 Illumina测序结果及α-多样性分析
高通量测序共获得299 568条序列,各样品获得的序列数介于44 098~56 432,平均每个样品有49 928条序列,覆盖率>99%,表明样本的OTU足够代表样本的多样性。JW组和TW组的OUT个数为1 071、1 131,共有OUT数728个(图2)。
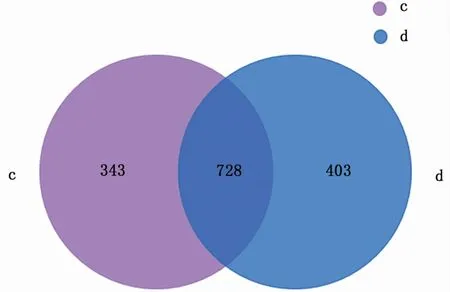
图2 JW组和TW组Venn图Fig.2 OTU Venn analysis of JW and TW
基于OTU计算样品的α-多样性(表4),采用Shannon指 数、ACE指 数、Chao1指 数 和Simpson多样性指数对肠道菌群进行α-多样性分析。其中JW组ACE指数、Chao1指数高于TW组,说明JW组乌鳢肠道中菌群总数最多。TW组OUT数和Shannon指数高于JW组,且Simpson多样性指数显著低于JW组(P<0.05),说明TW组乌鳢肠道中菌群多样性最好。

表4 两种模式养殖的乌鳢肠道微生物统计分析Tab.4 Statistical analysis of intestinal microbial diversity in C.argus under two cultivation modes
2.3.2 微生物物种组成差异
在科的分类水平上,分析两种养殖模式下乌鳢肠道微生物的组成差异。由图3和图4可见,消化链球菌科(Peptostreptococcaceae)、梭菌科(Clostridiaceae_1)在JW组乌鳢肠道中丰度最高,是JW组的优势菌群;微杆菌科(Microbacteriaceae)、梭杆菌科(Fusobacteriaceae)在TW组乌鳢肠道中丰度最高,是TW组的优势菌群。这4个科的微生物在两种模式养殖的乌鳢种均被检测出,但占比差异明显,表明不同养殖模式对乌鳢肠道中菌群的比例产生了巨大的影响。由图4可见,TW组整体颜色偏红,JW组整体颜色偏蓝,说明TW组的乌鳢肠道中菌群丰度高于JW组。TW组乌鳢肠道中微杆菌科、分枝杆 菌科(Mycobacteriaceae)、茎杆菌科(Caulobacteraceae)等科丰度明显高于JW组。

图3 两种养殖模式下乌鳢肠道微生物在科水平上的物种组成Fig.3 Species composition of intestinal microbial samples of C.argus at family level under two cultivation modes

图4 两种养殖模式下乌鳢肠道微生物样品的物种表达谱Fig.4 Heapmap of species expression of intestinal microbial samples of C.argus at family level under two cultivation modes
3 讨论
3.1 两种养殖模式对乌鳢肌肉营养成分的影响
氨基酸的组成及其含量是水产品蛋白质品质优劣的决定因素。在两组乌鳢肌肉中均检出16种常见氨基酸,氨基酸组成差别较小,且根据FAO/WHO的理想模式,质量较好的蛋白质,其组成氨基酸的∑EAA/∑TAA为40%左右,∑EAA/∑NEAA的比值在60%以上[10]。而两种模式的乌鳢肌肉氨基酸组成与比例均符合指标要求,其氨基酸具有良好的平衡性,属于优质的蛋白质源。谷氨酸在人体组织代谢过程中起解除氨毒害的作用[11],也是参与脑组织生化代谢和多种生理活性物质合成的重要氨基酸[12]。研究发现,两种模式下乌鳢肌肉中含量最高的氨基酸为谷氨酸(Glu),且JW组中谷氨酸(Glu)含量显著高于TW组(P<0.05),占JW组 氨 基 酸 总 量 的15.89%。鱼类肌肉鲜味程度取决于鲜味氨基酸的总量[13]。在4种呈鲜味氨基酸中,JW组总鲜味氨基酸(∑DAA)含量显著高于TW组(P<0.05),同时天冬氨酸(Asp)、谷氨酸(Glu)和甘氨酸(Gly)含量存在显著性差异(P<0.05)。甘氨酸(Gly)能产生甜味,天冬氨酸(Asp)和谷氨酸(Glu)能产生咸味和鲜味[14]。由此可以看出,集装箱模式的乌鳢的鲜美程度优于传统池塘模式且口感更加丰富。
食物的脂肪酸含量和组成是评价食物营养价值的重要指标,在TW组乌鳢肌肉中检测到10种脂肪酸,在JW组乌鳢肌肉中检测到11种脂肪酸。多不饱和脂肪酸是指含有2个或多个双肩的长链脂肪酸,具有独特生理功能,且不饱和程度越高,营养价值也越高[15],尤其是ω-3系列多不
饱和脂肪酸(∑ω-3 PUFA),是人体生命活动必不可少的[16-17]。根据结果分析发现,TW组总多不饱和脂肪酸(∑PUFA)含量显著高于JW组(P<0.05)。但从ω-3系列多不饱和脂肪酸上看,JW组有较高的二十碳五烯酸(EPA)和二十二碳六烯酸(DHA),而TW组中只检测到DHA,且JW组DHA显著高于TW组(P<0.05),此外JW组和TW组中EPA+DHA含量占脂肪酸总量的比例分别为:10.96%和5.71%。EPA和DHA是人体必需脂肪酸,在防治心脑血管疾病、抗癌、抗炎症、促进儿童大脑发育、治疗老年痴呆以及维持人体细胞功能和基因表达等方面有较好的功效[18]。因此对比之下,集装箱模式乌鳢具有更强的保健功能。∑PUFA与∑SFA的比值(>0.4)[19]以及∑ω-6与∑ω-3的比值(<4)[20-22]是衡量脂肪酸营养价值的重要指标,而JW和TW组的乌鳢肌肉的∑PUFA/∑SFA分别为73.08%和41.95%,∑ω-6/∑ω-3分别为6.07、1.98,因此集装箱模式的乌鳢肌肉的脂肪酸组成与比例更为均衡,营养价值更好。
两种养殖模式的乌鳢肌肉中检出的5种有害重金属As、Cd、Cr、Hg和Pb的平均含量均低于标准限值,符合国家食品安全标准,3种微量元素(Cu、Se、Zn)中,只有Se的含量存在差异(JW>TW,P<0.05)。Se含有丰富的人体细胞的活性因子,具有防癌、抗癌、抗氧化等功效[18],因此,集装箱模式养殖的乌鳢保健功能更好。在各微量元素之间,两组中Zn的含量均显著高于其他元素(P<0.05)。Zn对儿童的生长及智力发育起到至关重要的作用,同时有调节人体免疫功能的作用[23]。因此,两种模式养殖的乌鳢均可为人类提供丰富的Zn。
3.2 两种养殖模式对乌鳢组织形态的影响
徐家欢等[24]研究表明,每束肌纤维数量越多、肌纤维细,则肉质越细嫩,即肌纤维密度大、直径小可以使肌肉保持其营养、水分适中,从而有良好的适口性。肌肉内脂肪含量则直接影响肉质的风味和多汁性,随着肌肉内脂肪含量的增加,肉质的嫩度和口感相应会得到改善[25-26]。本研究中根据乌鳢肌肉切片结果发现,TW组乌鳢的肌纤维比JW组的更细,体现为密度大、直径小;TW组的肌间脂肪高于JW组。因此,传统池塘养殖模式的乌鳢肉质口感更好。肌纤维横截面积是描述肌肉组织形态结构的重要参数,营养状况和运动量对肌纤维横截面积的大小有重要影响[27-29]。本研究中JW组乌鳢肌肉的肌纤维横截面积更大,说明集装箱养殖模式的乌鳢运动量较大,而鱼体的生长与肌纤维横截面积成正比例关系[27-29],说明集装箱养殖模式的乌鳢生长更快。
肠道在水生动物的营养消化吸收过程中起重要作用,其组织结构是否完整对鱼类消化能力具有决定性作用[30]。肠道黏膜层的上皮由单层柱状上皮细胞构成,其中散布不少杯状细胞。杯状细胞能分泌消化酶,且分泌黏液,借以保护上皮细胞[31]。TW组乌鳢肠道的杯状细胞数量明显少于JW,说明集装箱养殖模式的乌鳢肠道对营养的吸收更好,且能更好的保护肠道健康。肠道隐窝是肠壁凹陷的结构,隐窝深度影响动物对营养物质吸收的能力,皱襞越高越宽越浓密,说明肠道吸收表面积越大,越有利于提高营养物质的吸收效率[32]。JW组乌鳢的肠道皱壁相比TW组更宽,隐窝更深,说明集装箱养殖模式的乌鳢肠道对营养的吸收效率更高。
3.3 两种养殖模式对乌鳢肠道菌群的影响
肠道有益菌属可通过改善宿主免疫调节功能、营养吸收能力和内环境调节能力来促进宿主生长[33],而有害菌属则会增加肠道黏膜层的通透性,从而导致细菌和其他大分子穿过黏膜屏障[34]。因此,建立良好的肠道微生态系统对于鱼类健康生长至关重要。
上述乌鳢肠道菌群多样性研究结果表明,两种模式下养殖的乌鳢肠道细菌优势菌群种类和数量方面差异显著,TW组乌鳢肠道内细菌的菌落种类多样性和OUT丰富度均高于JW组,而JW组乌鳢肠道中菌群总数最多。GHANBARI等[35]认为,鱼类肠道微生物的构成不仅与宿主特性密切相关,还与饮食、环境和生态因素(如水环境中的细菌)等有关,是多种因素共同作用的结果。本研究中,投喂饲料在整个实验过程中保持一致,因此水环境是导致两组肠道菌群差异的主要因素。梭菌科的普拉梭菌(Faecalibacterium prausnitzi)具有抗炎效应,可明显改善肠道炎症;消化链球菌科主要起促进肠道吸收养分的作用[36]。本研究发现,消化链球菌科、梭菌科是JW组乌鳢肠道中丰度最高的2个科。张植强等[37]研究表明,乌鳢的活动对底层水体的搅动作用较大,池塘沉积物中存在大量的微生物,水体搅动带动沉积物中大量微生物进入水体,而集装箱养殖模式由于使用循环水且会自动沉于箱体底部物质排出而水质更优。所以两种养殖模式水环境会有差异,推测可能是这种差异造成TW组和JW组乌鳢肠道菌群丰富度和多样性的差异。
4 小结
本研究表明,两种模式下养殖的乌鳢肌肉蛋白质含量丰富且脂肪含量相对适中,氨基酸种类齐全且平衡性好,必需氨基酸组成符合FAO/WHO的理想模式,说明本研究中的两种模式养殖的乌鳢是营养价值高的优质蛋白源。但集装箱模式的乌鳢的鲜美程度更高,脂肪酸组成和比例方面更好,且有较强的保健功能。集装箱模式养殖的乌鳢肌纤维横截面积更大,表明鱼体生长更快,肠道隐窝更深,表明肠道对营养的吸收效率更高。根据微生物多样性检测结果,集装箱模式养殖的乌鳢因为水质较好可能拥有更少的微生物,其中消化链球菌科、梭菌科是JW肠道菌落中的优势菌,具有改善肠道消化吸收、免疫等功能,能更好的适应集装箱养殖模式。综上所述,集装箱养殖的乌鳢与传统池塘养殖的乌鳢相比具有一定优势,但也存在一些不足,本研究结果可为进一步改善可控式集装箱养殖模式提供理论依据。

