跨膜蛋白173对TGF-β1活化的肝星状细胞增殖与凋亡的影响及机制研究
潘林鑫,李 玉,徐 涛,钱 成
(安徽医科大学 1.生命科学学院,2.药学院,3.科研实验中心,4.炎症免疫性疾病安徽省实验室,安徽 合肥 230032)
肝炎是一种常见的消化系统疾病,其种类繁多、病因复杂、发病率高,且随着病情的发展,肝脏细胞遭到持续地破坏,细胞外基质(extracellular matrix,ECM)成分过度异常地沉积,导致肝脏结构发生病理性改变,损害肝脏代谢功能,进一步发展成为肝纤维化,甚至肝癌,严重威胁着人类的生命健康[1-2]。肝星状细胞(hepatic stellate cell,HSC)是ECM的主要来源,其持续增殖与活化是肝脏炎性损伤和纤维化的关键环节[3-4],在肝细胞癌的发病机制中也扮演着重要角色[5]。TMEM173是一种存在于宿主细胞内质网膜上的跨膜蛋白,人源的TMEM173由379个氨基酸组成,其N端(1~137AA)为4次跨膜结构域,C端包含一个CTD结构域,可以结合胞质中细菌分泌的重要第二信使环二核苷酸(cyclic dinucleotides,CDNs),激活TBK1和IRF3抗病毒细胞信号通路,诱导抗感染的固有免疫反应[6-7]。有研究表明TMEM173与非酒精性脂肪肝和肝细胞癌的发生发展密切相关,且在HSC活化过程中扮演着重要角色[8-9],本研究通过构建pEGFP-C2-TMEM173表达载体和设计合成TMEM173-siRNA来调节TMEM173在活化LX-2细胞中的表达变化,旨在研究TMEM173对HSC活化过程中细胞增殖和凋亡的调控作用,为进一步探究其在肝炎和纤维化中的功能奠定基础,现报道如下。
1 材料与方法
1.1 载体、菌株和细胞pEGFP-C2载体、DH5α感受态菌株、LX-2细胞株由校实验中心实验室保存。
1.2 主要试剂引物合成自安徽通用生物有限公司;T4 DNA连接酶(B110041)购于生工生物公司;DMEM培养基(SH30081.01)购于澳洲HyClone公司;胎牛血清(FB25015)购于美国CLARK公司;Lipo8000脂质体(C0533)、细胞裂解液(P0013B)、PMSF蛋白酶抑制剂(ST506)、一抗稀释液(P0023A)、总RNA抽提试剂盒(R0028)购于上海碧云天公司;Evo M-MLV反转录试剂预混液(AG11706)、SYBR Green荧光定量PCR预混液(AG11701)购于中国AG生物公司;Opti-MEM转染液(31985070)购于美国Invitrogen公司;细胞凋亡试剂盒(559763)购于美国BD公司;PVDF膜购于美国Millipore公司;各抗体购于美国Proteintech公司。
1.3 主要仪器AL600RGB凝胶成像系统购自美国GE公司;Axio Observer 3倒置荧光显微镜购自德国卡尔蔡司公司、MoFlo XDP超速流式细胞分选仪购自美国Beckman公司;CytoFlex流式细胞分析仪购自美国Beckman公司。
1.4 质粒构建设计并合成引物序列:上游引物:5′-CCGGAATTCCGGATGCCCCACTCCAGCCT-3′;下游引物:5′-CGGGATCCCGTCAAGAGAAATCCGTGC-3′,以含人TMEM173全长cDNA序列的质粒为模板,PCR扩增出TMEM173的CDS序列,将产物进行琼脂糖凝胶电泳,并利用胶回收试剂盒进行回收,得到其PCR纯化产物,利用限制性内切酶EcoR I和BamH I对TMEM173的PCR纯化产物和pEGFP-C2空载体分别进行双酶切,用T4 DNA连接酶将二者的酶切产物进行连接,并将连接产物转化于DH5α感受态细胞中,37 ℃培养至单克隆生成,分别挑取数个单克隆进行扩大培养,并抽提菌液中的质粒进行双酶切鉴定(EcoR I和BamH I),选择鉴定正确的重组质粒送公司进行测序。
1.5 细胞培养复苏LX-2细胞,并用完全培养基(10% FBS+90% DMEM高糖+青链霉素)在5%CO2的恒温培养箱中进行培养,根据细胞状态及时更换完全培养基,待细胞密度达到90%以上时即可进行传代,并取适量细胞重新接种至新的培养瓶中,用于后续的转染实验。
1.6 转染本研究采用脂质体(Lipo8000)转染法,以十二孔板为例,步骤如下:先后将pEGFP-C2-TMEM173、TMEM173-siRNA及其对照(各1 μg)和Lipo8000(1.6 μL)加入到50 μL Opti-MEM转染液中,轻轻充分混匀后,将溶液加入待转染的LX-2细胞中,继续培养24-48 h,用于后续实验。
1.7 QPCR检测收集实验处理后的各组细胞,用TRIzol法提取细胞的总RNA,逆转录得到cDNA,设计并合成引物,引物序列见Tab 1。将cDNA模板、引物和SYBR®Green supermix核酸染料按一定比例加入反应体系中,并利用RT-PCR仪中进行扩增,并分析结果。

Tab 1 Primer sequence
1.8 Western blot转染约24 h后,收集LX-2细胞进行裂解(4 ℃),30 min后收集裂解液进行高速冷冻离心并收集上清液,蛋白定量后取出适量上清液,加入等量2× SDS上样缓冲液充分混匀后沸水浴5 min,冰浴后取适量蛋白样品先后进行 SDS-PAGE电泳(100 V,2 h)和恒流湿转(200 mA,1 h),取出PVDF膜室温封闭1 h,TBST溶液洗膜后加入一抗 (1 ∶500)进行孵育(4 ℃过夜),TBST洗膜后加入HRP标记的山羊抗兔IgG(1 ∶5 000)进行孵育(室温1 h),TBST溶液洗膜后用ECL化学发光液进行显色,在蛋白成像仪上进行显影和拍摄。
1.9 免疫荧光转染约24 h后,取出LX-2细胞爬片,用预冷的PBS清洗3次后进行细胞固定(-20 ℃预冷甲醇2 min+70%乙醇5 min),由于GFP能够自发绿色荧光,因此无需进行一抗和二抗孵育,固定后用PBS清洗3次后进行细胞核染色(0.15 g·L-1DAPI,2 min),弃DAPI溶液后用PBS清洗3次后,用荧光封片胶将盖玻片封于载玻片上,在荧光显微镜下进行观察。
1.10 MTT细胞增殖转染约24 h后弃去各组细胞的培养基,更换为无血清培养液,然后每孔加入20 μL的MTT (5 g·L-1),37 ℃继续孵育4 h后,弃上清并每孔加150 μL DMSO溶解细胞内结晶,室温振荡溶解10 min后于492 nm波长处测吸光度(A值)。
1.11 EdU细胞增殖转染约24 h后加入EdU工作液至终浓度为10 μmol·L-1,37 ℃继续孵育4 h后去除培养液,并加入4%的多聚甲醛室温固定15 min,洗涤液洗涤细胞3次后加入含0.3% Triton X-100的PBS进行室温透化15 min,洗涤液洗涤细胞3次后加入Click反应液室温避光孵育30 min,然后使用Hoechst 33342进行细胞核染色,并在荧光显微镜下进行观察。
1.12 细胞周期转染约24 h后,用不含EDTA的胰酶消化并收集实验处理后的各组细胞(浓度大约为1×109·L-1),预冷的PBS洗涤细胞2次后加入100 μL预冷的结合缓冲液重悬细胞,依此加入5 μL PE Annexin V 和5 μL 7-AAD后轻轻混悬细胞,于室温(25 ℃)避光条件下反应15 min,然后加入400 μL结合缓冲液,4 ℃避光保存,在24 h内用流式细胞仪检测。

2 结果
2.1 pEGFP-C2-TMEM173真核表达载体的构建与荧光表达对pEGFP-C2-TMEM173的连接产物进行转化,并挑取4个单克隆扩大培养后进行质粒抽提,然后进行双酶切(EcoR I和BamH I)鉴定,并对酶切产物进行琼脂糖电泳,结果如Fig1A显示,有2个质粒酶切后出现了两条亮带,与DNA Marker横向比较,发现其中一条大小约为4 700 bp,与pEGFP-C2空载体酶切产物的大小一致,另一条大小分别约为1 140 bp,与TMEM173目的片段大小一致,表明各重组质粒连接成功,选取其中一个阳性克隆送生物公司进行DNA测序,并将测序结果与TMEM173的CDS序列进行比较分析,结果发现二者的碱基序列完全一致。将pEGFP-C2-TMEM173瞬时转染至LX-2细胞中,约24 h后在荧光显微镜下观察TMEM173的过表达情况,结果如Fig1B所示,具有绿色荧光的细胞即为表达成功的细胞。进一步利用激光共聚焦技术对TMEM173的细胞亚定位进行了观察,结果如Fig1C所示,pEGFP-C2-TMEM173过表达后主要定位在细胞质中。综上表明pEGFP-C2-TMEM173真核表达载体成功构建并表达。

Fig 1 Restriction enzyme identification and fluorescent expression of pEGFP-C2-TMEM173A:The restriction enzyme identification of pEGFP-C2-TMEM173,M:DNA marker;1-4:the enzyme digestion products of pEGFP-C2-TMEM173;5:the enzyme digestion products of pEGFP-C2.B:Fluorescent expression of pEGFP-C2-TMEM173 after transfection for 24 hours.C:Subcellular localization of pEGFP-C2-TMEM173,GFP showed the green fluorescence localization of GFP-TMEM173 in LX-2;DAPI staining showed the nucleus;MERGE showed the superposition of GFP and DAPI.
2.2 TMEM173过表达和沉默效果检测分别将pEGFP-C2-TMEM173(pEGFP-C2为对照)和TMEM173-siRNA(NC-siRNA为对照)瞬时转染至LX-2细胞中,约24 h后收集各组细胞提取总RNA和总蛋白,并检测TMEM173的过表达和沉默效果。QPCR结果如Fig2A、B所示,与空白组和对照组相比,pEGFP-C2-TMEM173组细胞中TMEM173的mRNA表达水平明显升高(P<0.05),反之,TMEM173-siRNA组则明显降低(P<0.05)。另外,Western blot结果如Fig2C、D所示,当用TMEM173抗体进行免疫印迹时,与空白组和对照组相比,pEGFP-C2-TMEM173组在约64 ku的位置还出现了明显的蛋白条带,即为GFP-TMEM173融合蛋白(27 ku+37 ku)的表达;反之,TMEM173 -siRNA组细胞中的TMEM173的蛋白表达水平则明显降低(P<0.05),表明TMEM173在LX-2细胞中能够成功过表达和沉默。
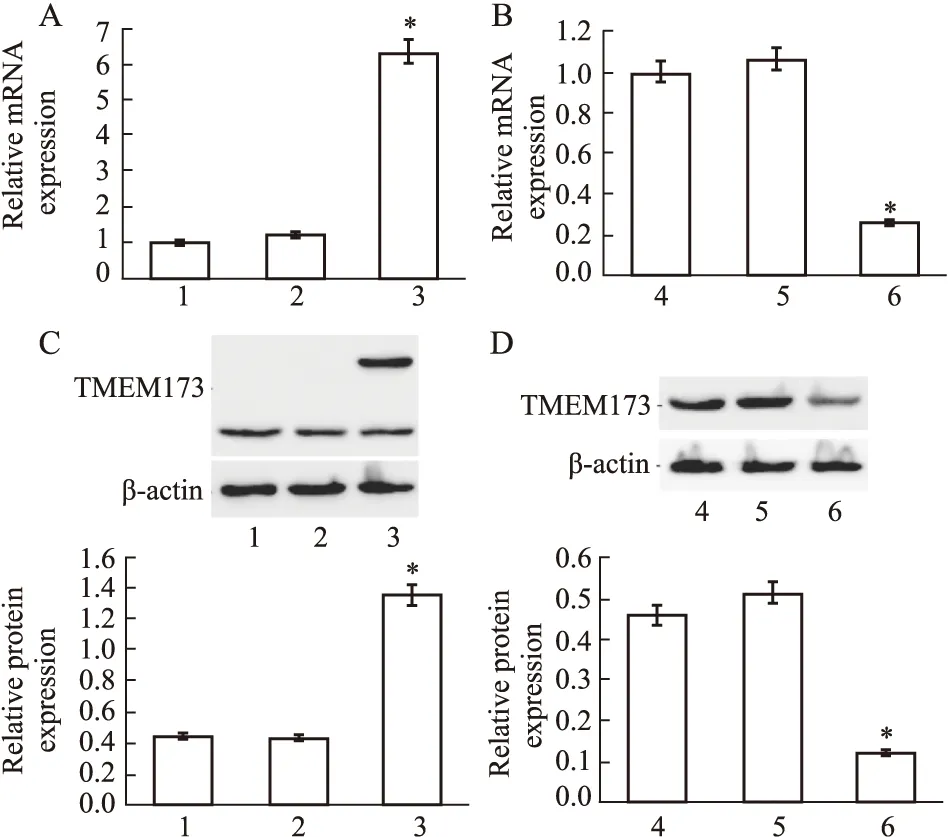
Fig 2 Effect of TMEM173 overexpression and silencingA and C:The QPCR and Western blot results of TMEM173 overexpression in LX-2 cells,1:Untransfected LX-2 cells;2:LX-2 cells transfected with pEGFP-C2;3:LX-2 cells transfected with pEGFP-C2-TMEM173.B and D:The QPCR and Western blot results of TMEM173 silencing in LX-2 cells,4:Untransfected LX-2 cells;5:LX-2 cells transfected with NC-siRNA;6:LX-2 cells transfected with TMEM173-siRNA.*P<0.05 vs control group.
2.3 TGF-β1诱导LX-2细胞活化α-SMA表达量的增加是HSC活化的主要标志,分别在LX-2细胞中按时间和浓度梯度加入TGF-β1进行刺激,分别收集各组细胞提取总RNA和总蛋白进行QPCR和WB检测。结果显示,当TGF-β1诱导12 h后,α-SMA的mRNA和蛋白表达水平均明显升高,且随着诱导时间的递增呈上升趋势,存在一定的时间依耐性,见Fig3A;当TGF-β1诱导浓度为10 μg·L-1时,α-SMA的mRNA和蛋白表达水平均明显升高,且随着诱导浓度的递增呈上升趋势,同样存在一定的浓度依耐性,见Fig3B。综上表明10 μg·L-1的TGF-β1诱导12 h后即可使LX-2细胞活化。

Fig 3 Activation of LX-2 cells induced by TGF-β 1A:The mRNA and protein expression levels of α-SMA were detected after LX-2 cells were induced by TGF-β1 in time gradient.B:The mRNA and protein expression levels of α-SMA were detected after LX-2 cells were induced by TGF-β1 in concentration gradient.*P<0.05 vs control group.
2.4 TMEM173过表达和沉默对活化LX-2细胞增殖的影响在TGF-β1诱导LX-2细胞12 h后,分别将pEGFP-C2-TMEM173(pEGFP-C2为对照)和TMEM173-siRNA(NC-siRNA为对照)瞬时转染至LX-2细胞中,约24 h后分别用MTT和EdU法检测各组细胞的增殖情况,结果如Tab 2和Fig4所示,与空白组和对照组相比,pEGFP-C2-TMEM173组细胞的增殖率明显升高(P<0.05),反之,TMEM173-siRNA组细胞的增殖率则明显降低(P<0.05)。表明TMEM173过表达能够明显促进活化LX-2细胞的增殖,而其沉默则能发挥明显的抑制增殖作用。
2.5 TMEM173过表达和沉默对活化LX-2细胞凋亡的影响在TGF-β1诱导LX-2细胞12 h后,分别将pEGFP-C2-TMEM173(pEGFP-C2为对照)和TMEM173-siRNA(NC-siRNA为对照)瞬时转染至LX-2细胞中,约24 h后收集各组细胞,分别进行PE Annexin V和7-AAD染色,然后利用流式细胞术检测各组细胞的凋亡情况,结果如Tab 3和Fig5所示,与空白组和对照组相比,pEGFP-C2-TMEM173组细胞的凋亡率明显降低(P<0.05),反之,TMEM173-siRNA组细胞的凋亡率则明显升高(P<0.05)。表明TMEM173过表达能够明显抑制活化LX-2细胞的增殖,而其沉默则能发挥明显的促进凋亡作用。

Tab 2 Effects of TMEM173 overexpression and silencing on proliferation of activated LX-2 cells

Tab 3 Effects of TMEM173 overexpression and silencing on apoptosis of activated LX-2 cells

Fig 4 Effects of TMEM173 overexpression and silencing on proliferation of activated LX-2 cellsA:Effect of TMEM173 overexpression on the proliferation of activated LX-2 cells,1:Blank group without transfection;2:Control group transfected with pEGFP-C2;3:Overexpression group transfected with pEGFP-C2-TMEM173.B:Effect of TMEM173 silencing on the proliferation of activated LX-2 cells,4:Blank group without transfection;5:Control group transfected with NC-siRNA;6:Silencing group transfected with TMEM173-siRNA.*P<0.05 vs control group.

Fig 5 Effects of TMEM173 overexpression and silencing on apoptosis of activated LX-2 cellsA:Effect of TMEM173 overexpression on apoptosis of activated LX-2 cells,1:Blank group without transfection;2:Control group transfected with pEGFP-C2;3:Overexpression group transfected with pEGFP-C2-TMEM173.B:Effect of TMEM173 silencing on apoptosis of activated LX-2 cells,4:Blank group without transfection;5:Control group transfected with NC-siRNA;6:Silencing group transfected with TMEM173-siRNA.*P<0.05 vs control group.
2.6 TMEM173对活化LX-2细胞的增殖和凋亡相关通路蛋白表达的影响在TGF-β1诱导LX-2细胞12 h后,分别将pEGFP-C2-TMEM173(pEGFP-C2为对照)和TMEM173-siRNA(NC-siRNA为对照)瞬时转染至LX-2细胞中,约24 h后收集各组细胞提取总蛋白,定量分析后进行Western blot检测,分别用PCNA、Bcl-2、Bax、cleaved-caspase-3和cleaved-PARP等抗体进行免疫印迹,结果如Fig6所示,与空白组和对照组相比,pEGFP-C2-TMEM173组细胞中PCNA和Bcl-2的蛋白表达水平明显上调(P<0.05),且Bax、cleaved-caspase-3和cleaved-PARP则明显下调(P<0.05);反之,TMEM173 -siRNA组细胞中PCNA和Bcl-2的蛋白表达水平明显下调(P<0.05),且Bax、cleaved-caspase-3和cleaved-PARP则明显上调(P<0.05),表明TMEM173的表达变化对增殖和凋亡相关通路蛋白具有调控作用,进而发挥其促增殖和抑凋亡的作用。

Fig 6 Effect of TMEM173 on expression of proliferation and apoptosis related pathway proteins in activated LX-2 cellsA:Effect of TMEM173 overexpression on the expression of proliferation and apoptosis related pathway proteins in activated LX-2 cells,1:Blank group without transfection;2:Control group transfected with pEGFP-C2;3:Overexpression group transfected with pEGFP-C2-TMEM173.B:Effect of TMEM173 silencing on the expression of proliferation and apoptosis related pathway proteins in activated LX-2 cells,4:Blank group without transfection;5:Control group transfected with NC-siRNA;6:Silencing group transfected with TMEM173-siRNA.*P<0.05 vs control group.
2.7 TMEM173对cGAS-STING通路活化的影响在TGF-β1诱导LX-2细胞12 h后,分别将pEGFP-C2-TMEM173(pEGFP-C2为对照)和TMEM173-siRNA(NC-siRNA为对照)瞬时转染至LX-2细胞中,约24 h后收集各组细胞提取总蛋白,定量分析后进行Western blot检测,分别用TBK1和IRF3抗体进行免疫印迹,结果如Fig7所示,与空白组和对照组相比,pEGFP-C2 -TMEM173组细胞中TBK1和IRF3的蛋白表达水平明显上调(P<0.05),反之,TMEM173-siRNA组细胞中TBK1和IRF3的蛋白表达水平明显下调(P<0.05)。表明TMEM173的表达变化对cGAS-STING通路的活化具有调控作用。
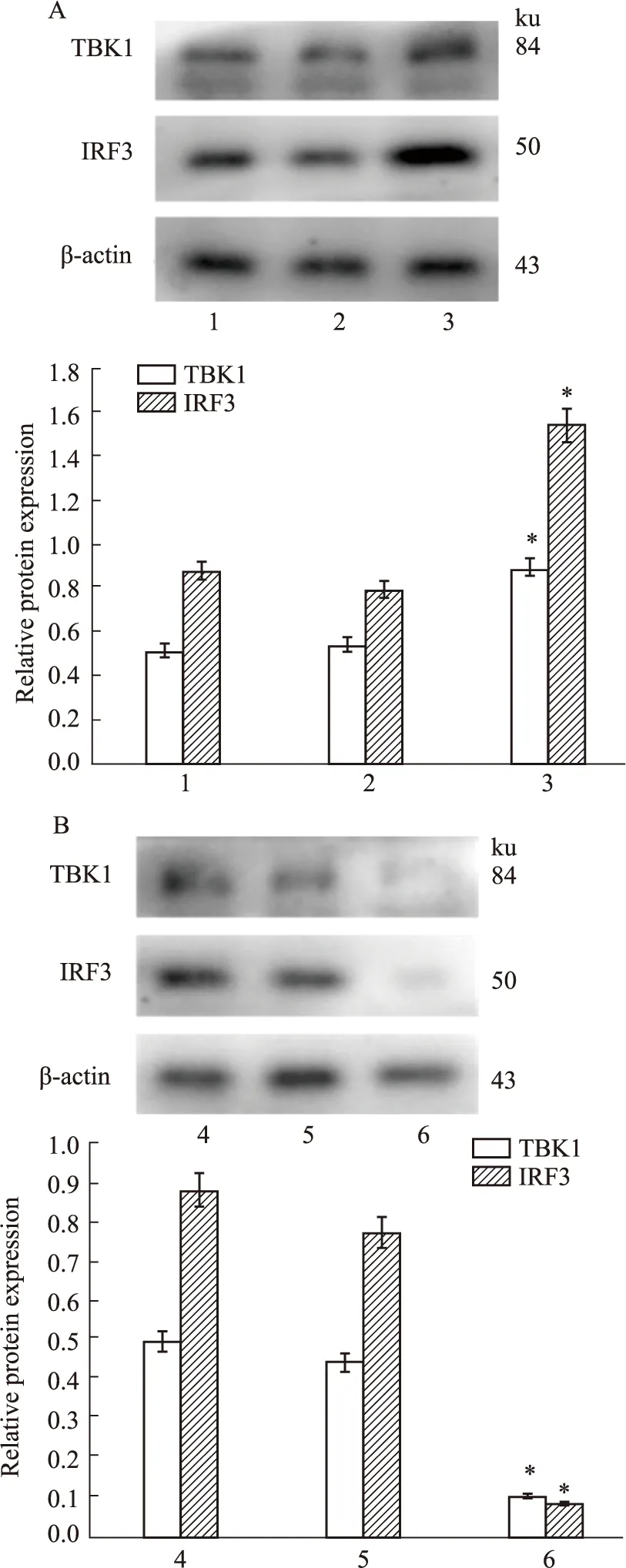
Fig 7 Effect of TMEM173 on activation of cGAS-STING pathwayA:Effect of TMEM173 overexpression on activation of cGAS-STING pathway,1:Blank group without transfection;2:Control group transfected with pEGFP-C2;3:Overexpression group transfected with pEGFP-C2-TMEM173.B:Effect of TMEM173 silencing on activation of cGAS-STING pathway,4:Blank group without transfection;5:Control group transfected with NC-siRNA;6:Silencing group transfected with TMEM173-siRNA.*P<0.05 vs control group.
3 讨论
HSC占肝脏固有细胞总数的15%,占非实质细胞的30%左右。HSC是细胞外基质的主要来源,各种致纤维化因素均把其作为最终靶细胞,当肝脏受到炎症或机械刺激等损伤时,其被激活并转化为肌成纤维细胞样细胞,其表型便由静止型转变为激活型。激活的肝星状细胞通过增生和分泌细胞外基质参与肝纤维化的形成和肝内结构的重建,最终奠定了肝纤维化的病理学基础。本研究涉及的LX-2细胞是最常见的HSC体外细胞模型之一,其保留着活化HSC的关键特征,如细胞因子信号传导、神经元基因表达、维甲酸代谢和纤维形成等,广泛应用于肝炎及纤维化的体外研究[10-11]。
TMEM173又称为STING、MPYS或ERIS,其具有高度的保守性,在不同真核细胞和无脊椎动物中都存在同源物,人源与鼠源的TMEM173的相似性高达81%[12]。TMEM173高表达于一些免疫细胞来源的细胞系,提示其可能在免疫系统中具有重要功能。而且TMEM173本身还可以作为受体,直接结合细菌分泌的重要第二信使——环二核苷酸(cyclic dinucleotides,CDNs),诱导抗感染的固有免疫反应[13-14]。有研究表明TMEM173在非酒精性脂肪肝患者肝组织中表达水平明显增加,DMXAA诱导能够促进巨噬细胞介导的小鼠肝脏炎症和纤维化因子的表达,并增强HSC的活化[9]。
本研究旨在探索TMEM173对活化LX-2的细胞增殖和凋亡的调控功能。TGF-β1是肝实质细胞受损后释放的强效致纤维化因子,是启动邻近静息态HSC活化的重要初始信号之一,因此,在本研究中我们首先利用TGF-β1刺激LX-2建立人肝星状细胞体外活化模型。然后我们通过改变活化LX-2细胞中TMEM173的表达水平来研究其对细胞增殖和凋亡的影响,一方面利用基因重组技术构建真核表达质粒pEGFP-C2-TMEM173来提高LX-2细胞中TMEM173的表达水平,另一方面设计并合成TMEM173-siRNA来降低TMEM173的表达水平,且QPCR和Western blot结果显示二者能够达到TMEM173预期的过表达和沉默效果。紧接着我们分别在活化的LX-2细胞中过表达和沉默了TMEM173,并分别利用MTT和FCM技术检测了其增殖和凋亡情况,结果发现TMEM173过表达能够明显促进细胞增殖和抑制细胞凋亡,而沉默TMEM173则能够得到相反的结果。
为探索TMEM173促增殖、抑凋亡的分子机制,我们进一步细胞增殖和凋亡标志蛋白的表达水平进行了检测。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)是一类只存在于增殖细胞中的阶段性表达的蛋白质,其浓度在细胞周期中呈周期性变化,检测其表达水平可以作为评价细胞增殖状态的重要指标[15],本研究发现TMEM173过表达后能够明显提高PCNA的蛋白表达水平,而其沉默后又明显降低PCNA的蛋白表达水平,进一步确定了TMEM173调控细胞增殖的功能。Bcl-2家族蛋白是在细胞凋亡过程中起关键性作用的一类蛋白,主要包括抗凋亡蛋白(如Bcl-2、Bcl-xL、Bcl-w 等)和促凋亡蛋白(如Bax、Bak、Bid 等),它们可通过调节线粒体中细胞色素C(cyt-c)释放来调控细胞凋亡,cyt-c的释放是线粒体凋亡途径激活的显著特征,其被释放到细胞质中后能够与凋亡蛋白酶激活因子1(APAF-1)结合,导致caspase-3激活而引起细胞凋亡,而活化的caspase-3能够水解PAPR,后者被认为是凋亡的标志物。本研究发现TMEM173过表达后能够明显提高Bcl-2的蛋白表达水平,而明显降低Bax、cleaved-caspase-3和cleaved-PARP的蛋白表达水平,且TMEM173沉默也能够得到相反的结果,进一步表明了TMEM173能够有效调控细胞凋亡,其作用机制可能与改变 Bax /Bcl-2 及 cleaved caspase-3 的蛋白表达有关。接下来本研究还对cGAS-STING通路中关键蛋白TBK1和IRF3的表达水平进行了检测,结果发现TMEM173过表达能够明显上调它们的表达水平,意味着其调控HSC细胞增殖可能与cGAS-STING通路的活化有着密切关系。
综上表明,TMEM173在活化肝星状细胞的增殖与凋亡过程中扮演着积极的角色,很可能成为肝炎和肝纤维化基因治疗的潜在靶点。接下来我们将分别建立肝炎和肝纤维化的细胞和动物模型,进一步研究TMEM173对肝星状细胞中炎症因子、纤维化因子分泌和表达的影响,以及对相关信号通路的调控功能,深入探索TMEM173参与肝炎和肝纤维化发生发展的具体机制。

