褐藻胶寡糖对D-半乳糖诱导的小鼠肾脏衰老的保护作用及机制
潘 慧,郑晓月,王 珊,陈 茗,毛拥军
(青岛大学附属医院老年医学科,山东 青岛 266000)
衰老引起的器官功能退行性改变是诱发各种年龄相关性疾病的主要危险因素。尽管衰老过程本身不会导致肾脏疾病,但结合年龄相关危险因素的累积影响,最终会引发肾脏的诸多病理改变。肾脏衰老是机体衰老的一部分,主要表现为功能性肾单位数量逐渐减少,肾小球萎缩、囊腔扩张,肾小管水肿、空泡化,肾间质纤维化[1-2],导致肾脏对应激损伤更加敏感,进而使老年人肾功能障碍的发病率和死亡率明显增加。因此,积极寻找抗衰老的天然化合物并探讨其延缓肾脏衰老的机制有重要意义。
自噬是大多数真核细胞降解受损或变性大分子物质的质量控制机制[3]。衰老可引起肾脏自噬功能紊乱,肾脏组织中自噬活性降低,可导致肾小球硬化、足细胞缺失,而上调自噬水平可减少足细胞和肾小管细胞凋亡并促进细胞再生,这对维持衰老肾脏组织稳态和缓解衰老相关损伤至关重要[4]。腺苷酸活化蛋白激酶(AMPK)和雷帕霉素靶蛋白(mTOR)是调控自噬的重要信号分子[5]。Liu等[6]研究表明,金丝桃苷可通过调控AMPK-ULK1信号介导的自噬减弱D-半乳糖(D-gal)诱导的肾脏老化和损伤。Yamamoto等[7]关于近端肾小管特异性自噬缺陷小鼠的研究表明,肾脏衰老损伤的发病机制与以微管相关蛋白1轻链3(LC3)和程序性死亡受体1(Beclin1)的变化为特征的自噬功能障碍相关。因此,上调自噬水平被认为是治疗年龄相关性肾损伤的一种有益策略。
褐藻胶是从海洋褐藻中提取的天然海藻多糖,褐藻胶寡糖(AOS)是由海藻酸盐解聚而形成的一种酸性多糖,具有水溶性、无毒、无免疫原性等多种独特优势。研究表明,AOS具有抗氧化、抗炎、免疫调节等多种药理活性,已被广泛应用于食品、药品等领域[8]。本课题组前期研究显示,AOS可以延缓D-gal诱导的C57BL/6j小鼠白内障进程[9],缓解野百合碱诱导的大鼠肺动脉高压[10]。然而,AOS在肾脏衰老过程中的作用研究甚少。基于既往研究及预实验结果,本课题组推测AOS可能通过激活AMPK/mTOR信号通路上调自噬水平延缓肾脏衰老。本研究旨在探讨AOS对D-gal诱导的小鼠肾脏衰老的保护作用及其可能机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 30只雄性C57BL/6j小鼠,6-8周龄,体质量(20±2)g,购自北京维通利华实验动物繁育有限公司,饲养在青岛大学医学部SPF级实验动物中心,温度(22±2)℃、相对湿度(50±10)%、明暗周期12 h ∶12 h。整个实验过程中,所有小鼠均可自由获得标准饲料和饮用水。本研究中所有动物实验相关操作均获得青岛大学动物福利和伦理管理委员会批准(批号:QYFYWZLL25840)。
1.1.2主要药物及试剂 D-gal(货号:G0750)购自美国Sigma公司;AOS购于青岛博智汇力生物技术有限公司。SQSTM1/p62(货号:23214)、Beclin1(货号:3495)、LC3-Ⅰ/Ⅱ(货号:12741)、AMPK(货号:2532)及p-AMPK(货号:2535)抗体购自美国Cell Signaling Technology公司;p16(货号:ab232402)购自美国Abcam公司;mTOR(货号:66888-1-Ig)、p-mTOR(货号:67778-1-Ig)抗体购于武汉Proteintech公司;GAPDH(货号:ENM0215)、山羊抗兔(货号:E-AB-1003)和山羊抗鼠(货号:E-AB-1001)二抗购于武汉Elabscience公司。尿素氮(BUN)、血肌酐(SCr)试剂盒购于南京建成生物技术有限公司;BCA蛋白浓度测定试剂盒购于北京索莱宝公司。除另有说明外,所有其他试剂均购自标准商业供应商。
1.2 实验方法
1.2.1动物分组及处理 适应性喂养1周后,将小鼠随机分成3组:对照组(Control)、模型组(D-gal)、AOS治疗组(D-gal + AOS),每组10只。D-gal组和D-gal + AOS组小鼠通过颈背部皮下注射D-gal(200 mg·kg-1·d-1)8周建立肾脏衰老模型,Control组小鼠同步注射等体积无菌生理盐水;从D-gal注射的第5周开始,D-gal + AOS组小鼠予以AOS(200 mg·kg-1·d-1)灌胃4周[11],Control和D-gal组小鼠同步予以等体积灭菌蒸馏水。
1.2.2肾功能测定 药物处理结束后,通过眼眶静脉收集血样,4 ℃、3 000 r·min-1离心15 min后,收集血浆于-80 ℃保存。采用试剂盒严格按照说明书操作,分别检测小鼠BUN和SCr水平。
1.2.3组织学检查 小鼠采血后麻醉并处死,迅速分离肾脏组织,大量生理盐水冲洗后,置于4%多聚甲醛中固定24 h,制成石蜡切片用于HE染色及Masson染色,显微镜下观察肾脏组织结构改变和纤维化程度。
1.2.4Western blot 取新鲜肾脏组织称重,并加入适量含有蛋白酶抑制剂和磷酸酶抑制的RIPA裂解液,4 ℃、12 000 r·min-1离心20 min后收集上清液,BCA试剂盒测定蛋白浓度。等量蛋白于适宜浓度的凝胶上电泳分离后,电转至PVDF膜上,随后用5%脱脂牛奶室温封闭90 min,TBST洗膜后,分别加入相应一抗,4 ℃孵育过夜后TBST洗膜,随后加入相应二抗在室温下孵育1 h。采用ECL化学发光液曝光,凝胶成像系统成像后采用Quantity One软件分析条带灰度值。将GAPDH蛋白表达作为内参照。
1.2.5实时荧光定量PCR(qRT-PCR) 取新鲜肾脏组织称重,并加入适量TRIzol提取总RNA,紫外分光光度计测定RNA纯度和浓度。采用Roche逆转录试剂盒,根据说明书操作合成cDNA。Klotho引物序列:F:5′-TGGGTCACTGGGTCAATCTCTGG-3′,R:5′-GCCTTTCAGCCGCCCTAAAC-3′;GAPDH引物序列:F:5′-CCTTCCGTGTCCCCACT-3′,R:5′-GCCTGCTTCACCACCTC-3′。根据qRT-PCR说明书在95 ℃ 10 min,95 ℃ 10 s、60 ℃ 10 s,72 ℃ 15 s,40次循环的条件下扩增cDNA。反应结束后,记录PCR仪上的扩增曲线显示的Ct值,目的基因的相对表达量采用比较2-△△Ct法计算。

2 结果
2.1 AOS对D-gal诱导衰老小鼠肾功能的影响结果如Fig1所示,D-gal组小鼠BUN和SCr水平明显高于Control组,AOS处理4周后,其水平恢复至低于D-gal组,提示AOS可以减轻D-gal诱导衰老小鼠的肾功能损害(P<0.05,P<0.01)。
2.2 AOS改善D-gal诱导衰老小鼠的肾脏组织病理改变HE染色和Masson染色结果如Fig2所示,与Control组相比,注射D-gal 8周后,小鼠肾脏中功能肾小球数量明显减少,肾小球嚢腔扩张,肾小管上皮细胞水肿、变性,空泡形成;肾间质可见明显蓝染胶原纤维,这些病理变化在AOS处理4周后明显缓解(P<0.01)。结果表明AOS可以改善D-gal诱导的衰老小鼠肾脏病理损伤,并缓解其纤维化程度。
2.3 AOS对D-gal诱导的小鼠肾脏组织中衰老相关蛋白表达的影响Western blot结果显示,衰老相关蛋白p16在D-gal组表达明显增加,与D-gal组相比,AOS处理促进了p16蛋白表达下调(P<0.05)(Fig3)。
2.4 AOS上调了D-gal诱导的衰老小鼠肾脏组织中Klotho的基因表达为探讨AOS是否调控Klotho在肾脏中的表达,采用qRT-PCR检测Klotho基因表达水平。结果如Fig4所示,与Control组相比,D-gal组小鼠肾脏组织中Klotho表达明显降低,而AOS给药4周后,Klotho表达明显增加(P<0.01)。我们的结果表明Klotho基因可能参与了AOS改善D-gal诱导的肾脏衰老过程。
2.5 AOS上调了D-gal诱导的衰老小鼠肾脏的自噬水平如Fig5中结果显示,与Control组相比,D-gal组小鼠肾脏组织中LC3-Ⅱ/Ⅰ和Beclin1蛋白表达明显下降,p62表达增加,AOS处理明显上调了LC3-Ⅱ/Ⅰ和Beclin1的表达,下调了p62的表达(P<0.01)。
2.6 AOS激活了D-gal诱导的衰老小鼠肾脏中AMPK/mTOR信号通路为了进一步探讨AOS是否通过激活AMPK/mTOR信号通路上调自噬水平,进而延缓D-gal诱导的小鼠肾脏衰老,我们采用Western blot方法检测各组肾脏组织中AMPK/mTOR信号通路蛋白的表达情况。实验数据显示,与Control组相比,D-gal诱导衰老小鼠肾脏组织中p-AMPK表达降低,p-mTOR表达增加;与D-gal组相比,AOS处理后p-AMPK表达增加,而p-mTOR表达明显降低(P<0.01)(Fig6)。

Fig 1 Kidney function improved by AOS in D-gal-induced aging mice n=10)A:The level of BUN;B:The level of SCr.**P<0.01 vs control group;#P<0.05 ,##P<0.01 vs D-gal group.
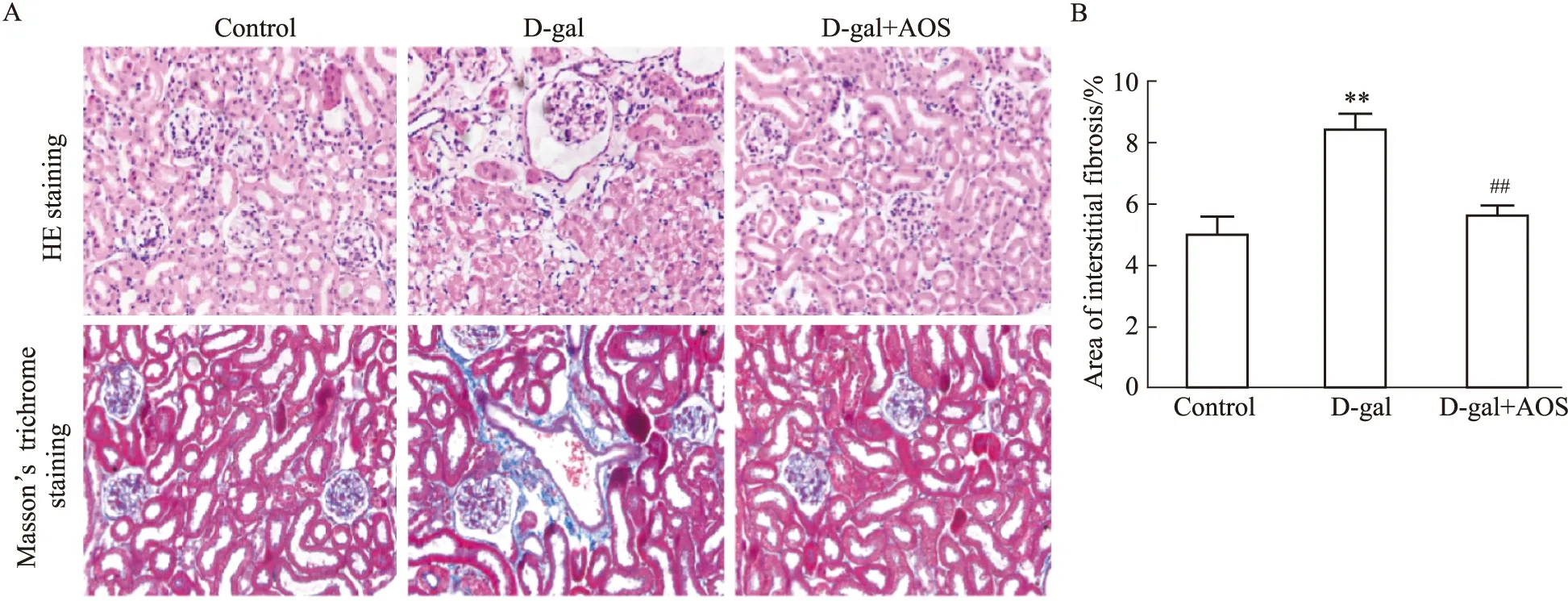
Fig 2 Kidney histological alterations prevented by AOS in D-gal-induced aging mice n=10)A:Morphological changes were assessed by HE staining (×400);B:The degree of kidney fibrosis was investigated by Masson trichrome staining (×400);C:The corresponding quantitative data of (B).**P<0.01 vs control group;##P<0.01 vs D-gal group.
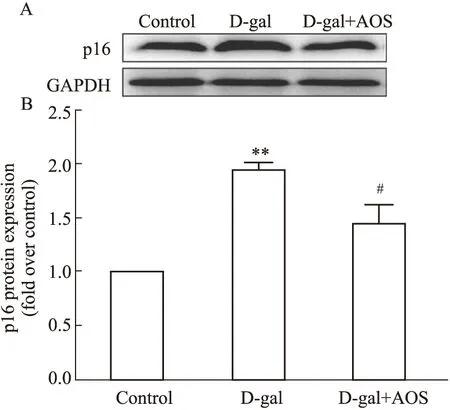
Fig 3 Expression of aging markers down-regulated by AOS in D-gal-induced aging mice n=10)A:The protein expression of p16 was measured by Western blot;B:The corresponding quantitative data of (A).**P<0.01 vs control group;#P<0.05 vs D-gal group.
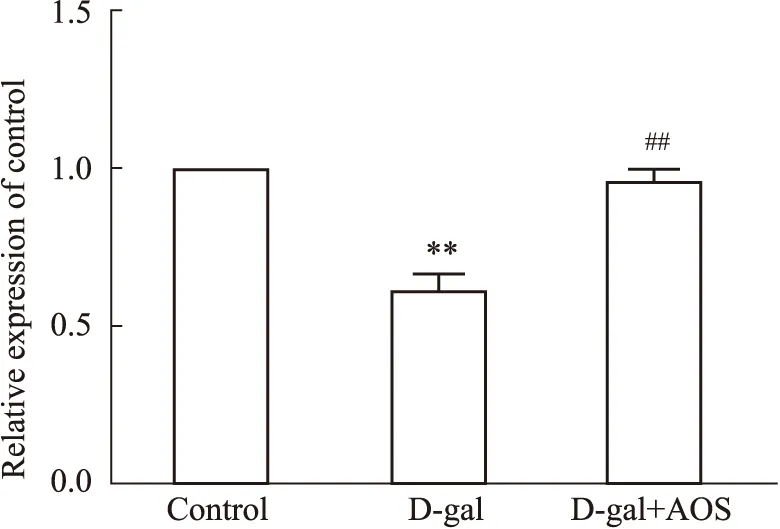
Fig 4 Expression of Klotho gene up-regulated by AOS in D-gal-induced aging mice n=10)The expression of the antiaging gene Klotho was measured by RT-qPCR.**P<0.01 vs control group;##P<0.01 vs D-gal group.

Fig 5 The autophagy level up-regulated by AOS in D-gal-induced aging mice n=10)(A,C)The protein expression of LC3-Ⅱ/Ⅰ,Beclin1 and p62 was determined by Western blot.(B,D)The corresponding quantitative data of (A ,C).**P<0.01 vs control group;##P<0.01 vs D-gal group.

Fig 6 AMPK/mTOR signaling pathway activated by AOS in kidney of D-gal-induced aging mice n=10)A:The protein expression of AMPK,p-AMPK,mTOR and p-mTOR was determined by Western blot;B:The corresponding quantitative data of (A).**P<0.01 vs control group;##P<0.01 vs D-gal group.
3 讨论
随着老龄人口的持续增长,年龄相关性肾脏疾病的发病率和死亡率不断增加[12],因此,明确肾脏衰老相关机制以及探索有效抗衰老药物对延缓肾脏衰老、治疗衰老相关肾损伤具有重要意义。本实验以D-gal诱导C57BL/6j小鼠的肾脏衰老模型为研究对象,探讨AOS可能的抗衰老作用及其机制。本研究发现,D-gal处理后小鼠肾功能下降、衰老标志物表达增加、衰老抑制基因及自噬水平降低,AOS干预后明显改善了肾功能,上调其自噬水平和衰老抑制基因表达,表明AOS对D-gal诱导的小鼠肾脏衰老有潜在的保护作用。
自噬-溶酶体体系是真核细胞内受损细胞器和大分子物质的主要降解途径,在自然衰老过程中,自噬活性逐渐降低。Beclin1是自噬过程启动的关键因子,自噬过程启动后,LC3蛋白合成并立即被Atg4剪切后在细胞质中形成LC3-Ⅰ,LC3-Ⅰ随后被泛素化修饰和加工后形成LC3-Ⅱ,并定位到自噬小体中,LC3-Ⅱ/Ⅰ比值的大小可评估自噬水平的高低[13-14]。p62是一类衔接蛋白,在自噬溶酶体降解过程中起关键作用。因此,LC3-Ⅱ、Beclin1和p62均可作为自噬水平检测的主要标志物。吴飞翔等[15]关于多胺及与自噬的研究支持了自噬在抗衰老过程中的关键作用。一项体外研究显示,肾脏足细胞和近端肾小管细胞Atg5基因的特异性缺失导致足细胞中受损线粒体和泛素化蛋白的积累,从而导致年龄依赖性蛋白尿和肾小球硬化,该研究结果表明,足细胞和近端肾小管细胞中基础自噬的缺乏与肾脏老化的发展相关[16]。我们的实验证实了AOS可以延缓D-gal诱导的肾脏衰老,为了探索其可能机制,我们进一步探讨了AOS处理前后自噬水平的变化。刘春燕等[17]研究表明,db/db糖尿病模型小鼠足细胞自噬水平下降,表现为自噬标志物LC3-Ⅱ和Beclin1表达减少,p62表达增加,AMPK磷酸化被抑制,mTOR磷酸化增加。本研究结果与前人一致,D-gal组小鼠肾脏组织中LC3-Ⅱ、Beclin1表达均减少,p62蛋白表达增加,予以AOS干预4周后,LC3-Ⅱ和Beclin1表达显著增加,p62蛋白表达明显减少,这表明AOS可能通过上调自噬水平延缓D-gal诱导的小鼠肾脏衰老。
研究表明,AMPK的缺失会加速衰老相关疾病的发生和发展。mTOR是诱导自噬的关键分子,磷酸化mTOR可抑制自噬,而mTOR的负性调节可促进自噬。AMPK/mTOR信号通路作为自噬调控的关键通路之一,在自噬调节中具有重要作用,AMPK在低能量条件下磷酸化,进而通过抑制mTOR的磷酸化激活自噬[18]。因此,我们检测了AMPK/mTOR通路的相关指标,并探讨了AOS是否通过激活AMPK/mTOR信号通路上调D-gal诱导小鼠衰老肾脏的自噬水平。研究发现,D-gal抑制了小鼠肾脏组织中AMPK的磷酸化,促进mTOR磷酸化,进而抑制自噬;AOS处理促进了衰老肾脏中AMPK的磷酸化,从而抑制了mTOR的磷酸化,进而增强自噬。基于本研究结果,我们推断AOS通过激活AMPK/mTOR信号通路上调了D-gal诱导的小鼠衰老肾脏的自噬水平,从而延缓肾脏衰老。
综上所述,本研究证实了在D-gal诱导的C57BL/6j小鼠的衰老肾脏中自噬水平下降。我们的研究表明,AOS可以延缓D-gal诱导的小鼠肾脏衰老,其机制可能与激活AMPK/mTOR信号通路上调自噬水平有关。然而,本研究只在动物水平探讨了AOS通过调控自噬水平延缓D-gal诱导的小鼠肾脏衰老,AOS延缓肾脏衰老的其他机制需要进一步研究。

