人参皂苷Rb1通过调控Nrf2/ARE信号通路抗氧糖剥夺/复氧后神经细胞焦亡的研究
王睿智,陈志文,邵 乐,史孟娇,龚子崴,佘 颜,邓常清
(湖南中医药大学1.医学院血管生物学实验室,湖南 长沙 410208;2.第一附属医院,湖南 长沙 410007)
炎症反应贯穿于脑缺血/再灌注神经损伤的全过程,是脑缺血/再灌注治疗的主要干预环节[1]。细胞焦亡是近年来发现的一种依赖于炎症反应的细胞程序性死亡方式,包括经典焦亡途径和非经典焦亡途径。经典细胞焦亡途径依赖于半胱天冬蛋白酶-1(cysteinyl aspartate-specific proteases-1,Caspase-1)的活化,主要存在于非感染性炎症类疾病中,如脑缺血/再灌注[2-3]。氧化应激损伤是激活经典细胞焦亡的主要途径,同时也是脑缺血/再灌注损伤的重要机制[4]。因此,通过调控氧化应激途径抑制神经细胞焦亡,可能是防治脑缺血/再灌注后炎性损伤的重要途径。
人参皂苷Rb1(ginsenoside Rb1,GRb1)是五加科植物人参、三七中的主要活性成分。研究表明,人参皂苷Rb1具有多种药理作用,包括抑制兴奋性毒性、氧化应激和神经炎症、维持神经递质平衡、抗凋亡和线粒体稳定等作用[5]。由于人参皂苷Rb1抗脑缺血/再灌注损伤的作用机制(如抗氧化应激、抗炎症反应)与细胞焦亡相关调控因素密切相关[6],因而推测人参皂苷Rb1也可通过调控氧化应激和炎症反应,从而抑制脑缺血/再灌注后神经细胞焦亡,发挥脑保护作用。
本研究选用形态、生理生化功能均与正常神经细胞较为相似的人神经母细胞瘤细胞(human neuroblastoma cells,SH-SY5Y cells)进行研究,建立氧糖剥夺/复氧(Oxygen-glucose deprivation/reoxygenation,OGD/R)模型模拟体内脑缺血/再灌注损伤,从核因子E2相关转录因子2/抗氧化反应原件(nuclear factor-E2-related factor 2/antioxidant response element,Nrf2/ARE)介导的抗氧化信号通路探究人参皂苷Rb1抗SH-SY5Y细胞损伤的作用机制,进一步明确人参皂苷Rb1抗OGD/R后SH-SY5Y细胞焦亡与调控Nrf2/ARE抗氧化信号通路的关系。
1 材料与方法
1.1 材料
1.1.1细胞 SH-SY5Y细胞(编号SCSP-5014)购自上海中科院细胞库。
1.1.2主要试剂 人参皂苷Rb1标准品(纯度≥98%,批号18082204)购自成都普菲德公司;GV493-NFE2L2基因RNA干扰慢病毒(批号GIEL0185890)购自上海吉凯基因公司;乳酸脱氢酶检测试剂盒(批号C0017)、Hoechst/PI双染试剂盒(批号C1056)购自上海碧云天公司;兔抗人caspase-1多克隆抗体(批号22915-1-AP)、兔抗人Nrf2多克隆抗体(批号16396-1-AP)、兔抗人血红素氧合酶-1(HemeOxy-genase-1,HO-1)多克隆抗体(批号10701-1-AP)购自美国Proteintech公司;兔抗人磷酸化Nrf2单克隆抗体(批号Ab76026)购自英国Abcam公司。FITC标记的山羊抗兔IgG(批号SAO0003-2)、TRITC标记的山羊抗兔IgG (批号SA00007-2)购自美国Proteintech公司;小鼠抗人β-actin单克隆抗体(批号TA-09)、辣根过氧化物酶标记的山羊抗兔IgG(批号ZB-2301)、辣根过氧化物酶(HRP)标记的山羊抗小鼠IgG (批号ZB-2305)购自北京中杉金桥公司。
1.1.3主要仪器 三气培养箱购自美国Thermo Fisher Scientific公司;多功能酶标仪购自美国Perkinelmer公司;荧光显微镜购自德国Carl Zeiss公司;ChemiDoc XRS高灵敏度化学发光成像系统购自美国Bio-Rad Laboratories公司。
1.2 方法
1.2.1野生型SH-SY5Y细胞的培养及处理 将野生型SH-SY5Y细胞常规培养于细胞培养箱中(5% CO2,21% O2,74% N2)。取第2-5代细胞进行实验。细胞生长融合后,将细胞分为空白对照(Control)组、OGD/R组、不同浓度人参皂苷Rb1(0.01、0.1、1、10、20 mg·L-1)组。在建立OGD/R模型前12 h,Control和OGD/R组加入含10% FBS的DMEM完全培养基,各药物组加入以DMEM完全培养基配制的不同浓度药物,培养12 h。
1.2.2si-Nrf2-SH-SY5Y细胞系构建及处理 将野生型SH-SY5Y细胞常规培养于细胞培养箱中(5% CO2,21% O2,74% N2)。取第2-5代细胞进行实验。细胞生长融合后,将3种GV493-NFE2L2基因RNA干扰慢病毒(si-Nrf2 RNA 53-1、si-Nrf2 RNA 54-1、si-Nrf2 RNA 55-1)和空载慢病毒(si-con RNA)按照MOI(Multiplicity of infection)=20的转染滴度分别转染入野生型SH-SY5Y细胞中。3 d后加入含5 mg·L-1嘌呤霉素的DMEM完全培养基进行多克隆稳转细胞株的筛选,通过在荧光显微镜下观察绿色荧光(si-RNA)的表达比率来判断转染效率(转染效率=绿色荧光细胞数/白光细胞数)。直至上述各种RNA干扰慢病毒转染SH-SY5Y细胞效率达80%后换用含2.5 mg·L-1嘌呤霉素的DMEM完全培养基筛选。筛选培养7 d后,以Western blot方法检测GV493-NFE2L2基因RNA干扰慢病毒和空载慢病毒转染后SH-SY5Y细胞Nrf2蛋白的表达,以此评价GV493-NFE2L2基因RNA干扰慢病毒沉默Nrf2效果,建立稳定的si-con-SH-SY5Y细胞和si-Nrf2-SH-SY5Y细胞。
si-Nrf2-SH-SY5Y细胞系构建后,将细胞分为si-con-SH-SY5Y细胞(空载慢病毒)对照组、si-con-SH-SY5Y细胞模型组、si-con-SH-SY5Y细胞人参皂苷Rb1组、si-Nrf2-SH-SY5Y细胞(沉默Nrf2慢病毒)模型组、si-Nrf2-SH-SY5Y细胞人参皂苷Rb1组。在建立OGD/R模型前12 h,si-con-SH-SY5Y细胞对照组、si-con-SH-SY5Y细胞模型组和si-Nrf2-SH-SY5Y细胞模型组加入含10% FBS的DMEM完全培养基,各药物组加入以DMEM完全培养基配制的1 mg·L-1人参皂苷Rb1,培养12 h。
1.2.3OGD/R模型建立 将模型组和药物组细胞置于三气培养箱中(5% CO2,1% O2,94% N2)缺糖缺氧培养4 h,然后换成DMEM完全培养基常规培养进行复糖复氧,3 h后终止培养并进行检测。
1.2.4CCK-8法检测细胞存活率 将SH-SY5Y细胞接种于96孔细胞培养板中。细胞处理完毕后每孔加入CCK-8检测液(每100 μL DMEM完全培养基中加入10 μL CCK-8原液),反应2 h后检测450 nm的吸光度(A)值,并计算细胞存活率:细胞存活率/%=(实验孔A值-背景孔A值)/(正常对照孔A值-背景孔A值)×100%。
1.2.5测定LDH漏出率 将SH-SY5Y细胞接种于96孔细胞培养板中。细胞处理完毕后,每孔收集100 μL培养基,1 000 r·min-1离心10 min,取上清作为细胞培养上清液。再向培养板中加入与原培养基等体积的新培养基后置于-80 ℃冷冻约30 min,随后37 ℃温育15 min,将细胞冻融液1 000 r·min-1离心10 min,取上清,即为细胞冻融液。分别取SH-SY5Y细胞培养上清液和细胞冻融液100 μL,加入60 μL LDH检测工作液,混匀,室温(24-26)℃,避光孵育,计算培养上清液和细胞冻融液中的LDH活性,再计算细胞LDH漏出率:LDH漏出率=[培养上清液LDH活性/(培养上清液LDH活性+细胞冻融液LDH活性)]。
1.2.6Hoechst/PI染色法检测细胞膜损伤 将SH-SY5Y细胞接种于24孔细胞培养板中。细胞处理完毕后,在SH-SY5Y细胞加入染色液(1 mL细胞染色缓冲液中加入5 μL Hoechst染色液和5 μL PI染色液),4 ℃孵育30 min,抗荧光淬灭剂封片,荧光显微镜下观察红色荧光(PI)和蓝色荧光(Hoechst)表达强度及定位。
1.2.7免疫荧光法检测焦亡蛋白caspase-1的表达 将SH-SY5Y细胞接种于24孔细胞培养板中。细胞处理完毕后,将SH-SY5Y细胞置于4%多聚甲醛中固定爬片15 min,PBST清洗,再用PBST稀释的1 %牛血清白蛋白封闭液封闭1 h。加入PBST稀释的caspase-1一抗(1 ∶50稀释),4 ℃孵育过夜。每孔加入PBS稀释的TRITC标记的荧光二抗(1 ∶50稀释),室温避光孵育1 h,DAPI染液染核,抗荧光淬灭剂封片,荧光显微镜下观察红色荧光(caspase-1)和绿色荧光(si-RNA)的表达强度及定位。
1.2.8免疫荧光法检测Nrf2蛋白活化 将SH-SY5Y细胞接种于24孔细胞培养板中。细胞处理完毕后,将SH-SY5Y细胞置于4%多聚甲醛中固定爬片15 min,PBST清洗,再用PBST稀释的1 %牛血清白蛋白封闭液封闭1 h,加入PBST稀释的磷酸化Nrf2一抗(1 ∶200稀释),4 ℃孵育过夜。每孔加入PBS稀释的TRITC标记荧光二抗(1 ∶50稀释),室温避光孵育1 h,DAPI染液染核,抗荧光淬灭剂封片,荧光显微镜下观察红色荧光(activated Nrf2)和绿色荧光(si-RNA)的表达强度及定位,检测Nrf2蛋白活化水平。
1.2.9Western blot检测Nrf2、HO-1、caspase-1蛋白表达 将SH-SY5Y细胞接种于75 cm2培养皿中。细胞处理完毕后,将SH-SY5Y细胞加入0.25%胰蛋白酶消化,1 000 r·min-1离心10 min后收集细胞,加入150 μL蛋白裂解液提取细胞总蛋白。BCA 法测定各样本蛋白浓度,并将各样本蛋白浓度调整为3 g·L-1。蛋白样品煮沸变性后进行SDS-PAGE凝胶电泳,转膜,5%脱脂奶粉37 ℃封闭1 h。加入PBS稀释的Nrf2、HO-1、caspase-1一抗(1 ∶1 000稀释)及β-actin一抗(1 ∶1 500稀释),4 ℃孵育过夜。TBST清洗,加入TBST稀释的二抗(1∶5 000稀释),室温孵育1 h。TBST清洗,加入ECL显影液显影,凝胶成像仪照相,Image图像分析软件测定各目的条带的积分光密度(IOD),分别以Nrf2、HO-1、caspase-1的IOD与β-actin的IOD的比值对目的蛋白的表达进行相对定量。

2 结果
2.1 不同浓度人参皂苷Rb1对OGD/R后SH-SY5Y细胞存活率的影响野生型SH-SY5Y细胞OGD/R后,细胞存活率下降(P<0.01)。与模型组比较,各浓度人参皂苷Rb1组均可使细胞存活率提升(P<0.01)。人参皂苷Rb1(0.01、0.1、1 mg·L-1)组之间呈现量效关系,以人参皂苷Rb1(1 mg·L-1)组作用最强(P<0.05,P<0.01),见Fig1。
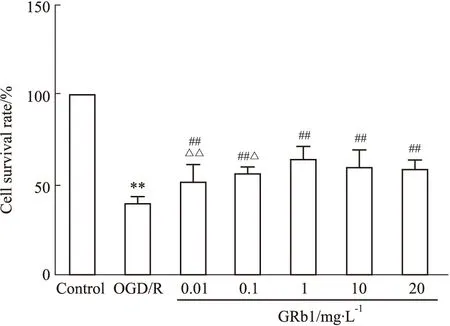
Fig 1 Comparison of cell survival rate in each group (n=8)**P<0.01 vs Control group;##P<0.01 vs OGD/R group;△P<0.05,△△P<0.01 vs GRb1(1 mg·L-1)group.
2.2 si-Nrf2 RNA-SH-SY5Y细胞系的构建选取3种GV493-NFE2L2慢病毒(si-Nrf2 RNA 53-1、si-Nrf2RNA 54-1、si-Nrf2RNA 55-1)干扰SH-SY5Y细胞,评价GV493-NFE2L2慢病毒下调Nrf2的效果。与si-RNA比较,si-Nrf2 RNA 53-1、54-1、55-1均可使SH-SY5Y细胞Nrf2蛋白表达水平下降(P<0.01),且以si-Nrf2 RNA 55-1的作用最强,本研究采用si-Nrf2 RNA 55-1干扰细胞构建Nrf2低表达SH-SY5Y细胞(si-Nrf2-SH-SY5Y)进行实验,见Fig2。
2.3 人参皂苷Rb1对OGD/R后SH-SY5Y细胞存活率的影响si-con-SH-SY5Y细胞OGD/R后,细胞存活率降低(P<0.01)。与si-con-SH-SY5Y细胞OGD/R组比较,si-Nrf2-SH-SY5Y细胞OGD/R后细胞存活率下降(P<0.05)。
与si-con-SH-SY5Y细胞OGD/R组比较,si-con-SH-SY5Y细胞人参皂苷Rb1组存活率增加(P<0.05)。与si-con-SH-SY5Y细胞人参皂苷Rb1组比较,si-Nrf2-SH-SY5Y人参皂苷Rb1组细胞存活率降低(P<0.01),见Fig3。
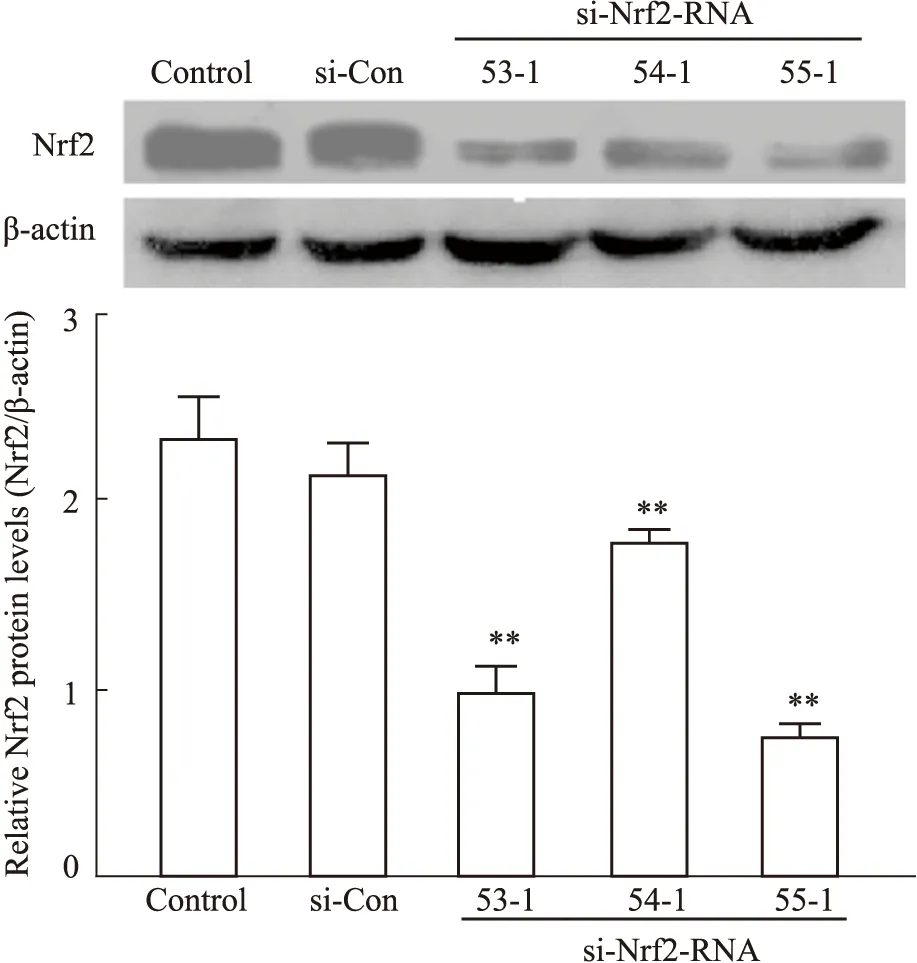
Fig 2 Comparison of Nrf2 protein expression in each group (n=3)**P<0.01 vs si-con group.
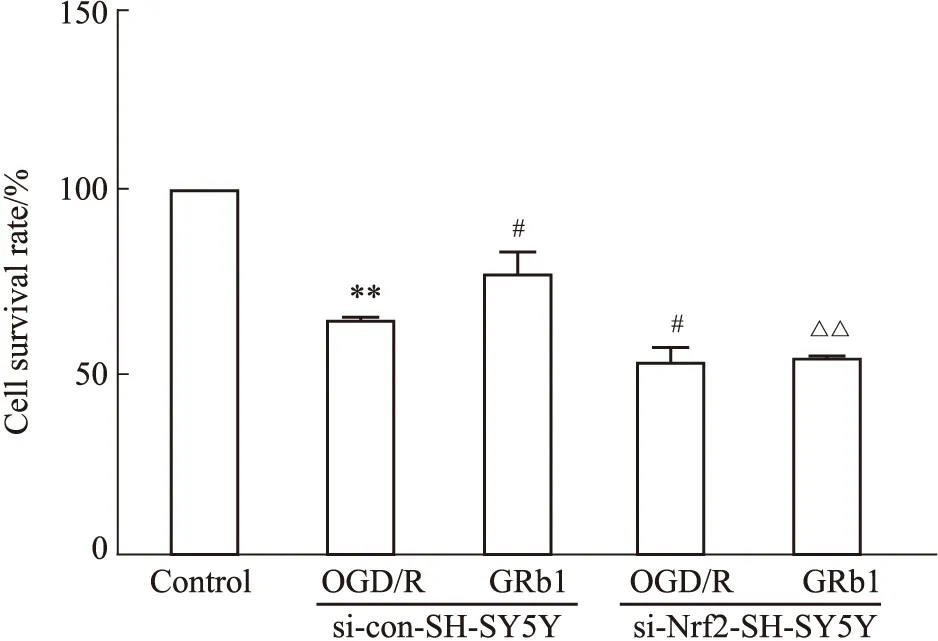
Fig 3 Comparison of cell survival rate in each group (n=8)**P<0.01 vs si-con-SH-SY5Y control group;#P<0.05 vs si-con-SH-SY5Y OGD/R group;△△P<0.01 vs si-con-SH-SY5Y GRb1 group.
2.4 人参皂苷Rb1对OGD/R后SH-SY5Y细胞焦亡的影响si-con-SH-SY5Y细胞OGD/R后,LDH漏出率(Fig4A)、Hoechst/PI荧光强度(Fig4B)和焦亡蛋白caspase-1表达(Fig4C、4D)增加(P<0.05,P<0.01)。与si-con-SH-SY5Y细胞OGD/R组比较,si-Nrf2-SH-SY5Y细胞OGD/R后LDH漏出率、Hoechst/PI荧光强度和焦亡蛋白caspase-1的表达增加(P<0.05,P<0.01)。
与si-con-SH-SY5Y细胞OGD/R组比较,si-con-SH-SY5Y细胞人参皂苷Rb1组LDH漏出率、Hoechst/PI荧光强度和焦亡蛋白caspase-1的表达降低(P<0.05,P<0.01)。与si-con-SH-SY5Y细胞人参皂苷Rb1组比较,si-Nrf2-SH-SY5Y细胞人参皂苷Rb1组LDH漏出率、Hoechst/PI荧光强度和焦亡蛋白caspase-1的表达均升高(P<0.01)。
2.5 人参皂苷Rb1对OGD/R后SH-SY5Y细胞Nrf2/ARE信号通路的影响si-con-SH-SY5Y细胞OGD/R后,活化Nrf2蛋白(磷酸化Nrf2蛋白)荧光表达(Fig5A)、全细胞Nrf2(Fig5B)和HO-1(Fig5C)蛋白表达增加(P<0.05,P<0.01)。与si-con-SH-SY5Y细胞OGD/R组比较,si-Nrf2-SH-SY5Y细胞OGD/R组活化Nrf2蛋白荧光表达和全细胞Nrf2蛋白表达水平降低(P<0.05,P<0.01)。

Fig 4 Effect of ginsenoside Rb1 on Pyroptosis of SH-SY5Y cells after OGD/R(A)Comparison of LDH release rate in each group (n=8).(B)Comparison of double-fluorescent staining with PI (red),and Hoechst (green)in each group (n=5).(C)Comparison of double-fluorescent staining with caspase-1 (red)siRNA (green)and DAPI (blue)in each group (n=5).(D)Comparison of protein levels of caspase-1 in each group (n=3).*P<0.05,**P<0.01 vs si-con-SH-SY5Y control group;#P<0.05,##P<0.01 vs si-con-SH-SY5Y OGD/R group;△△P<0.01 vs si-con-SH-SY5Y GRb1group.
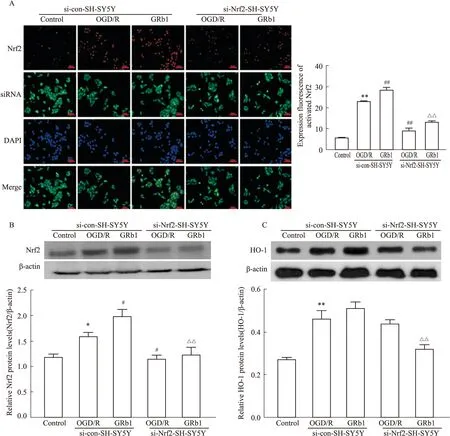
Fig 5 Effect of ginsenoside Rb1 on Nrf2 /ARE signaling pathway in SH-SY5Y cells after OGD/R(A)Comparison of double-fluorescent staining with activated Nrf2 (red),siRNA (green)and DAPI (blue)in each group (n=5).(B)Comparison of protein levels of Nrf2in each group (n=3).(C)Comparison of protein levels of HO-1 in each group(n=3).*P<0.01,**P<0.01 vs si-con-SH-SY5Y control group;#P<0.05,##P<0.01 vs si-con-SH-SY5Y OGD/R group;△△P<0.01 vs si-con-SH-SY5Y GRb1 group.
与si-con-SH-SY5Y细胞OGD/R组比较,si-con-SH-SY5Y细胞人参皂苷Rb1组的活化Nrf2蛋白荧光表达和全细胞Nrf2蛋白表达增加(P<0.05,P<0.01)。与si-con-SH-SY5Y细胞人参皂苷Rb1组比较,si-Nrf2-SH-SY5Y细胞人参皂苷Rb1组的活化Nrf2蛋白荧光表达、全细胞Nrf2和HO-1蛋白表达降低(P<0.01)。
3 讨论
炎症反应是脑缺血/再灌注一系列损伤级联反应中的重要机制,阻断炎症反应是改善缺血/再灌注脑损伤的理想策略。细胞焦亡是一种典型依赖于炎症的程序性细胞死亡方式,caspase-1介导的经典细胞焦亡途径参与了脑缺血/再灌注损伤的过程[3]。细胞焦亡时,质膜破裂形成小孔,有利于能够穿透细胞膜的细胞染料穿过焦亡细胞,嵌入细胞核DNA,使其染色阳性。PI是一种可以嵌合到双链DNA和RNA的碱基对中并与之结合的荧光染料,无碱基特异性,仅能通过受损的细胞膜显示红光。焦亡细胞的胞膜完整性消失,细胞渗透性肿胀,胞内物质流出,如LDH和炎性细胞因子释放。caspase-1为经典焦亡途径的关键分子,其活化反映了焦亡发生。因此,Hoechst/PI染色、LDH漏出及caspase-1的活化广泛用于检测焦亡的发生[7]。
Nrf2/ARE抗氧化信号通路是机体重要的内源性抗氧化机制,在生理状态下,Nrf2与胞质伴侣蛋白Kelch样环氧氯丙烷相关蛋白-1(Kelch-like ECH2 associated protein-1,Keap-1)结合,且被泛素蛋白酶迅速降解,处于相对抑制状态并被锚定在胞质中。当机体受到氧自由基和内源性毒素等攻击时,Nrf2与Keap-l解偶联,转位进入细胞核,与ARE相结合,从而启动下游抗氧化基因和一系列II相解毒酶如血红素氧合酶-1(hemeOxy-genase-1,HO-1)、谷胱甘肽-S-转移酶(glutathione S-transferase,GST)和醌氧化还原酶1(NADPH quinine oxidoreductase,NQO1)等的表达。研究表明Nrf2是Nrf2/ARE抗氧化信号通路的关键因子,对细胞焦亡发挥着重要的负调控作用[8-9]。
本研究结果表明在氧糖剥夺/复氧后细胞存活率下降,LDH漏出率、Hoechst/PI荧光表达、焦亡蛋白caspase-1的表达均增高,这提示细胞焦亡参与了氧糖剥夺/复氧后细胞的损伤。进一步应用siRNA 干扰技术成功构建siRNA Nrf2的SH-SY5Y细胞模型。研究结果发现氧糖剥夺/复氧后,Nrf2/ARE抗氧化信号通路关键分子Nrf2和HO-1的表达明显增加,表明氧糖剥夺/复氧的刺激激活了细胞内Nrf2/ARE信号通路。当Nrf2基因沉默后,细胞焦亡以及细胞损伤显著加重,表明沉黙Nrf2基因后增强细胞焦亡,促进细胞损伤。这提示Nrf2作为Nrf2/ARE抗氧化信号通路的关键因子,可通过负调控氧糖剥夺/复氧后细胞焦亡,从而抑制细胞的损伤。
人参皂苷Rb1是人参二醇系皂苷,属于达玛烷型三萜皂苷类化合物,其主要分布在五加科人参属植物中,如三七、人参等。目前研究发现人参皂苷Rb1在中枢神经系统疾病中有着较强的药理活性,能够通过多环节、多途径、多靶点的作用方式抗脑缺血/再灌注损伤。其中,抗炎症反应与抗氧化应激是人参皂苷Rb1发挥对脑缺血/再灌注损伤后神经功能保护作用的重要机制[10-12]。本研究结果发现人参皂苷Rb1能够提高氧糖剥夺/复氧后细胞存活率,降低细胞LDH漏出率、Hoechst/PI荧光表达、焦亡蛋白caspase-1的表达,表明人参皂苷Rb1具有抗细胞焦亡的效应。人参皂苷Rb1能上调全细胞Nrf2蛋白和活化Nrf2蛋白表达,维持HO-1的高表达水平,表明人参皂苷Rb1可激活细胞Nrf2/ARE信号通路。当Nrf2基因沉默后,人参皂苷Rb1对Nrf2/HO-1信号通路的激活作用减弱,且人参皂苷Rb1抗细胞损伤和细胞焦亡的效应减弱。这一结果提示人参皂苷Rb1可能是通过调控Nrf2/ARE抗氧化信号通路,而发挥抗细胞焦亡的作用。
综上所述,本研究结果表明细胞焦亡参与了氧糖剥夺/复氧后细胞损伤,人参皂苷Rb1可通过抑制OGD/R后细胞焦亡,从而发挥对细胞保护作用。其作用机制与调控Nrf2/ARE抗氧化信号通路密切相关。

