胰体尾切除术后胰瘘发生率及其影响因素分析
王健,魏伏,段东峰,惠立良,王成果,鲁建国
[1.中国人民解放军空军军医大学第二附属医院普通外科,陕西西安710038;2.陕西省西安市人民医院(西安市第四医院) 重症医学科,陕西西安710004]
胰腺体尾部肿瘤包括:胰腺囊性肿瘤、胰腺癌、胰腺神经内分泌肿瘤、胰腺转移癌,其中胰体尾部癌约占胰腺癌的20%~25%[1],因发病隐匿、手术切除率低[2-3]、化疗敏感性差[4]、恶性程度高[5]等因素导致其预后较差,目前胰腺癌的发病率呈上升趋势[6],且5年总体生存率仅为8%[7]。胰体尾切除术(distal pancreatectomy,DP)是治疗胰腺体尾部肿瘤的标准手术方式[8-9]。 术后胰瘘(postoperative pancreatic fistula,POPF)是DP 术后最常见并发症,发生率为20%~30%[10],常常继发腹腔感染[11]、出血等严重并发症,术后胰瘘作为术后严重并发症的始动因素,且具有导致并发症呈次联反应的风险,其与患者的预后及转归有着密切的关系。本研究回顾性分析2015年1月—2021年2月中国人民解放军空军军医大学第二附属医院胰腺专业组收治的99 例因胰腺肿瘤行DP 术患者的临床病理资料,拟讨论DP 术后胰瘘发生率及其影响因素,旨在为临床提供一定的理论依据。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月—2021年2月中国人民解放军空军军医大学第二附属医院胰腺专业组收治的99 例因胰腺肿瘤行DP 术患者的临床资料。纳入标准:(1)经影像学评估诊断为胰腺体尾部肿瘤。包括:胰腺癌、胰腺囊性肿瘤、胰腺神经内分泌肿瘤,胰腺转移癌;(2)经影像学评估无远处转移且肿瘤可切除。排除标准:(1)合并严重心肺疾病;(2)合并其他慢性脏器功能不全;(3)胰头部肿瘤或需行胰十二指肠切除(PD)或全胰切除;(4)术中发现远处转移,仅行腹腔探查。
1.2 方法
1.2.1 手术治疗所有纳入病例均行DP 术,根据不同肿瘤性质,决定是否联合脾脏切除,如:胰体尾部癌、胰腺囊腺癌、胰腺转移癌,手术过程遵循胰体尾部癌的相关标准,同时行标准淋巴结清扫。如浆液性囊腺瘤,经术中冷冻排除恶性病变,行保留脾脏的胰体尾切除术。手术方式包括:腹腔镜、腹腔镜辅助、开腹、达芬奇。胰腺残端闭合方式两种:(1)通过闭合器离断,据胰颈厚度选择合适的钉仓。(2)通过手工缝合,超声刀离断,寻找主胰管,行主胰管“8”字缝合+胰腺残端不可吸收线缝合。
1.2.2 术后引流液淀粉酶检测术后胰腺残端常规放置腹腔引流管。生长抑素及其类似物术后常规预防使用。术后第1 天常规检测血常规、凝血系列、肝肾功电解质。术后第3 天测腹腔引流液淀粉酶,各根引流管分别检测,其中以高值为当天引流液淀粉酶值,用于胰瘘诊断。
1.2.3 观察指标胰体尾切除术后胰瘘发生率情况:生化漏发生率、B 级胰瘘发生率、C 级胰瘘发生率。胰体尾切除术后B 级、C 级胰瘘治疗情况。影响胰体尾切除术后胰瘘发生相关因素分析。
1.2.4 评价标准胰瘘诊断依据国际胰瘘学组(ISGPF) 2017年发布标准[12]。胰瘘是胰腺导管上皮与其他上皮表面的异常通道,内含源自胰腺富含酶类的液体。诊断标准:术后≥3 d 任意量的引流液中淀粉酶浓度高于本机构正常血清淀粉酶浓度上限的3 倍以上。根据临床诊断、治疗策略的改变、及患者转归,将胰瘘严重程度分成3 级,并对应相应的治疗策略及临床转归。
1.3 统计学处理
应用SPSS 20.0 软件进行分析,计量资料以均数±标准差(±s) 或中位数(四分位数间距)[M(IQR)]表示,计数资料采用频数(百分比)[n(%)]表示。单因素分析中计量资料用LSD-t检验或Mann-WhitneyU检验分析,计数资料分析用χ2或Fisher 精确检验。将单因素分析中P<0.10 的连续数据通过基于最大Youden 指数的受试者工作特征曲 线(receiver operating characteristic curve, ROC)寻找最佳界点而获取分组。单因素分析中P<0.05或者被认为有临床意义的变量将被纳入非条件二分类Logistic 回归进行多因素分析,结果用比值比(odd radio,OR) 及95%置信区间(confidence interval,CI)表示。P<0.05 为差异有统计学意义。
2 结 果
2.1 DP术后胰瘘发生率情况
99例患者行DP术后,生化漏发生率为34.3%(34/99),B 级胰瘘发生率18.2% (18/99),C 级胰瘘发生率1.0%(1/99)。
2.2 DP术后胰瘘治疗情况
18 例DP 术后B 级胰瘘患者中,15 例患者经积极保守治疗,均顺利康复。3 例患者出现发热,2 例患者行超声提示腹腔包裹性积液,1 例患者行CT 提示胰腺周围包裹性积液,均行B 超引导下腹腔穿刺置管引流,后经保守治疗康复出院。1 例C 级胰瘘患者因腹腔出血经历再次手术,术后经积极治疗顺利康复出院。
2.3 DP术后胰瘘的影响因素分析
单因素分析结果示,年龄、手术时间、胰管直径及是否联合脾切可能与胰瘘发生有关(均P<0.05),而其余的术前、术中及术后资料在两组间差异无统计学意义(均P>0.05)(表1-3)。通过ROC 曲线分析,找到年龄、手术时间及胰管直径最佳界点值分别为42.5 岁、252.5 min、0.185 cm,再次行单因素分析,结果仍均有统计学意义(均P<0.05)(表4)。多因素分析结果表明,年龄<42 岁(OR=0.955,95%CI=0.914~0.998)、手术时间≥253 min(OR=1.013,95%CI=1.005~1.021)及联合脾切术(OR=4.152,95%CI=1.043~16.535)是DP 术后胰瘘的独立危险因素(均P<0.05)(表5)。

表1 胰瘘与无胰瘘患者临床基本特征比较Table 1 Comparison of the general characteristics between patients with and without pancreatic fistula
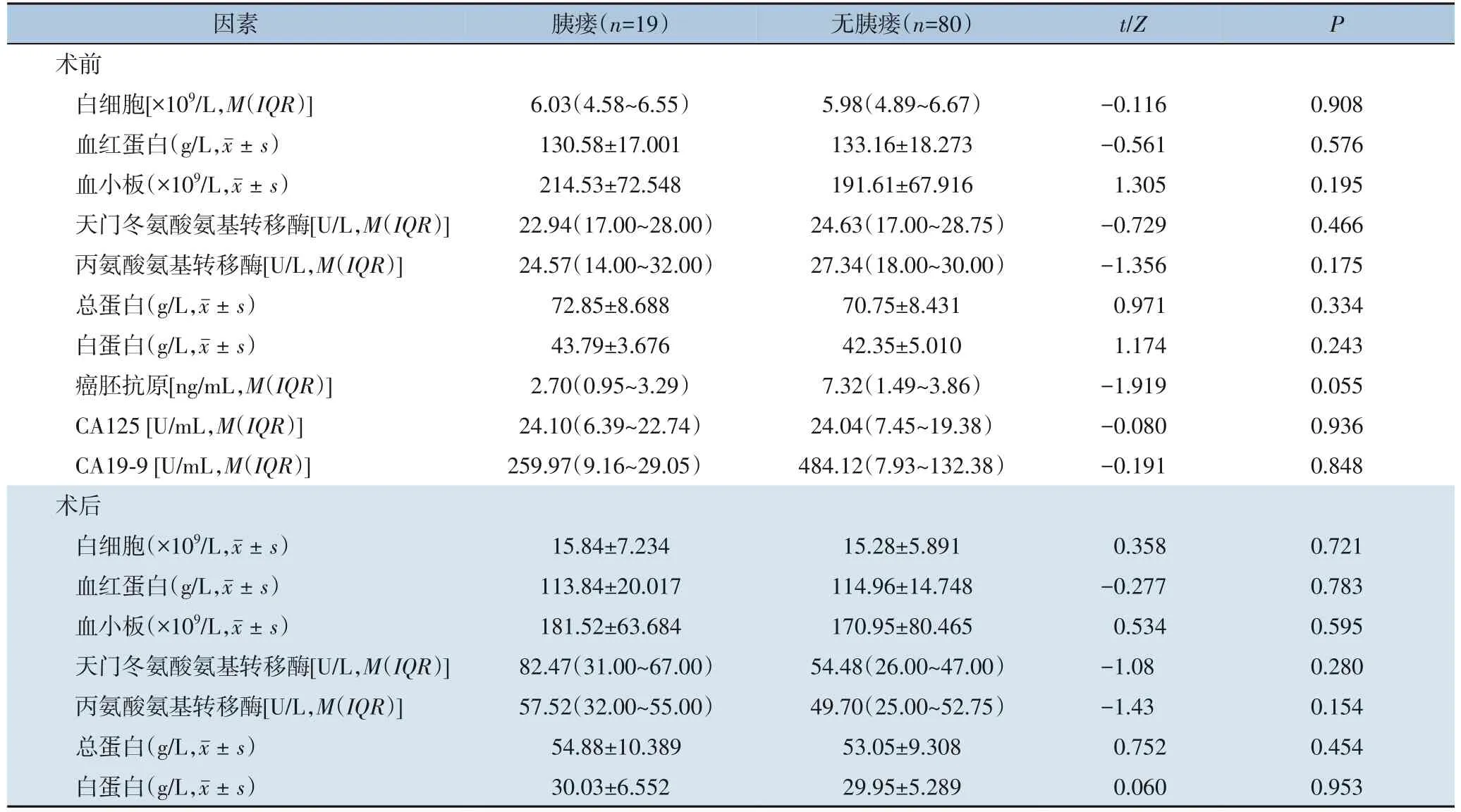
表2 胰瘘与无胰瘘患者术前及术后生化指标比较Table 2 Comparison of pre-and postoperative biochemical parameters between patients with and without pancreatic fistula
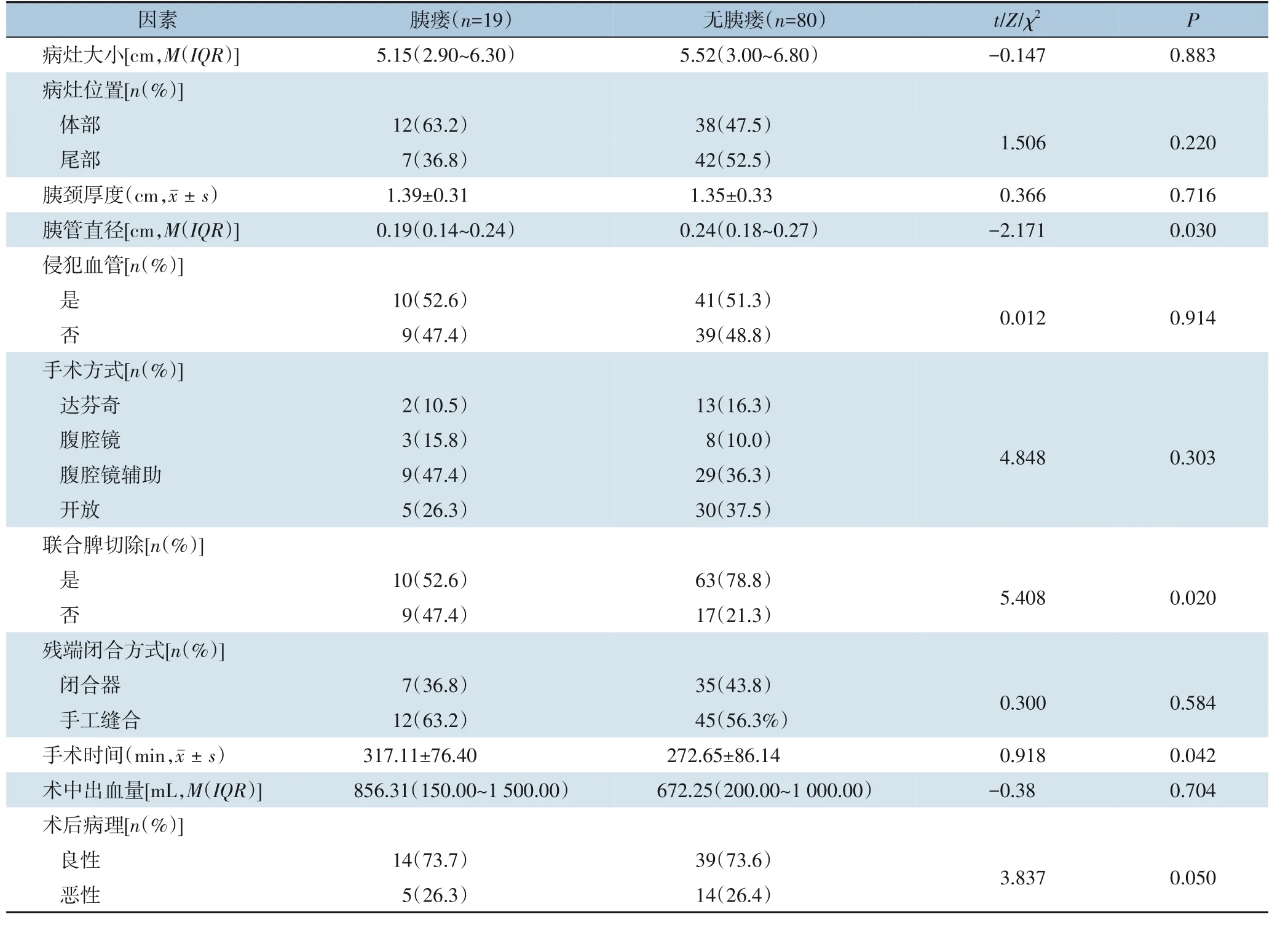
表3 胰瘘与无胰瘘患者手术相关资料比较Table 3 Comparison of the relevant surgical variables between patients with and without pancreatic fistula
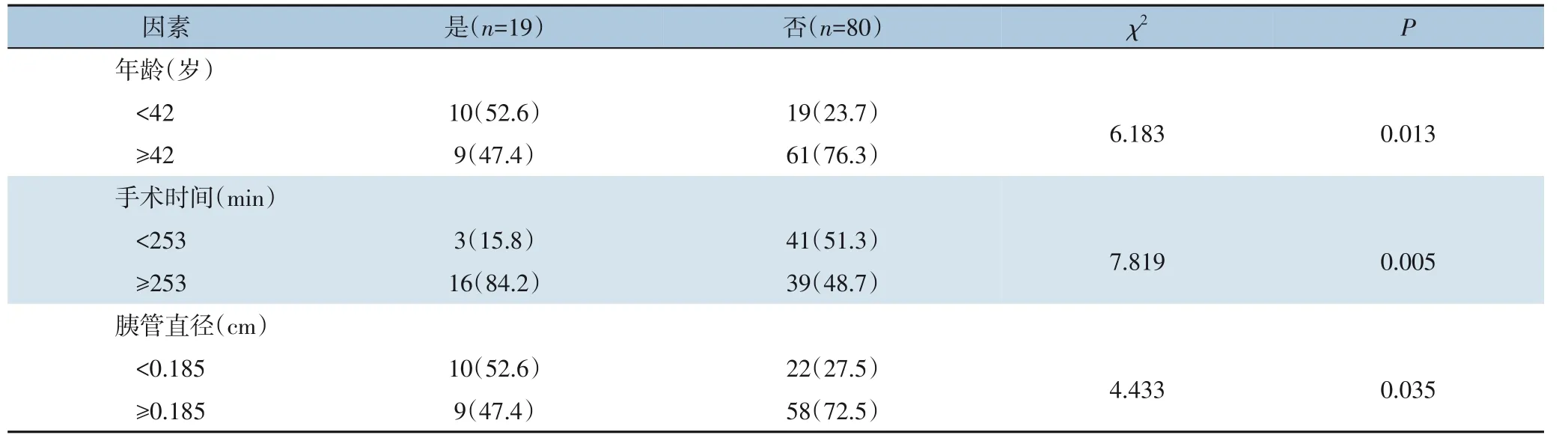
表4 胰瘘与无胰瘘患者年龄、手术时间、胰管直径按最佳界点值分层比较[n(%)]Table 4 Stratified comparison of age,operative time and pancreatic duct diameter between patients with and without pancre‐atic fistula[n(%)]
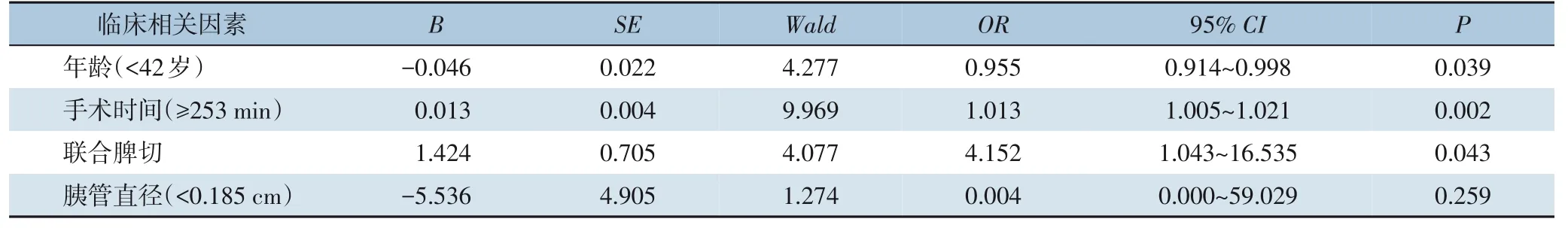
表5 影响术后胰瘘的多因素分析Table 5 Multivariate analysis of factors for postoperative pancreatic fistula
3 讨 论
胰瘘是DP 术后常见且严重的并发症,发生率为20%~30%,高于PD 术[13-16]。这往往和术后胰瘘的临床危险因素有着密不可分的关系。因此术后胰瘘的危险因素和减少其发生的有效措施是临床的关注点,本研究对POPF 发生可能的相关危险因素进行纵向分析,旨在探索POPF 发生的独立危险因素,为临床制定减少其发生的有效措施提供一定的理论依据。
本研究共纳入99 例行DP 手术的病例,其中临床相关的术后胰瘘(clinically relevant postoperative pancreatic fistula,CR-POPF)发生率为19.2%(19/99),本研究中术后胰瘘的发生率低于部分文献报道[10]。许多研究表明,众多的患者相关因素(年龄[17-18]、性别[19]、体质量指数[20]、糖尿病[21])及手术相关的因素(胰腺质地[22-23]、胰腺厚度[21,24],手术时间[25-27]、联合脾脏切除[27]、术中出血量[27]、淋巴结清扫[1]、开放手术[28])被报道为DP 术后胰瘘的危险因素。本研究结果表明年龄是术后胰瘘的独立危险因素之一,年龄<42 岁患者胰瘘发生风险增大。Yoshioka 等[17]的研究结果显示年龄<65 岁是术后胰瘘的独立危险因素。同样,在Eguchi 等[18]的研究中也提示年龄偏小是术后胰瘘的独立危险因素。本研究及上述研究结果均提示年龄越小,术后胰瘘的发生率越高,究其原因可能与胰腺外分泌功能的年龄依赖性下降有关。然而,我们的研究结果中发生胰瘘的年龄界点(42 岁)比Yoshioka 等[17]的年龄界点(65 岁)更小,究其原因可能与研究所纳病例年龄分布及样本量有一定的关系。但均提示在临床中行DP 手术时,面对年龄更小的患者,需提高警惕,积极采取预防措施以减少胰瘘的发生。
手术时间被认为是DP 术后胰瘘发生的重要危险因素,本研究中,手术时间≥253 min 组的术后胰瘘发生率为84.2%(16/19),多因素分析结果显示手术时间≥253 min、联合脾切是胰瘘的独立危险因素,与以往研究结果一致;一项包含302 例DP 患者的回顾性研究[29]结果显示较长的手术时间(超过480 min)与较高的胰瘘发生率相关;一项纳入2 070 例病例的Meta 分析认为手术时间延长会增加术后胰瘘的风险[26]。手术时间的延长归因于各种与手术操作有关的因素,例如肿瘤分期较晚、淋巴结清扫、术中出血量多、联合脾脏切除等;其次,更长的手术时间可能预示着更复杂或更困难的手术。因此,在DP 术中,精细、准确的操作有助于控制手术时间,这将对减少胰瘘的发生有极为重要的意义。
临床相关性胰瘘需要胰腺外科医师快速识别并加以干预,以避免严重并发症的发生。对于DP术后胰瘘的预测一直是胰腺外科医师的关注点,风险识别和风险分层可能会有助于预防术后胰瘘,因此,更为准确的风险预测模型或评分系统的创建是亟需解决的问题。
本研究仍存在一定的局限性。首先,本研究是单中心、回顾性的,因此,可能存在一定的偏倚;其次,研究样本量较少,可能一些临床重要数据未被纳入,因此,可能需要更多多中心、前瞻性随机对照试验研究进一步验证,为临床提供更高级别的循证医学证据。
综上,年龄、手术时间、联合脾切是DP 术后胰瘘的独立危险因素。这些危险因素对术后胰瘘的风险预测模型或评分系统的建立提供一定的依据,同时为临床医生筛选出高危胰瘘患者提供一定的帮助,对临床工作有极为重要的指导意义。

