重症急性胰腺炎感染期脓肿处理方式的选择:附5例报告
彭程,臧龙军,李志强,朱红伟,陈浪,孙吉春,聂晚频,余枭
(中南大学湘雅三医院肝胆胰外科II,湖南长沙410013)
急性胰腺炎(acute pancreatitis,AP)是消化系统常见疾病,发病率逐年升高,总体病死率为5%,重症急性胰腺炎(severe acute pancreatitis,SAP) 病死率更高[1-2]。中度重症急性胰腺炎患者(moderately severe acute pancreatitis,MSAP) 和SAP患者常合并胰腺感染坏死(infected pancreatic necrosis,IPN)[3-4]。更重要的是,70%~80%的SAP患者死亡因素与胰腺感染相关[5],这是AP 治疗中比较棘手的情况,尽早清除感染灶是治疗的关键,但近年来其外科干预方式一直是个存在争议的话题。清创强度逐级递增的进阶式(step-up)策略旨在避免对机体产生“二次打击”的基础上,通过多次逐级递增的微创外科干预,降低胰腺感染坏死的负荷,已被广泛接受并应用[6-7],多中心也报道了进阶式策略的优越性[8-11]。然而,患者的个体化特征是临床实践中不能忽视的问题[12],进阶式策略并不能使所有患者受益,对于特定的患者,跳跃式(skip-up)策略也许更能提供救治机会[6]。本中心在2018年4月30日—2021年4月30日间共收治AP 患者315 例,其中SAP 患者48 例,SAP 合并IPN 共35 例,24 例采用进阶式策略治疗(根据病情选择外科进阶式、内镜进阶式或两者联合,19 例成功,5 例死亡),11 例采用跳跃式策略治疗(10 例成功,1 例死亡)。本文对其中5 例具有代表性的SAP 合并IPN 患者的临床特征、诊疗经过、腹部CT 影像学变化进行总结,并复习国内外文献,以期加强临床医生对该病的认识,现报告如下。
1 病例资料
患者1 女,54 岁。因上腹部持续性胀痛,伴恶心、呕吐1 d,于2020年11月26日入院,急诊CT 提示急性胰腺炎,未见胆道系统疾病,化验提示淀粉酶22 900 U/L、血白细胞14.76×109/L,降钙素原5.762 ng/mL,血钙1.92 mmol/L,甘油三酯23.05 mmol/L,总胆固醇22.99 mmol/L,血气分析提示pH=7.27,乳酸2.2 mmol/L,实际碳酸氢根14.1 mmol/L。降钙素原5.76 ng/mL,肌酐169 μ mol/L,尿素11.33 mmol/L,以“急性胰腺炎(高脂血症型),急性肾功能不全”收入我院重症医学科。入院体检:急性病容,体温38.0 ℃,脉搏108 次/min,呼吸25 次/min,血压136/78 mmHg(1 mmHg=0.133 kPa)。腹部膨隆,肠鸣音减弱,约2 次/min,中上腹压痛,伴反跳痛和肌紧张。予以液体复苏、抑酸、抑酶、保肝、镇静、CRRT 等对症支持治疗,并于入院当天在床旁超声引导下留置腹腔引流管1 根。入院第21 天,患者生命体征平稳,转入肝胆胰外科进一步治疗。复查提示血白细胞14.57×109/L,降钙素原2.185 ng/mL, 肌 酐431 μmol/L,尿素34.14 mmol/L,暂给予哌拉西林他唑巴坦、营养支持、间断血滤等治疗,患者仍存在间歇性低热,入院第26 天复查腹部CT,提示胰头部密度减低,胰周脂肪间隙大片渗出,较前明显增加,部分包裹,气泡征阳性,遂于入院第30 天,行超声内镜下胰腺脓肿-胃支架置入术及彩超引导下经皮胰腺脓肿穿刺引流术,并于入院第37、40 天分别行内镜下胰腺脓肿清创引流术,手术顺利,患者病情好转,于入院第42 天出院,出院后2 周来院复查腹部CT 提示腹腔包裹性积液较前进一步减少。患者CT 影像学变化见图1。
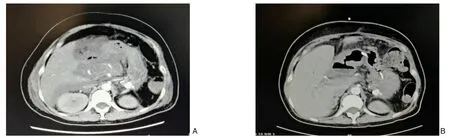
图1 患者1的CT影像学变化 A:胰腺明显肿胀,增强扫描可见片状低密度区,周围脂肪间隙有大量渗出和积液;B:原腹腔积液较前明显减少Figure 1 Changes in CT findings in case 1 A:Severe swelling of the pancreas,and low-density lesions of pancreatic parenchy‐ma on contrast-enhanced CT, with a large amount of exudation and collection in the peripancreatic fat space; B: Markedly reduced size of the previous peritoneal collection
患者2 女,44 岁。因上腹部持续性胀痛,伴恶心、呕吐4 d,于2020年3月23日入院。急诊CT 提示急性胰腺炎,化验提示血甘油三酯44.12 mmol/L,总胆固醇18.07 mmol/L,血气分析提示标准碳酸氢根21.3 mmol/L,CO2分压33.3 mmHg,O2分压86.6 mmHg,遂以“急性胰腺炎(高脂血症型)”收入我院重症医学科。入院体检:急性病容,体温38.6 ℃,脉搏121 次/min,呼吸28 次/min,血压172/88 mmHg。腹部膨隆,肠鸣音减弱,约1 次/min,左上腹、中上腹压痛、反跳痛伴肌紧张。入院化验:白细胞12.83×109/L,总淀粉酶184 U/L,胰淀粉酶158 U/L,降钙素原0.16 ng/mL,白蛋白23.2 g/L。给予营养支持、吸氧、哌拉西林他唑巴坦、血浆置换、吸氧、抑酸、抑酶等对症支持治疗后,患者基本情况好转,但仍存在间歇性发热,于入院第15 天转入肝胆胰外科治疗并于当日留置右髂窝引流管1 枚。入院第21 天,患者发热,血白细胞升高至20×109/L,中性粒细胞比例92.1%,CRP>8.29 mg/L,复查全腹CT 提示胰腺多处斑片状低密度灶,胰周、左侧和右侧结肠旁沟、腹盆腔渗出,部分呈不完全包裹状,腹腔积液细菌培养阳性,为肺炎克雷伯菌,根据药敏试验将抗生素调整为美罗培南。于入院第22天行胆道镜下腹膜后脓肿清创术。入院第24天,患者因腹内压升高、高热寒战、呼吸困难、血压下降转入重症医学科治疗,入院第25 天在内镜下行胃-腹膜后脓肿支架置入术+脓肿清创术,好转后于入院第28 天再次转回肝胆胰外科治疗,随后,分别在入院第29、36、44、51、58、62 天行胆道镜下腹膜后脓肿清创术。入院第63 天,患者精神状态差,心率124 次/min,血氧饱和度84%~96%,呼吸36 次/min,血压106/68 mmHg,体温间歇性升高,再次转入重症医学科,患者家属放弃治疗。患者2 CT 影像学变化见图2。
患者3 男,46 岁。因中上腹痛,伴尿量逐渐减少2 d 就诊于当地医院,腹部CT 提示急性胰腺炎,化验提示肾功能衰竭,遂就诊于我院,以“重症急性胰腺炎”收入我院重症医学科。入院体检:急性病容,体温37 ℃,脉搏132 次/min,呼吸24 次/min,血压135/58 mmHg。腹部膨隆,肠鸣音4 次/min,中上腹压痛,伴反跳痛及肌紧张。入院化验:CRP 291.47 mg/L,白细胞8.7×109/L,降钙素原6.21 ng/mL,中性粒细胞比例88%,白蛋白29 g/L,肌酐258 μ mol/L,尿素11.93 mmol/L,总淀粉酶1 750 U/L,胰淀粉酶1 537 U/L,甘油三酯3.41 mmol/L。血气分析:pH=7.35,标准碳酸氢根16.9 mmol/L,CO2分压31.8 mmHg,乳酸2.3 mmol/L。予以气管插管、镇静、禁食、抑酶、营养支持、哌拉西林他唑巴坦等对症支持治疗后病情平稳,转入肝胆胰外科继续治疗。入院第16 天,患者发热,腹部增强CT 提示胰腺不规则低、无强化区,胰周、胃周、左侧结肠旁沟及部分肠管间可见不规则渗出,部分包裹,遂行超声引导下腹腔脓肿穿刺引流术,细菌培养阳性,为屎肠球菌,根据药敏试验将抗生素调整为替考拉宁。入院第35 天,行CT 引导下腹腔脓肿穿刺引流术,患者持续发热,以中度热为主,全腹CT 提示腹腔仍有多处脓腔,遂决定行传统开腹胰腺坏死组织清除+低负压持续冲洗引流术,患者及家属拒绝开放手术。入院第44 天,行内镜下经胃壁胰腺囊肿支架置入内引流术,体温基本恢复正常,入院第47、50 天行内镜下胰腺脓肿清创术,经鼻胰腺穿刺引流管持续冲洗脓腔,入院第51 天再次发热,最高体温39.1 ℃,于入院第54 天再次内镜下清创,发现腔内有黄色肠内容物,第55 天至第59 天,腹腔引流管出现红色浑浊坏死组织,60 d 时引流液变成脓性,患者再次发热,体温达39 ℃,入院第64 天,复查全腹CT 提示胰腺、腹腔及腹膜后大量坏死性积聚及包裹性坏死,于入院第65 天,行CT 引导下左侧及右侧囊肿穿刺引流,引流出大量脓性液体,引流管持续冲洗,入院第70 天,患者左侧引流管再次出现红色浑浊坏死组织,于入院第78、84、85、89、93、94 天行内镜下经胃壁胰腺囊肿清创术,患者病情无显著改善,最终于入院第96 天行剖腹探查、腹腔脓肿清创引流术。入院第108 天,患者再发胰腺出血坏死,可见呕血、解黑便数次,并发急性肾功能衰竭、胸腔积液及肺炎,患者家属放弃治疗。患者3 CT 影像学变化见图3。

图2 患者2的CT影像学变化 A:胰腺肿胀,轮廓模糊,胰周、腹膜后可见大量渗出、积液;B:胰腺肿胀、积液情况大致同前Figure 2 Changes in CT findings in case 2 A: Pancreatic swelling with indistinct margins and extensive exudation and collec‐tion in the peripancreatic and retroperitoneal areas;B:The pancreatic swelling and fluid collection presenting basically the same situations as the previous findings
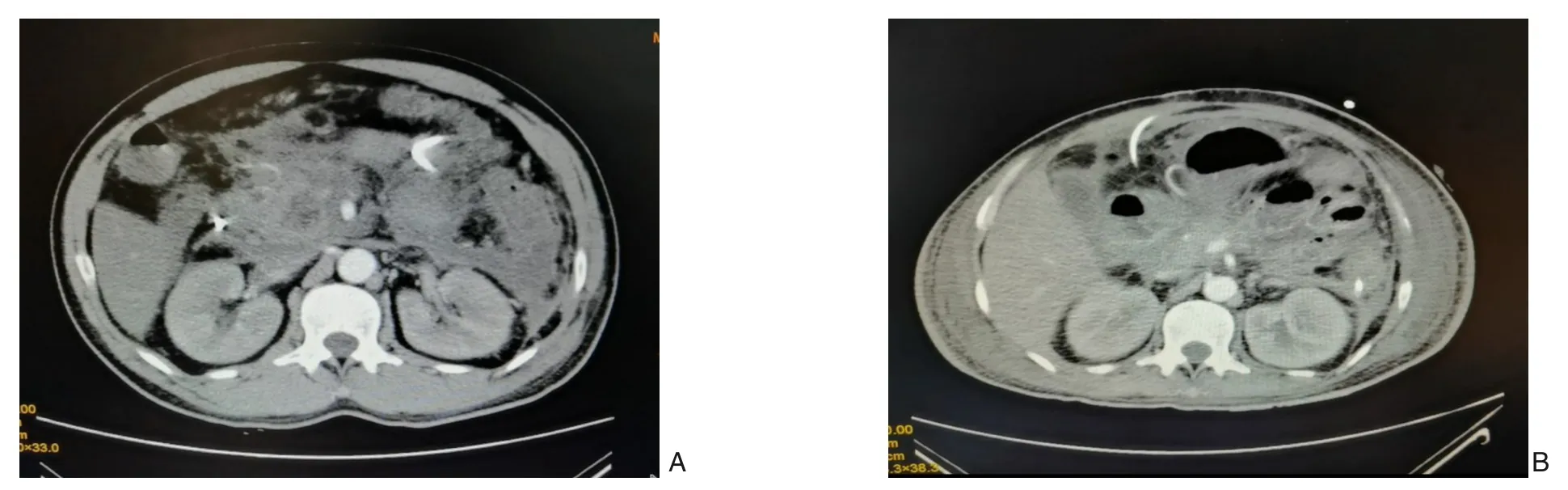
图3 患者3的CT影像学变化 A:胰腺增强CT中可见不规则低、无强化区,胰周、胃周可见絮状不规则渗出灶;B:胰腺增强CT中不规则低、无强化区大致同前,胰周、胃周不规则渗出较前增加,部分呈包裹状Figure 3 Changes in CT findings in case 3 A:Contrast-enhanced CT scan showing the irregular hypoenhanced or non-enhanced lesions in the pancreas, and irregular exudative lesions in the peripancreatic and perigastric regions; B: The irregular hy‐poenhanced and nonenhanced areas of the pancreas on contrast-enhanced CT presenting approximately the same situations as before,and the enlargement with partial encapsulation of the irregular exudation in the peripancreatic and perigastric re‐gion compared with previous findings
患者4 男,45 岁。2 个月前饮酒后出现持续性剧烈上腹痛,伴呼吸急促、困难,就诊于当地医院,以“急性重症胰腺炎”收入重症医学科,给予对症支持治疗后症状缓解。1 个月前出现高热、寒战,体温最高39.5 ℃,腹部CT 提示胰腺假性囊肿,予以穿刺引流,引流物和血培养提示白色念珠菌感染,予以氟康唑联合哌拉西林他唑巴坦治疗后,囊腔未见明显缩小,引流效果不佳,患者存在间歇性发热,遂于2020年6月22日转至我院肝胆胰外科进一步治疗。入院后行腹部CT 检查提示胰头区斑片状低密度影,胰腺和胰周改变考虑坏死性胰腺炎,伴腹腔和腹膜后包裹性坏死,其内可见多发气体密度影。入院第2 天,行CT 引导下腹腔脓肿穿刺引流,术后感染未明显控制,引流液培养提示白假丝酵母菌阳性,根据药敏试验予以氟康唑联合哌拉西林他唑巴坦,结合患者病史及检查结果,考虑微创治疗效果较差,遂于入院第8 天,行开放腹腔脓肿清创引流术,术中清理出大量坏死组织,约300 g,术后持续低负压冲洗引流,恢复尚可,各项化验指标明显好转,病情平稳,于术后第22 天出院。患者4 CT 影像学变化见图4。

图4 患者4的CT影像学变化 A:胰腺肿胀,见斑片状低密度影,周围脂肪间隙模糊,胰周、腹膜后可见多发渗出灶和积液,部分呈包裹状;B:胰腺肿胀减轻,周围脂肪间隙较前清晰,胰周、腹膜后渗出灶和积液较前减少Figure 4 Changes in CT findings in case 4 A: Pancreatic swelling and patchy hypodense areas, indistinct peripancreatic fat space, and multiple exudative lesions and collection with partial encapsulation in the peripancreatic and retroperitoneal ar‐eas;B:Relieved pancreatic swelling,the clearer peripancreatic fat space than before,and reduced exudative lesions and col‐lection in the peripancreatic and retroperitoneal region
患者5 男,37 岁。因上腹部胀痛逐渐加重,伴全身大汗2 d 就诊于当地医院,化验提示血甘油三酯21.1 mmol/L,尿淀粉酶9 039 U/L,CT 提示急性胰腺炎并胰周渗出,予以对症处理后,症状未见好转,伴气促,尿量减少至100 mL/d。为求进一步诊治,于2020年8月20日就诊于我院,以“重症急性胰腺炎”收入我院重症医学科。入院体检:体温39.3 ℃,脉搏167 次/min,呼吸22 次/min,血压151/108 mmHg,腹部膨隆,腹式呼吸消失,腹肌紧张,上腹部压痛伴反跳痛。血气分析提示氧分压50.2 mmHg,CO2分压25.7 mmHg。化验提示血肌 酐548 μmol/L, CRP 320.72 mg/L,降钙素原1.202 ng/mL,白细胞10.96×109/L,中性粒细胞比例86.6%。给予高流量吸氧、血液净化、哌拉西林他唑巴坦抗感染、腹腔穿刺引流、营养支持等治疗后患者病情逐渐平稳,但仍有间歇性高热,入院第26 天复查腹部CT 提示:胰腺多发低密度区、强化减低,胰周及腹腔多发坏死性液体积聚,并腹膜炎、腹腔积液、肠系膜及门静脉汇合处受累变窄,十二指肠炎性水肿,腹腔引流液培养阳性,为屎肠球菌,根据药敏试验予以头孢哌酮舒巴坦。入院第28 天,患者再次出现发热,体温最高38.3 ℃,伴气促,血氧饱和度89%,复查血常规提示血红蛋白降至60 g/L,行右下腹穿刺置管引流,1 h 内引流出750 mL 红褐色血性液体,夹闭引流管,输红细胞悬液4 单位后血红蛋白上升至82 g/L,循环稳定。次日复查腹部CT 提示:胰周及腹腔多发包裹性坏死,积血较前增多,右肾下极前方间隙-右结肠旁沟区域病灶伴活动性出血可能。考虑患者病情危急,与家属充分沟通后,于入院第30 天行剖腹探查+胰周坏死组织清除+持续低负压冲洗引流术(图5),术后恢复尚可,于入院第56 天转回肝胆胰外科治疗,入院第66 天,行右侧腹膜后脓肿穿刺引流术,入院第76 天,行胆道镜下脓肿清创引流术,入院第86 天起,患者出现持续低热,腹部CT 提示腹腔积液及坏死性积聚局部范围部分较前进展,遂于入院第89 天,再次行开放腹膜后脓肿清除术,术中清除大量坏死组织和脓液。术后1 周复查腹部CT 提示急性出血坏死性胰腺炎治疗后,腹腔积液及坏死性积聚局部范围部分较前减少。2020年12月3日,患者顺利出院,出院后2 周来院复查,腹部CT 提示腹腔积液和坏死性积聚范围较前减少。患者5 CT 影像学变化见图6。

图5 患者5术中照片 A:手术切口;B:术中可见胰周大量坏死组织;C:低负压三腔引流管(自制)Figure 5 Intraoperative views of case 5 A: Surgical incision; B: A large amount of necrotic tissue in the peripancreatic area;C:Low negative pressure and triple-channel catheter(self-designed)
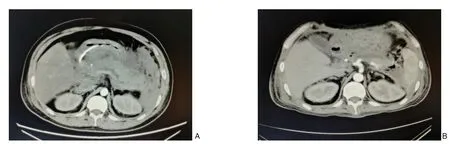
图6 患者5的CT影像学变化 A:胰腺肿胀,增强扫描可见低、无强化区,周围间隙模糊,胰周、腹膜后可见多发渗出灶和积液;B:胰腺轮廓较前清晰,积液、坏死性积聚较前明显吸收减少Figure 6 Changes in CT findings in case 5 A:Contrast-enhanced CT scan showing pancreatic swelling with hypoenhanced and nonenhanced lesions,the blurred peripancreatic fat planes,and multiple exudative lesions and effusions in the peripancreat‐ic and retroperitoneal area;B:The clearer pancreatic margin than before,with reduced necrotic collection
2 讨论并文献复习
SAP 占AP 的20%,病情危重且复杂多变,处理较为棘手,病死率高达30%[13-14]。病程2 周内为急性反应期,可出现休克、呼吸衰竭、肾衰竭、脑病等并发症,是患者的第一个死亡高峰[2,15]。病程2 周后为感染期,初期患者主要表现为全身细菌感染、深部真菌感染或双重感染,后期则表现为腹腔内或腹膜后残余感染,迁延不愈甚至出现消化道瘘,此为患者的第二个死亡高峰[16]。疾病早期加强监护治疗、纠正血流动力学异常、营养支持、防治休克、肺水肿、急性肾功能衰竭、急性呼吸窘迫综合征、脑病等严重并发症是急性反应期的治疗重点,旨在为患者提供充分的对症支持,帮助其度过急性期[17]。对于感染期患者,乃至急性期保守治疗中出现感染或病情发展迅猛的患者,外科干预,即引流和清创,具有不可或缺的作用[18-19]。
过去,治疗SAP 合并IPN 的共识是开放坏死组织清除术,但开腹术后并发症发生率高达34%~95%,病死率为11%~39%,并且可能出现长期的胰腺功能不全[20-21]。近年来,随着微创理念的革新,微创干预手段得到了较快的发展,如超声引导下经皮穿刺引流(percutaneous catheter drainage,PCD)、内镜超声经胃、十二指肠穿刺支架引流(endoscopic transluminal drainage,ETD)、经皮内镜坏死组织清除术(percutaneous endoscopic necrosectomy,PEN)、内镜直视下坏死组织清除术(direct endoscopic necrosectomy,DEN) 以及视频辅助腹腔镜下清创术(video-assisted retroperitoneal debridement,VARD),微创干预的主要优势在于创伤较小、直达病灶、减轻炎症反应和菌血症[21-24],可使90%的IPN 得到完全缓解,是目前推荐的AP合并IPN 的治疗方法[17,25-26]。2010年,进阶式微创引流或清创策略被首次提出[7],即首先进行PCD 或ETD,而后在此基础上进行PEN、DEN 或VARD。该多中心研究显示,对于合并IPN 的AP 患者,进阶式策略相比于开放手术,可以降低患者发生多器官功能衰竭的风险,对这些患者进行了平均86 个月的随访后,结果显示,进阶式组相比于开放手术组,患者病死率、胰腺分泌功能不全、切口疝的发生率均显著降低,结论仍然支持进阶式策略优于开放手术[8]。因此,进阶式策略的优越性体现在避免对机体产生“二次打击”的基础上,通过逐级递增的微创引流策略降低胰腺和胰周的坏死负荷,协同营养支持等内科治疗,帮助患者度过急性期,使坏死区域逐渐局限,实现延期清创并最大可能避免开放清创手术[6,27-28]。然而,微创干预有其局限性,传统的开放胰腺坏死组织清除术(open pancreatic necrosectomy,OPN) 尽管占比逐渐下降,但其在SAP 合并IPN 的治疗中仍具有不可替代的作用,甚至在大型、先进的中心,OPN仍占25%~60%[29-31]。以往认为OPN 的手术时机至少在发病4 周以后,但随着经验的累积和理念的革新,越来越多中心认为不可盲目地推迟手术[32]。2020年美国胃肠协会发布的共识中,已将持续存在感染合并器官功能衰竭患者的外科手术时机由>4 周调整为>2 周[28],对于这部分患者,跳跃式策略也许更能提供救治机会[6]。
本中心近3年来共收治SAP合并IPN的患者35例,本文选取了5 例典型患者,其中3 例采用进阶式策略治疗,2 例采用跳跃式策略治疗,总体可代表本组患者的基本诊疗情况。患者1 为跳跃式策略治疗成功的案例。然而,在临床实践中,笔者发现跳跃式策略并不能使所有患者受益,例如本文中的患者2,患者存在胰周、双侧结肠旁沟、腹盆腔等多部位坏死感染,鉴于IPN 的位置分布,我们采用了以外科进阶式为主的策略,但8 次清创引流的效果并不理想。患者3 同样存在胰周、胃周、左侧结肠旁沟及部分肠管间多处脓腔,采用外科进阶式策略进行2 次引流后,效果较差,无法控制感染,本中心建议患者行OPN,以期通过跳跃式策略缩短病程,控制感染,但患者及家属拒绝,遂先后行11 次引流、清创。患者2 和患者3 都进行了多次的引流、清创,但效果并不理想,不排除在此过程中出现了坏死感染物质吸收、引流不畅造成病情加重,最终两名患者均出现全身状况恶化,患者家属因预后较差、经济原因放弃治疗。对于该2 例患者,多点多次的微创清创引流并没有有效控制感染、阻止疾病的进展,并且显著增加了治疗周期和干预次数,这提示并不能刻板地执行进阶式策略,要讲究个体化治疗[12]。针对这一问题,近年来,有学者提出跳跃式的治疗策略[6],即对于符合指征的患者,可以在进阶式策略的基础上进行“跳跃”,直接进行开放清创,对于早期爆发多器官功能障碍且微创引流无法缓解者,或合并严重并发症(如大出血或肠瘘等),继续刻板执行进阶式策略将延长病程,耽误治疗,而直接开放减压和引流可以抢救患者生命,降低患者的病死率[26]。另一类适合跳跃式策略的患者是腹腔内存在广泛脓腔、微创引流效果较差者,对于这类患者,进阶式策略将显著延长治疗周期、增加患者生理和经济负担,如引流效果较差,还可能再次爆发感染导致患者状态急剧恶化,跳跃式治疗策略对于这类患者,有望在一次手术中彻底清创,缩短患者病情,加速康复。本文中患者4 在经历抗生素及引流治疗效果不佳后,考虑患者感染重、全身状况有恶化趋势、腹腔脓肿广泛分布,遂直接行OPN,术中成功清除大量坏死组织,感染得以迅速控制,患者于术后22 d 出院,恢复良好。患者5 存在腹腔内广泛脓腔且感染症状重,抗生素无法控制感染,且穿刺引流发现患者合并腹腔内出血,遂果断行OPN,解除出血问题并降低坏死负荷,术后辅以数次引流和清创清除残余积脓后患者好转出院。
综上所述,SAP 患者合并IPN 的治疗对临床医生提出了更高的要求,治疗过程中应注重个体化,力求“一人一策”。 进阶式策略可使大部分患者康复,但对于患者出现爆发性器官功能衰竭、严重并发症、重症感染、腹腔内存在广泛脓腔时,切勿刻板执行进阶式策略,在充分评估后可试行跳跃式策略,只有将进阶式和跳跃式策略结合好,才能将SAP 合并IPN 的个体化治疗理念具体落实。

