Gasdermin基因家族在胃癌中的表达及功能的生物信息学分析
李娟妮,徐志杰,胡宽
(中南大学湘雅医院1.病理科2.肝脏外科,湖南长沙410008)
胃癌是是全球最常见的消化道恶性肿瘤之一[1]。而我国又是胃癌高发区,患者数约占全球40%,由于现在生活节奏、饮食习惯的改变,胃癌的发病率呈逐年攀升趋势,其中年轻人的占比也逐渐升高[2]。目前针对胃癌的治疗已进入分子时代,基因测序、分子靶向及免疫治疗的进展使得胃癌的治疗日益精准化[3]。因此,发现新型胃癌特异性生物标志物及治疗靶点一直是胃癌相关研究的热点方向。
Gasdermin(GSDM)家族成员是近来鉴定的成孔效应蛋白。在人类中,GSDM 家族内成员基于同源性鉴定共有6 个,分别是GSDMA、GSDMB、GSDMC、 GSDMD、 DFNA5 (GSDME) 和 PJVK(DFNB59)。GSDM 家族成员在晶体结构中共享一个高度类似的成孔结构域,该结构域是GSDM 蛋白发挥功能的主要结构域,负责介导细胞膜透化和细胞焦亡[4-6]。细胞焦亡是一种GSDM 蛋白介导的具有促炎特征的细胞程序性死亡形式,在生理上对于人体发育、免疫反应发挥重要作用[7]。近年来,不断有研究揭示了焦亡及GSDM 家族分子在多种癌症类型中存在表达/功能的失调,为肿瘤发生发展机制的进一步研究提供了新的思路。例如,单核苷酸多态性变体rs8067378 能显著增加GSDMB的表达,从而提高宫颈癌的发生率[8];GSDMC 在结直肠癌中是促癌基因,将其敲低将导致结直肠癌细胞系的增殖能力减弱[9];GSDMD 在非小细胞肺癌和转移性黑色素瘤中表达升高,且肿瘤细胞侵袭能力越强,GSDMD 的表达越高[10]。然而,GSDM 家族成员在胃癌中的表达、预后价值、功能和潜在机制研究尚待阐明。
本研究从GSDM 家族这一整体概念出发,通过多个生物信息平台数据库,系统分析了GSDMA、GSDMB、GSDMC、GSDMD、DFNA5、PJVK 这6 个家族成员在胃癌中的表达差异、预后价值、基因变异情况、参与肿瘤进程的潜在功能及信号通路、与肿瘤免疫的相关性以及甲基化状态,旨在加深研究者对胃癌中GSDM 基因家族的理解,为深入研究胃癌中GSDM 家族各分子提供新的思路。
1 资料与方法
1.1 表达相关数据库(ONCOMINE、UALCAN 和GEPIA2)分析
ONCOMINE 作为肿瘤基因芯片数据库,可用于分析基因表达差异、寻找离群值、预测共表达基因等[11]。UALCAN 是基于TCGA 和GTEx 数据库资源进行肿瘤数据在线分析和挖掘的网站[12]。通过ONCOMINE 和UALCAN 来比较胃癌和正常组织之间GSDM 家族的mRNA 差异表达。GSDM 家族成员与TNM 分期及肿瘤分级之间的相关性探究由UALCAN完成。GSDM 家族各成员之间的相对表达水平和关联分析由GEPIA2 完成[13]。P<0.05 为差异有统计学意义。
1.2 生存分析数据库(Kaplan-Meier plotter 和GEPIA2)分析
Kaplan-Meier plotter 和GEPIA2 数据库都可以用于评估某基因与常见癌症类型的预后关系[14]。本研究使用这两个数据库进行GSDM 家族在胃癌患者中的生存分析,以总生存期(OS)作为主要研究终点。P<0.05 为差异有统计学意义。
1.3 cBioPortal和Cytoscape分析
cBioPortal 是一个癌症基因组学数据库,包含常见癌症类型的基因组数据,并可供用户进行下载和分析[15]。通过该数据库获得胃癌患者数据集的基因改变状况(TCGA,Firehose Legacy,369 例),以此来明确GSDM 家族的基因改变频率和类型。胃癌中GSDM 家族相关基因的筛选也是通过该数据库,共筛选出186 个GSDM 家族相关基因,并通过Cytoscape 工具绘制蛋白相互作用网络图。
1.4 WebGestalt分析
WebGestalt 全称为WEB-based Gene SeT AnaLysis Toolkit,是一个基于公共数据库的基因集分析工具[16]。本研究中,将186 个GSDM 家族相关基因导入WebGestalt 获得GO 功能和KEGG 通路的富集分析数据。
1.5 TIMER 2.0分析
TIMER 2.0 是一个基于TCGA 等公共数据库的综合分析平台,提供常见癌症中基因表达差异和免疫细胞浸润的相关性分析[17]。通过TIMER 2.0 的“免疫关联”模块进行GSDM 家族基因表达和CD4+T 细胞、CD8+T 细胞、B 细胞、树突状细胞、巨噬细胞和中性粒细胞等免疫细胞的相关性分析。
1.6 DiseaseMeth分析
DiseaseMeth 是一个涵盖多种癌症类型的研究甲基化异常的数据库[18]。通过该数据库分析GSDM家族各成员在胃癌组织和正常胃组织中的DNA 甲基化水平的差异。
2 结 果
2.1 GSDM基因家族在胃癌中的表达
通过ONCOMINE 和UALCAN 数据库对GSDM 基因家族在胃癌中的mRNA 表达进行了分析。ONCOMINE 数据库的分析结果显示:胃癌组织中DFNA5 明显高表达,其表达水平较正常组织升高2.479 倍(Cho Gastric 数据集);GSDMB 的表达在胃癌组织中明显降低,较正常组织下降2.042~2.074 倍(Chen Gastric 数据集和DErrico Gastric 数据集);其余4 个成员GSDMA、GSDMC、GSDMD 和PJVK 在胃癌中的表达较正常组织无差异(图1A)。另外,UALCAN 数据库的分析结果显示: GSDMA、GSDMB、GSDMD、DFNA5 的表达水平在胃癌中较正常胃组织明显升高,而GSDMC、PJVK 的表达无明显差异(图1B)。上述二个数据库的分析结果显示:仅有DFNA5 的表达在两个数据库中具有一致性,其在胃癌组织中高表达,是潜在的促癌基因。接着,通过GEPIA2 数据库比较胃癌中GSDM 家族各成员之间的相对表达水平,发现它们的相对表达量从高到低排列依次是GSDMB>GSDMD>DFNA5>PJVK>GSDMA>GSDMC(图1C)。

图1 GSDM 基因家族的mRNA 表达情况 A:GSDM 基因家族各成员在胃癌组织和正常组织中的mRNA 表达(ONCO‐MINE);B:GSDM基因家族各成员在胃癌组织和正常组织中的mRNA表达(UALCAN);C:胃癌组织中各GSDM家族成员的相对表达水平(GEPIA2)Figure 1 The mRNA expression levels of GSDM family members A: The mRNA expression levels of individual GSDM member in gastric cancer tissues and normal tissues (ONCOMINE); B: The mRNA expression levels of individual GSDM member in gastric cancer tissues and normal tissues(UALCAN);C:Relative mRNA expression levels of each GSDM mem‐ber in gastric cancer tissues(GEPIA2)
接下来,利用UALCAN 数据库探究GSDM 家族的表达与临床TNM 分期的相关性,结果显示:GSDMA、GSDMB、GSDMD、DFNA5 的mRNA 表 达在多个TNM 分期间存在明显差异(图2)。笔者前期结果显示:仅有DFNA5 的mRNA 表达在两个数据库中具有一致性,均在胃癌组织中高表达。于是本研究进一步探究DFNA5 与TNM 分期或肿瘤分级的关系,结果显示:DFNA5 在TNM 2、3、4 期的表达水平较TNM 1 期及正常组织明显升高,提示DFNA5 可能是反映进展期胃癌的有效指标(图2A)。同时DFNA5 也被发现与肿瘤分级密切相关,DFNA5 在肿瘤分级2、3 级中的表达明显升高,表明DFNA5 与较差的分化程度可能相关(图2B)。
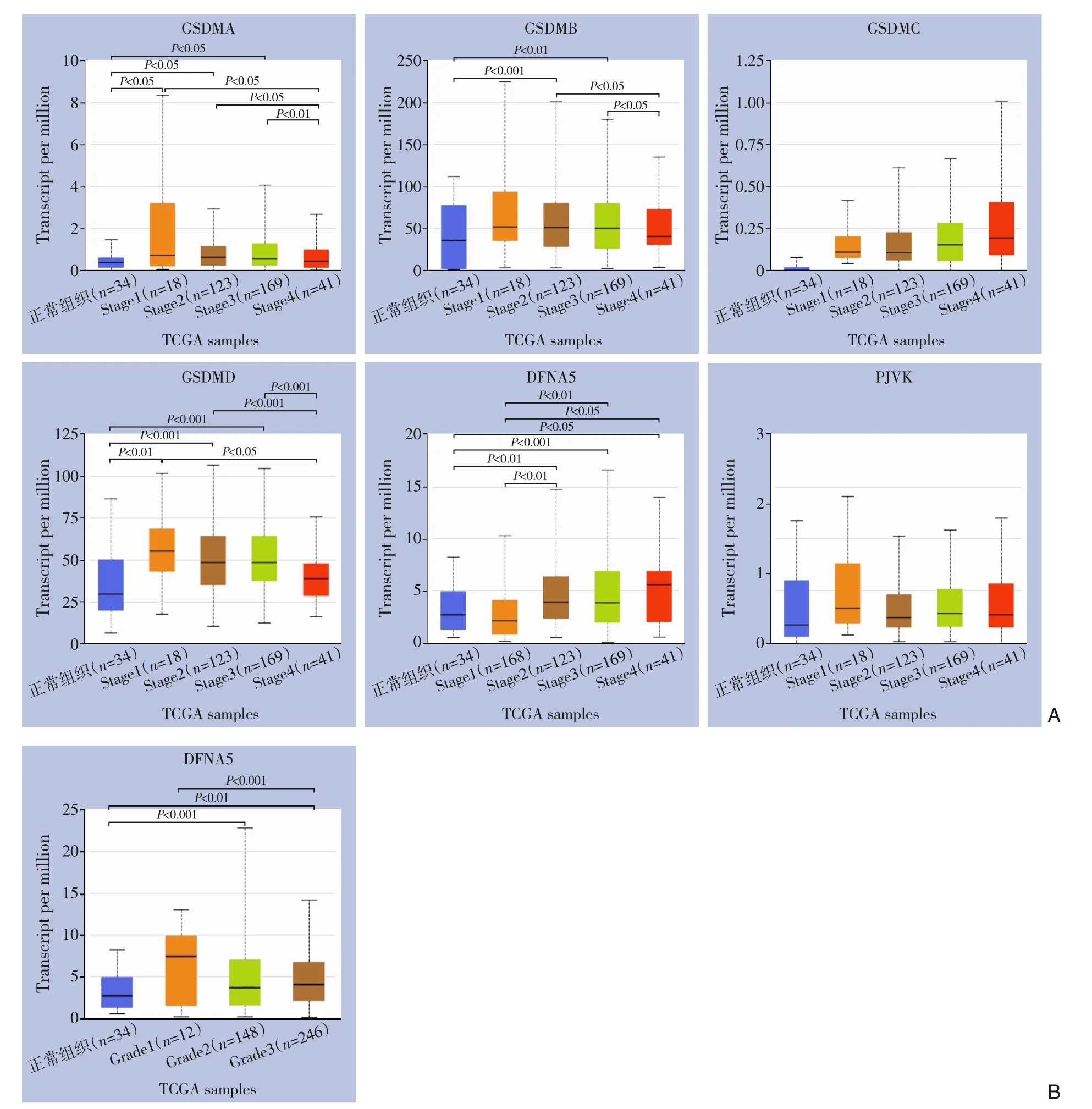
图2 GSDM基因家族的表达与胃癌患者临床分期及肿瘤分级的关系(UALCAN) A:GSDM基因家族各成员与临床分期的关系;B:DFNA5的表达与肿瘤分级的关系Figure 2 The relationship between the mRNA expression of GSDM family members and clinical cancer stage in patients with gastric cancer(UALCAN) A:The relationship between individual GSDM member and clinical cancer stage;B:The re‐lationship between DFNA5 expression and tumor grade
2.2 GSDM基因家族在胃癌患者中的预后价值
本研究中,采用Kaplan-Meier plotter 数据库评估GSDM 家族在胃癌中的预后价值,分析结果显示:高表达GSDMC(P=0.028)和DFNA5(P=0.0013)的胃癌患者具有更差的总OS,而高表达GSDMD(P=0.007)的胃癌患者具有更好的OS(图3)。综合上述GSDM 家族成员在胃癌中的表达趋势及与患者预后关系,结果发现:只有DFNA5 在胃癌中的表达趋势和预后关系相一致,即DFNA5 在胃癌中高表达,并与患者的更差预后相关,提示DFNA5 可能是胃癌患者潜在的预后标志物和治疗靶点。
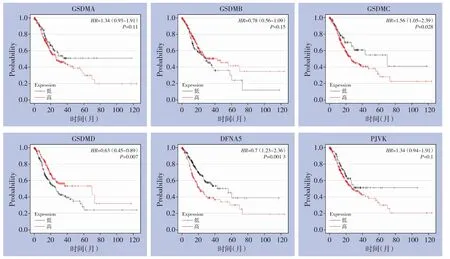
图3 GSDM基因家族的表达与胃癌患者OS的相关性(Kaplan-Meier plotter)Figure 3 The relationship between the mRNA expression of GSDM family members and OS in patients with gastric cancer(Kaplan-Meier plotter)
2.3 GSDM基因家族在胃癌中的基因改变状况
通过cBioPortal 数据库分析胃癌患者数据集的基因改变状况(TCGA, Firehose Legacy,369 例),结果显示:在369 例胃癌患者中,共有167 例(45%)患者存在GSDM 家族基因改变,其中基因变异率GSDMD最高(19%),GSDMA、GSDMB、GSDMC 次之(14%),DFNA5 (8%) 和PJVK 最低(6%)(图4A)。此外,通过GEPIA2 数据库对GSDM 家族分子之间的相关性进行分析并绘制成热图,结果显示: GSDMB 和GSDMD, GSDMA 和GSDMB 之间明显正相关,而GSDMD 与PJVK 间明显负相关(图4B)。
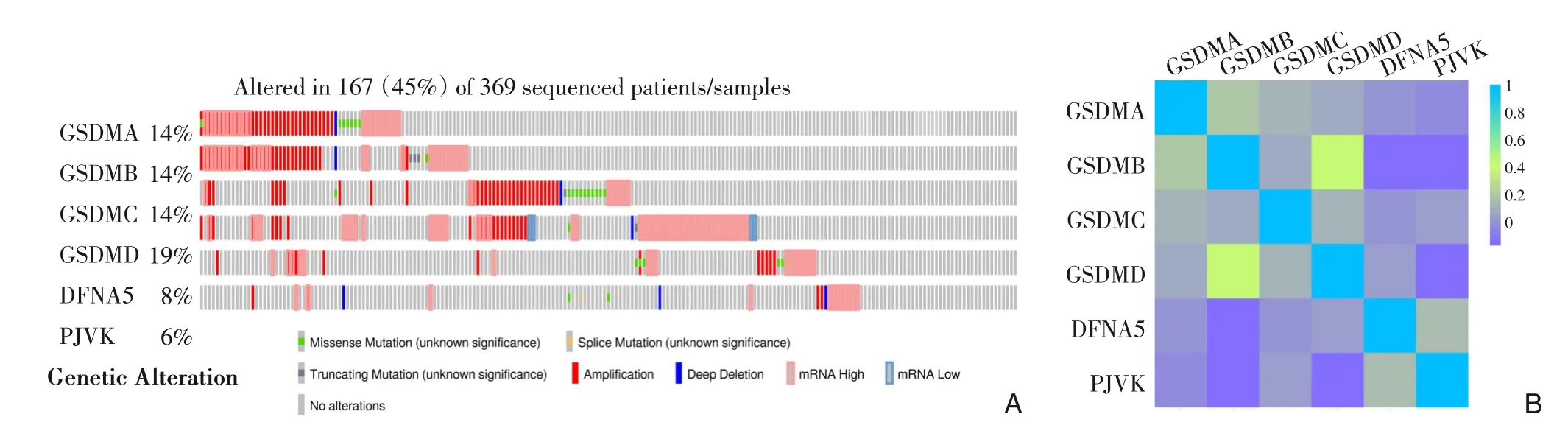
图4 GSDM基因家族的基因改变及各成员之间的相关性 A:GSDM基因家族各成员的基因改变频率(cBioPortal;TCGA,Firehose Legacy);B:GSDM家族各成员之间的相关性分析(GEPIA2)Figure 4 The genetic alteration of individual GSDM family member and the correlation among its members A:The genetic alteration frequency of each GSDM member(cBioPortal;TCGA,Firehose Legacy);B:Correlation analysis among the GS‐DM family members(GEPIA2)
2.4 GSDM基因家族相关共表达基因的功能及通路富集分析
进一步探究GSDM 基因家族相关共表达基因的作用,有助于更好地了解GSDM 基因家族的功能。通过cBioPortal 中的胃癌患者数据集(TCGA,Firehose Legacy)获得369 例胃癌患者信息,并筛选出186 个GSDM 相关的共表达基因,并根据它们之间的共表达关系使用Cytoscape 工具绘制成蛋白相互作用网络图发现: CXCL8、 CXCL1、 PF4、PPARG 是GSDM 基因家族功能最密切相关的主要分子(图5A)。接着,通过WebGestalt 数据库的GO功能富集分析和KEGG 通路富集分析,进一步探讨GSDM 相关分子的生物学功能,结果显示:GSDM基因家族相关分子主要富集分布于细胞膜、囊泡、细胞核、内膜系统中,主要负责生物调节和代谢调控等生物学过程,分子功能主要涉及蛋白质结合、离子结合、核酸结合以及转移酶活性调节等(图5B);KEGG 通路富集分析结果显示:GSDM 基因家族相关分子在胃癌中的差异表达主要涉及炎症细胞凋亡、趋化因子反应、急性炎症反应相关的信号通路(图5C)。
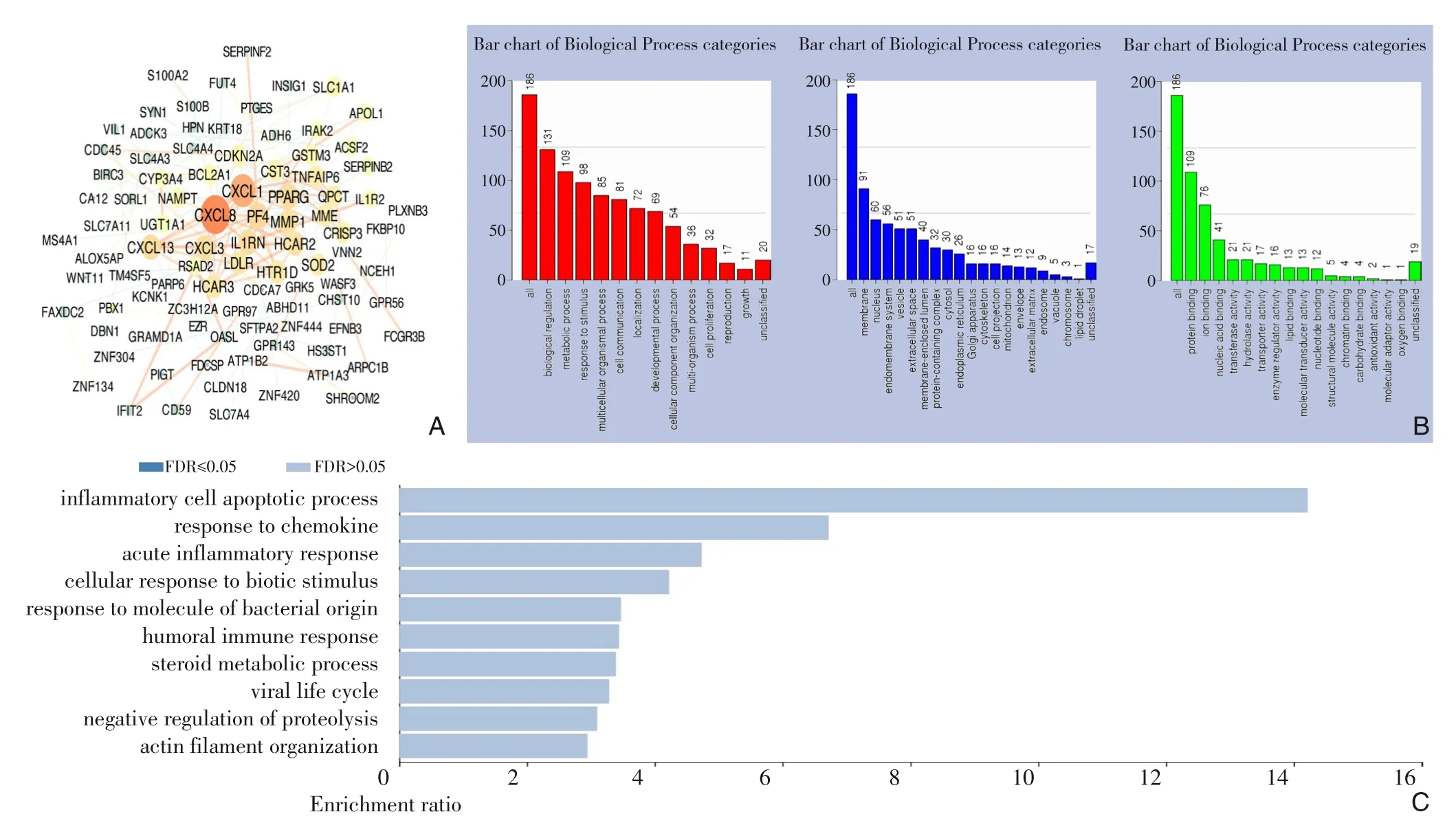
图5 GSDM 基因家族相关共表达基因的功能分析 A:蛋白相互作用图展示胃癌中与GSDM 基因家族共表达的186 个基因(cBioPortal,Cytoscape);B:GO功能富集分析预测与GSDM基因家族共表达分子相关的生物过程、细胞成分、分子功能(WebGestalt);C:KEGG通路富集分析GSDM基因家族共表达分子主要涉及的相关信号通路(WebGestalt)Figure 5 Functional analysis of related co-expressed genes of GSDM family members A:The protein-protein interaction dia‐gram showing 186 genes co-expressed with the GSDM family members in gastric cancer (cBioPortal, Cytoscape); B: GO functional enrichment analysis predicting the biological processes, cellular components and molecular functions related to the GSDM family co-expression molecules (WebGestalt); C: KEGG pathway enrichment analysis predicting the main sig‐nal pathways related to the GSDM family co-expression molecules(WebGestalt)
2.5 GSDM基因家族与胃癌免疫细胞浸润的相关性
胃癌组织周围的免疫细胞浸润是重要的肿瘤微环境组成部分。本研究为了进一步探讨GSDM 基因家族成员是否参与免疫相关调节机制,通过TIMER 2.0 数据库分析GSDM 基因家族各成员与CD8+T 细胞、CD4+T 细胞、B 细胞、树突细胞、巨噬细胞、中性粒细胞浸润的相关性,结果显示:GSDMA、GSDMC、GSDMD、DFNA5 与CD8+T 细胞浸润呈正相关;GSDMA、PJVK 与CD4+T 细胞浸润呈正相关;GSDMB、GSDMD 与B 细胞浸润呈正相关;GSDMA、GSDMC、DFNA5 与中性粒细胞浸润呈正相关;GSDMA、GSDMD、DFNA5 与巨噬细胞浸润呈正相关,而PJVK 与之呈负相关;GSDMA、GSDMC、GSDMD、DFNA5 与树突细胞浸润呈正相关,而PJVK 与之呈负相关(图6)。
2.6 GSDM基因家族在胃癌中的甲基化
DNA 甲基化是常见的癌症相关基因调控途径。本研究通过DiseaseMeth 数据库分析胃癌中GSDM 基因家族各成员的表达与其DNA 甲基化水平的关系,结果显示:GSDMA、GSDMC、GSDMD 在胃癌中的甲基化水平较正常胃组织中显著降低。结合前期研究结果:GSDMA、GSDMD 的mRNA 水平在胃癌中 显 著 高 表 达(UALCAN), 提 示: GSDMA、GSDMD 在胃癌组织中的异常高表达的调控机制可能与它们的低甲基化水平有关。DFNA5 在胃癌组织中高表达, 但其甲基化水平无明显改变(图7)。
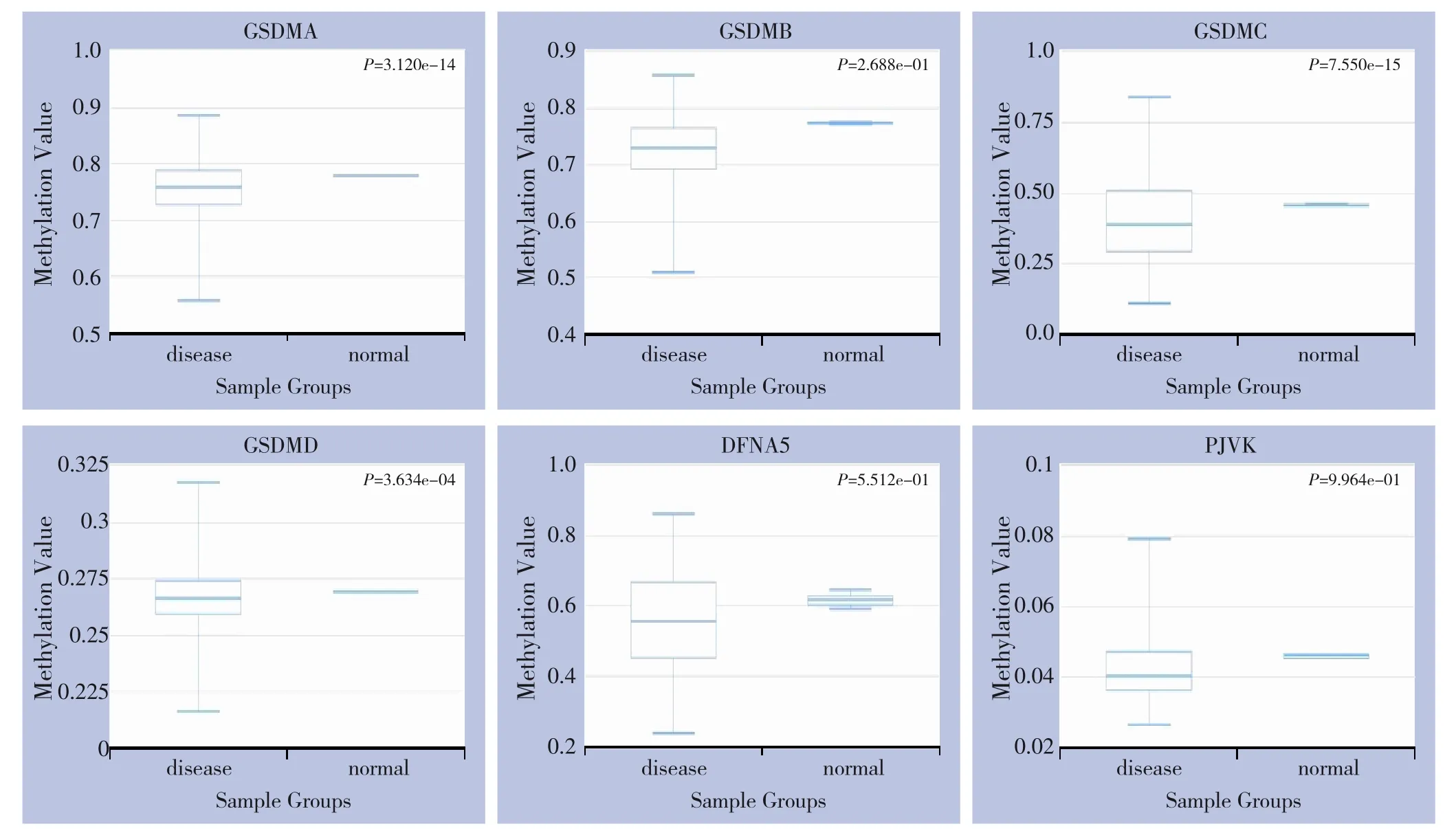
图7 GSDM基因家族各成员在胃癌组织和正常胃组织中的DNA甲基化水平分析(DiseaseMeth)Figure 7 DNA methylation levels of individual GSDM family members between gastric cancer tissues and normal tissues(Dis‐easeMeth)
3 讨 论
焦亡作为一种促炎性程序性细胞死亡,主要由GSDM 家族成员介导,发生过程中伴有多种炎症和免疫反应[19-20]。近年来的研究表明,GSDM 家族的表达失调与多种癌症生物学行为相关,是非常有前景的研究新方向。以GSDMC 为例,Watabe等[21]发现GSDMC 过表达可以促进B16 黑色素瘤细胞的转移。在结直肠癌中,研究者发现GSDMC 通过抑制TGFBR2 的活性来增强结直肠癌细胞的增殖能力从而促进肿瘤发生[9]。在胃癌中,有文献[22]报道GSDMC 可以作为抑癌基因明显抑制胃癌细胞的生长。以上报道说明GSDMC 在不同癌症中的作用具有异质性,甚至可以是截然相反的。
目前尚未有关于GSDM 家族在胃癌中的整体系统性研究。本研究首先通过多个数据库探讨了GSDM 家族成员在胃癌组织与正常胃组织中的表达差异。虽然GSDMA、GSDMB、GSDMD、DFNA5 在单个数据库(UALCAN)中显示出表达的差异性,但仅有DFNA5 的表达模式在多个数据库中具有一致性,即在胃癌组织中高表达,这表明DFNA5 是较为合适的潜在的促癌基因,值得研究者进行深入探索。GSDM 家族成员在Oncomine 及UALCAN 数据库中表达不一致的原因,一方面可能是因为UALCAN 数据库主要收纳的是TCGA level 3 级的RNA 测序数据,而Oncomine 数据库的数据来源主要为已经发表的癌症基因芯片数据;另一方面,当来自不同数据库的结果不一致时,提示可能有多重复杂的深层机制导致矛盾结果的产生,或者是样本量不足或者是高度异质性导致的偏倚。而其他GSDM 基因家族成员在消除偏倚、细化胃癌研究对象标准后也可能具有重要的研究意义。
随后,生存分析结果显示:GSDMC 和DFNA5高表达提示更差的患者预后,而GSDMD 高表达提示更好的预后。同样,只有DFNA5 在两个数据库中的生存分析结果是一致的,且其表达趋势与预后作用相符合,这进一步证明了DFNA5 作为胃癌促癌基因的可能性。值得注意的是:DFNA5 在某些其他类型肿瘤中被认为是肿瘤抑制基因。例如,在乳腺癌中,DFNA5 通过介导肿瘤细胞的焦亡而发挥肿瘤抑制作用[23]。在肺癌细胞中,KRAS、EGFR 等小分子抑制剂能通过DFNA5 发挥抗肿瘤效果[24]。综上所述,通过进一步的实验证明和机制探索,DFNA5 很可能作为新的肿瘤标志物和治疗靶点改善胃癌患者的诊治与生存。
本研究筛选了胃癌中与GSDM 基因家族功能相关的差异表达分子,并进行了功能和通路富集分析,以期望能促进研究者们对GSDM 家族与胃癌之间关系的理解。GSDM 基因家族相关分子主要涉及炎症细胞凋亡、趋化因子反应、急性炎症反应相关的信号通路,这与病原体衍生或宿主衍生的危险信号介导caspase 切割GSDM 家族蛋白,从而同时发挥焦亡及凋亡功能的理论相一致。GSDM 基因家族可以通过触发细胞焦亡来抑制肿瘤生长,具体机制被认为与免疫相关,即细胞焦亡通过增强肿瘤相关巨噬细胞对肿瘤细胞的吞噬作用,以及影响肿瘤浸润性CD8+T 细胞的数量和功能来激活抗肿瘤免疫[25]。本研究揭示了胃癌中GSDM 基因家族各分子的表达与多种免疫细胞浸润的关系,发现多数GSDM 家族成员的表达与CD4+T 细胞、CD8+T 细胞、B 细胞、中性粒细胞、巨噬细胞、树突细胞的浸润存在不同程度的显著正相关,仅PJVK 在巨噬细胞和树突细胞浸润中呈负相关,说明胃癌中GSDM 家族的免疫细胞浸润谱存在特征性,并在一定程度上与GSDM 家族的焦亡机制密切相关,有作为新的生物标志物和免疫治疗疗效评估标志物的潜力。
DNA 甲基化是经典的表观遗传学修饰过程,在调节多种人类癌症相关基因的表达方面发挥关键作用[26]。Upchurch 等[27]发现异常的启动子低甲基化状态会显著影响血液系统恶性肿瘤中多种癌基因的表达水平; 磷酸核糖氨基咪唑羧化酶(PAICS)的启动子区域在肺癌中经常处于低甲基化状态,这导致了PAICS 的激活从而发挥肿瘤启动子的作用[28]。DFNA5 是caspase-3 介导的细胞焦亡的执行者,它在胃癌、乳腺癌和结直肠癌中通过甲基化在表观遗传上沉默,从而发挥肿瘤抑制因子的功能[29]。本研究发现,GSDMA、GSDMD 在胃癌组织中的异常高表达的调控机制可能与它们的低甲基化水平有关。另外,胃癌中DFNA5 的甲基化水平无明显改变,这与已有的文献存在不相符之处,可能是由于样本量不足的原因,或者是纳入的患者存在偏倚因素,需经过更多和更大样本量的研究进行验证。
本研究有以下几点局限性。首先,本研究用于分析的数据来自多个在线数据库,需要进一步的体内及体外来验证。此外,对单个GSDM 成员在胃癌中的具体机制缺乏了解,后续的研究工作将通过具体实验进一步探究GSDM 各成员在胃癌发生发展中的作用。

