PIK3C3与SMAD4在胰腺癌中的表达及作用
周袁,张鹏程,方强强,喻亚群,肖娟,2
(桂林医学院附属医院1.广西肝损伤与修复分子医学重点实验室2.广西神经鞘脂代谢相关疾病基础研究重点实验室3.肝胆胰外科,广西桂林541001)
胰腺癌(pancreatic adenocarcinoma,PAAD)仍是世界范围内最致命的癌症之一[1]。据2018年全球肿瘤流行病统计数据(GLOBOCAN)显示,PAAD每年可导致432 242 例以上的患者死亡,其在男性或女性癌症病死率中排名第七[2-3]。随着外科手术及化疗不断发展,PAAD 患者的生存率有所提高。但在一些国家,PAAD 患者的5年生存率仍低至2%[4-5],其主要原因在于PAAD 的早期诊断困难[6-8]。因此,研究可用于PAAD 早期诊断的指标至关重要。
III 型磷脂酰肌醇3-激酶(PIK3C3,也称为VPS34),在低等真核生物、植物和哺乳动物体内保守[9-10]。PIK3C3 蛋白是一种内体激酶,在胞内可通过与不同的多蛋白复合物结合而行使多种功能[11]。研究发现,PIK3C3 在哺乳动物中的生物学功能与小泡运输的调节有关,包括自噬、内吞和吞噬作用等[12]。最近,自噬被发现与癌症的发生发展密切相关[13],自噬在癌症中发挥双重作用[14]。一方面,肿瘤发生早期,自噬可清除损伤的蛋白及细胞器以维持细胞稳态,进而抑制肿瘤发生发展;另一方面,肿瘤发生晚期,自噬可通过降解蛋白质或细胞器为肿瘤细胞提供营养,从而有助于肿瘤的发展。然而,自噬关键分子PIK3C3 在PAAD 中的作用并不十分清楚。
SMAD4 基因编码Smad 家族成员蛋白,该基因的产物可调节靶基因的转录[15]。SMAD4 蛋白质可充当肿瘤抑制因子并抑制上皮细胞增殖[16]。此外,钙蛋白还可能通过减少血管生成和增加血管通透性而对肿瘤产生抑制作用[17-18]。该基因的突变或缺失可能导致PAAD[19-20], 但其与PIK3C3 联合在PAAD 中的作用未知。
本研究通过生物信息学分析和相关实验验证以了解PIK3C3 及SMAD4 联合是否对PAAD 患者的诊断和预后产生影响。
1 材料与方法
1.1 数据收集及处理
利用UALCAN 在线网站(http://ualcan.path.uab.edu/index.html)分析PIK3C3及其相关基因SMAD4在PAAD 中的表达,分析PIK3C3 及SMAD4 基因与PAAD 预后之间的关联。从癌症基因组图谱(The Cancer Genome Atlas, TCGA)数据库(http://cancergenome.nih.gov)下载4例正常对照及178 例PAAD 的千碱基百万片段(FPKM)样式数据的转录组测序(RNA-seq) 数据及匹配的临床信息数据, 生存分析时将没有生存信息的患者剔除(1 例)。
1.2 聚类分析
基于PIK3C3 和SMAD4 联合的mRNA 表达水平,使用“ConsensusClusterPlus”R 软件包进行聚类分析,将178 例PAAD 分为聚类1(101 例)和2(77 例)。通过“Limma”R 软件包进行主成分分析(PCA)以分析两个cluster 的区分度, 所得结果通过“ggplot2”R 软件包进行可视化。
1.3 免疫组织化学染色
PAAD 组织芯片购自上海芯超生物有限公司(货号HPanA150Su01),PIK3C3 检测芯片有效癌组织及癌旁组织例数分别为78 及59,SMAD4 检测芯片有效癌组织及癌旁组织例数分别为66 及50,同时具备PIK3C3 及SMAD4 病理评分的癌组织例数为60。将组织样本切片脱蜡再水化,然后在0.01 mmol/L柠檬酸盐缓冲液(pH=6.0)中进行热诱导抗原决定簇修复,在3%过氧化氢和甲醇中封闭10 min。抗PIK3C3/VPS34 (Proteintech Group) 和抗SMAD4(Proteintech Group) 多克隆抗体分别与组织芯片4 ℃孵育过夜。孵育结束后,滴加适量反应增强液、二抗聚合物各避光室温下孵育20 min。DAB 染色5 min,复染,脱水,透明,封片。最后由多个病理学专家在显微镜下对蛋白表达水平进行评分。根据染色强度和染色面积将其分为4 个级别:0(阴性),1(弱阳性), 2(中阳性)和3(强阳性)[21-22]。
1.4 统计学处理
采用R(版本3.6.1)进行了与R 相关的统计分析。使用秩和检验(Wilcoxon)比较癌组织和癌旁组织中PIK3C3 和SMAD4 的mRNA 表达差异。使用Kolmogorov-Smirnov 检验分析 了PIK3C3 及SMAD4 与PAAD 患者的临床病理特征之间的关系。使用Kaplan-Meier 法分析两个聚类之间的总生存期(OS)差异。采用独立样本t检验(SPSS)及ROC曲线AUC(GraphPad prism)分析PIK3C3 或SMAD4蛋白在PAAD 癌及癌旁组织的表达差异。采用Kaplan-Meier 法(Log-rank)分析PIK3C3 及SMAD4单独及联合在评估PAAD 患者预后中的作用。P<0.05 为差异有统计学意义。
2 结 果
2.1 PAAD中PIK3C3的mRNA表达分析及生存分析
UALCAN 网站分析得到的箱线图表明,与正常组织相比,PAAD 组织中PIK3C3 mRNA 表达略有下降,但差异不明显(P>0.05)(图1A)。同时,分析结果表明PIK3C3 mRNA 表达对PAAD 患者的预后无明显影响(P>0.05)(图1B)。
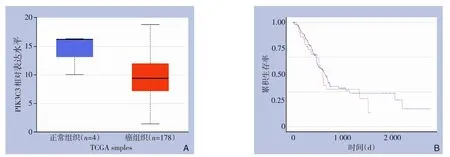
图1 PIK3C3 mRNA在PAAD中的表达及其对预后的影响 A:PIK3C3 mRNA在正常和PAAD组织中的表达情况;B:不同PIK3C3 mRNA表达水平PAAD患者的生存曲线Figure 1 The expression of PIK3C3 mRNA in PAAD and its effect on prognosis A:PIK3C3 mRNA expressions in PAAD and adjacent normal tissues;B:Survival curves of PAAD patients with different expression levels of PIK3C3 mRNA
2.2 与PIK3C3 mRNA表达相关的基因筛选
上述结果说明PIK3C3 mRNA 表达在癌和癌旁中的差异不明显且其与PAAD 预后无明显关系。PIK3C3 为自噬关键调控基因,且自噬与肿瘤的发生发展关系密切,故PIK3C3 可能与其他基因共同影响PAAD。利用UALCAN 分析得到在PAAD 中与PIK3C3 mRNA 共表达相关性最高的20 个基因,其中包括SMAD4(表1)。

表1 PAAD中与PIK3C3共表达最相关的前20个基因Table 1 Top 20 genes correlate to PIK3C3 in PAAD
2.3 基于PIK3C3 和SMAD4 mRNA 表达的共聚类分析
Wilcoxon 检验、R 热图分析结果显示,PIK3C3和SMAD4 mRNA 在PAAD 中具有相似的表达模式,且两者在PAAD 癌和癌旁中均无明显差异(图2)。采用基于PIK3C3 和SMAD4 mRNA 表达模式的聚类分析研究两者联合在PAAD 中的作用。k=2 即PAAD患者被分为聚类1 和聚类2,进一步使用主成分分析(PCA)比较聚类1 和聚类2 之间的转录谱,结果表明聚类1 和聚类2 之间有明显的差别(图3A-D)。与聚类1 比较,聚类2 中PIK3C3 和SMAD4 mRNA 表达水平更高,且65 岁以下的病例数更多(图3E)。此外,在聚类1 中,PAAD 患者的总生存率比聚类2 中的患者明显更短(P=0.006)(图3F)。

图2 在PAAD组织和正常组织中PIK3C3和SMAD4 mRNA的表达热图Figure 2 Heatmap of PIK3C3 and SMAD4 mRNA expres‐sion in PAAD tissues and adjacent normal tissues

图3 一致性聚类分析 A:当k=2 时,TCGA 队列被分为聚类1 和聚类2;B:k=2~10 的一致性聚类累积分布函数(CDF);C:k=2~10 CDF曲线下面积的相对变化;D:在TCGA数据集中2个亚组主成分分析(PCA);E:每个亚组中PIK3C3和SMAD4的表达水平及临床参数热图;F:聚类1与聚类2患者的OS曲线Figure 3 Consensus clustering analysis A:Two distinct clusters divided from the TCGA cohort when k=2; B:The consistency clustering cumulative distribution function(CDF)for k=2 to 10;C:Relative change in area under CDF curve for k=2 to 10;D:Principal component analysis(PCA)of 2 clusters of total RNA expression profile after consistency analysis of PAAD in the TCGA dataset;E:The heatmap for visualizing the expression levels of PIK3C3 and SMAD4,and clinical parameters in each cluster;F:OS curves of the two clusters of patients
2.4 SMAD4的mRNA表达分析及生存分析
以上结果表明SMAD4 可以与PIK3C3 联合作用影响PAAD 的预后。从UALCAN 网站分析得到的箱线图表明,与PIK3C3 类似,PAAD 组织中SMAD4 mRNA 表达下降,但不明显(P>0.05)(图4A)。同时,SMAD4 mRNA 表达与PAAD 患者的预后无明显关系(P>0.05)(图4B)。

图4 SMAD4mRNA在PAAD中的表达及其对预后的影响 A:SMAD4 mRNA在正常和PAAD组织中的表达情况;B:不同SMAD4 mRNA表达水平PAAD患者的生存曲线Figure 4 The expression of SMAD4 mRNA in PAAD and its effect on prognosis A:SMAD4 mRNA expressions in PAAD and adjacent normal tissues;B:Survival curves of PAAD patients with different expression levels of SMAD4 mRNA
2.5 PAAD患者中PIK3C3和SMAD4蛋白表达分析
采用免疫组化的方法分析PAAD 中PIK3C3 和SMAD4 蛋白表达水平。对PAAD 及癌旁组织的免疫组化病理评分进行独立样本t检验以分析蛋白表达的差异性。结果表明,PIK3C3 和SMAD4 蛋白定位在PAAD 组织的细胞质中(图5A-B),且PAAD 组织中的PIK3C3 和SMAD4 的蛋白质水平均明显低于癌旁组织(均P<0.001);ROC 曲线也证明PAAD 与癌旁组织中PIK3C3 和SMAD4 蛋白质表达存在明显差异,其AUC 分别为0.741 7 和0.799 1(图5C-D),提示PIK3C3 和SMAD4 蛋白可能为PAAD 的诊断标志物。
2.6 PIK3C3 和SMAD4 蛋白与PAAD 预后的关系分析
生存分析结果显示,PIK3C3 或SMAD4 蛋白单独均未对PAAD 患者的预后产生影响(图6A 和6B)。接下来对PIK3C3 和SMAD4 蛋白联合进行预后分析,将PAAD 病例分组(图6C)。与PIK3C3 和SMAD4 蛋白为阴性的组相比,PIK3C3 或SMAD4 蛋白任意一个表达为阳性时,PAAD 患者的生存率更高(P=0.035 9)(图6C)。
3 讨 论
目前,仍缺乏有效的生物标志物以预测PAAD发病风险和预后[23-26]。本项研究发现PAAD 癌组织中PIK3C3 和SMAD4 蛋白较癌旁组织显著下调。同时,本研究还发现PIK3C3 及SMAD4 mRNA 同时升高,PIK3C3 或SMAD4 蛋白上调的PAAD 患者可以获得更好的预后。
本研究中,PAAD 癌组织中PIK3C3 mRNA 表达变化不明显。但PAAD 癌组织中,PIK3C3 蛋白表达显著降低。由此可以推测,PAAD 组织中PIK3C3 蛋白水平的降低很可能与其降解增加有关,而与转录无关。
研究证实,PIK3C3 的已知生物学功能均与囊泡运输的调节有关,包括参与自噬,内吞和吞噬作用等[9-10,27]。具体而言,PIK3C3 是自噬的关键调节因子。同时,部分实验已经证实,通过抑制PIK3C3 降低自噬可促进膀胱癌细胞的死亡,说明自噬促进膀胱癌细胞存活[28-29]。与膀胱癌不同的是,在本研究中PIK3C3 与PAAD 负相关,而VPS34为正向关键调控因子,由此推测自噬在不同的癌症类型中所起的作用可能不同。
本研究发现SMAD4 在PAAD 癌组织中低表达,与早期的一项研究相符[30]。同时,SMAD4 在PAAD存在突变[19],结合其蛋白在PAAD 中降低的现象可推断出SMAD4 突变可导致其自身蛋白的不稳定性。近期研究发现,SMAD4 可抑制PAAD 类器官的侵袭能力[20],本研究并没有发现这一现象。
PIK3C3 或SMAD4 mRNA 单独表达并不影响PAAD 患者的预后情况。然而,PIK3C3 和SMAD4 的组合可以很好地预测PAAD 患者的预后。SMAD4 高表达可体外抑制胰腺癌细胞的存活[31],而抑制PIK3C3 可抑制癌症发生[32]。两基因单独对癌症的影响相反,但两者联合对PAAD 的影响却是一致的,基于两者的共表达关系推测,PIK3C3 在一定范围内的高表达可以促进SMAD4 的抑癌作用进而更加有助于PAAD 患者的存活。
本研究根据PIK3C3 及SMAD mRNA 表达高低将PAAD 患者分为两个聚类:聚类1 与聚类2,聚类2中两基因mRNA 表达较高且PAAD 患者预后更好。值得注意的是,聚类2 的PAAD 患者年龄显著低于聚类1,而年龄大小可以影响PAAD 患者的预后,故PIK3C3 及SMAD mRNA 表达量影响PAAD 预后可能与年龄因素相关,此部分内容有待进一步研究。同时,PIK3C3 及SMAD mRNA 表达量也有可能受年龄因素的影响。
PIK3C3 及SMAD 的mRNA 表达在PAAD 癌组织与癌旁组织中没有明显差异,可能由公共数据库中PAAD 患者的正常样本数量有限所导致[33]。此外,本研究存在一定的局限性,即仅使用TCGA 数据库进行分析。
总而言之, PIK3C3 和SMAD4 蛋白可作为PAAD 潜在的诊断标志物,PIK3C3 和SMAD4 联合可成为PAAD 预后评估的新指标。

