机器人辅助与传统腹腔镜胰体尾切除术治疗胰腺恶性肿瘤疗效比较的Meta分析
杨雯雯,田宏伟,宋绍明,雷彩宁,龚世怡,景武堂,杨克虎,郭天康
(1.兰州大学第一临床医学院,甘肃兰州730000;2.甘肃省人民医院普外临床医学中心,甘肃兰州730000;3.甘肃中医药大学第一临床医学院,甘肃兰州730000;4.兰州大学循证医学中心,甘肃兰州730000;5.甘肃省循证医学与临床转化重点实验室,甘肃兰州730000)
胰腺恶性疾病,如胰腺癌,是一种毁灭性的疾病,总体5年生存率低于6%[1],通常需要手术治疗才能有效缓解症状。目前,胰腺切除最常用的微创手术有两种:机器人辅助胰体尾切除术(robotic-assisted distal pancreatectomy,RDP)和腹腔镜胰体尾切除术(laparoscopic distal pancreatectomy,LDP)。自从Cushieri[2]于1996年首次报道腹腔镜保留脾脏的胰体尾切除术后,短短20年间,腹腔镜技术呈井喷式发展,腹腔镜胰体尾切除术已然成熟,特别是保留脾脏的腹腔镜胰体尾切除术在治疗胰腺远端良性肿瘤和低度恶性肿瘤已在各大医院逐渐得到广泛应用。最近的一项Meta 分析[3]比较了LDP 和开腹胰体尾切除术治疗壶腹周围恶性肿瘤的效果,尽管在短期生存率和胰瘘发生率方面,两者没有区别,但是LDP 损伤小、术后恢复快、住院时间短、总并发症发生率低。然而,LDP 也有一些局限性,例如视野局限、手术器械僵硬、自由度低等。有研究[4]表明,LDP 术中中转开腹率高达16%~31%,这些不足给机器人手术带来潜在的优势。
机器人系统的引入是一种更加微创的手术方法[5]。机器人手术平台的优势包括手术野的三维可视化和提高器械的灵活性,这有助于复杂的解剖和手术重建。此外,人体工程学手术控制台的使用可以减少外科医生在漫长而复杂的手术过程中的疲劳,这也是腹腔镜手术不受欢迎的原因之一。在各种复杂的手术过程中,机器人手术已被证明优于传统腹腔镜手术。例如,在根治性前列腺切除术中,与传统腹腔镜手术相比,机器人方法可使性功能更早恢复,这是由于保留海绵状神经的能力增强[6]。在机器人直肠手术中也有类似的阳痿率降低的报道,可能是出于类似的原因[7]。
尽管既往已有相关研究[8-10]报道了RDP 和LDP之间的差别,但各研究得出的结论均不一致,且对脾脏保存率这一指标有很大的争议。因此,本研究通过更加全面的检索和筛查,客观评价了RDP 和LDP 的有效性和安全性,为临床选择提供决策依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入标准(1)研究类型:随机对照试验(randomized controlled trial,RCT)或队列研究,无语种限制。(2)研究对象:接受RDP 和LDP 的胰腺恶性肿瘤患者,其性别、年龄、种族不限。(3)干预措施:试验组采用RDP 手术,对照组采用LDP手术。(4)主要结局指标:保脾率、术中中转开腹率、手术时间、胰瘘率、住院时间、术后总并发症率、90 d 再手术率、90 d 再入院率、30 d 病死率、淋巴结清扫数;次要结局指标:术中出血量、伤口感染、术中输血率、R0切除、肿瘤大小。PROSPERO 系统评审注册号:CRD 42021246758。
1.1.2 排除标准(1)良性胰腺疾病;(2)难以提取资料数据的文献;(3)动物实验、综述、Meta 分析、病例报道、摘要、会议记录或专家意见等;(4)重复发表的文献。
1.2 文献检索策略
计算机检索 PubMed、 Embase、 Cochrane Library、WanFang Data、CBM 和CNKI 数据库,检索比较RDP 与LDP 在治疗胰腺恶性肿瘤疗效的临床研究,检索时限均为建库至2021年3月。采用主题词与自由词结合的检索方式进行文献检索。英文检索词: Pancreatic Cancer、 Cancer of the Pancreas、 Pancreatic Neoplasm、 Robotic、 Computer-Assisted Surgery、 Robot-assisted、 tele-robotics、Robotic-assisted、distal pancreatectomy;中文检索词:机器人、达芬奇、机器人辅助、胰体尾切除术、腹腔镜胰体尾部切除术。
1.3 文献筛选与数据提取
由2 名研究者独立筛选文献、提取资料并交叉核对。如遇分歧,则相互讨论达成共识或与经验丰富的第三方讨论解决。资料提取内容主要包括:(1)纳入研究的基本信息:第一作者姓名、发表年份、研究类型等;(2)研究对象的基线特征和干预措施;(3)偏倚风险评价的关键要素;(4)所关注的结局指标和结果测量数据。
1.4 文献质量评价
由2 名研究者独立评价纳入文献的偏倚风险并交叉核对结果。对于队列研究,采用纽卡斯尔-渥太华量表(Newcastle-Ottawa Scale,NOS)[11]评价偏倚风险,总分为9 分,≥7 分为高质量文献,纳入文献要求≥6 分;对于RCT,采用Cochrane 手册5.1.0推荐的RCT 偏倚风险评估工具评价偏倚风险[12]。
1.5 统计学处理
采用RevMan 5.4 软件进行Meta 分析。计量资料采用均数差(mean difference,MD)为效应分析统计量,二分类变量采用比值比(odds ratio,OR)为效应分析统计量,各效应量均计算其95%CI。通过I2定量判断研究间的异质性大小。若各研究间无明显异质性(I2<50%,P>0.10),则采用固定效应模型进行Meta 分析;若各研究结果间存在明显异质性(I2>50%,P<0.10),进一步分析异质性来源,并采用亚组分析或敏感度分析等方法进行处理,若异质性仍无法消除,则采用随机效应模型进行Meta 分析。
2 结 果
2.1 文献筛选流程及结果
初步检索共获得4 909 篇相关文献,经过逐层筛选,最终共有15 篇文献[13-27]符合纳入和排除标准。共有2 940 例患者,其中RDP 组997 例,LDP 组1 943 例。具体文献筛选流程及结果见图1。纳入研究的基本特征见表1。
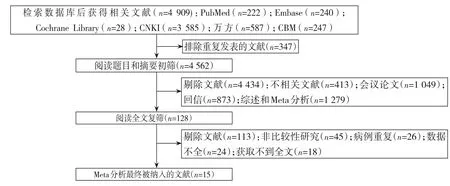
图1 文献筛选流程及结果Figure 1 Literature screening process
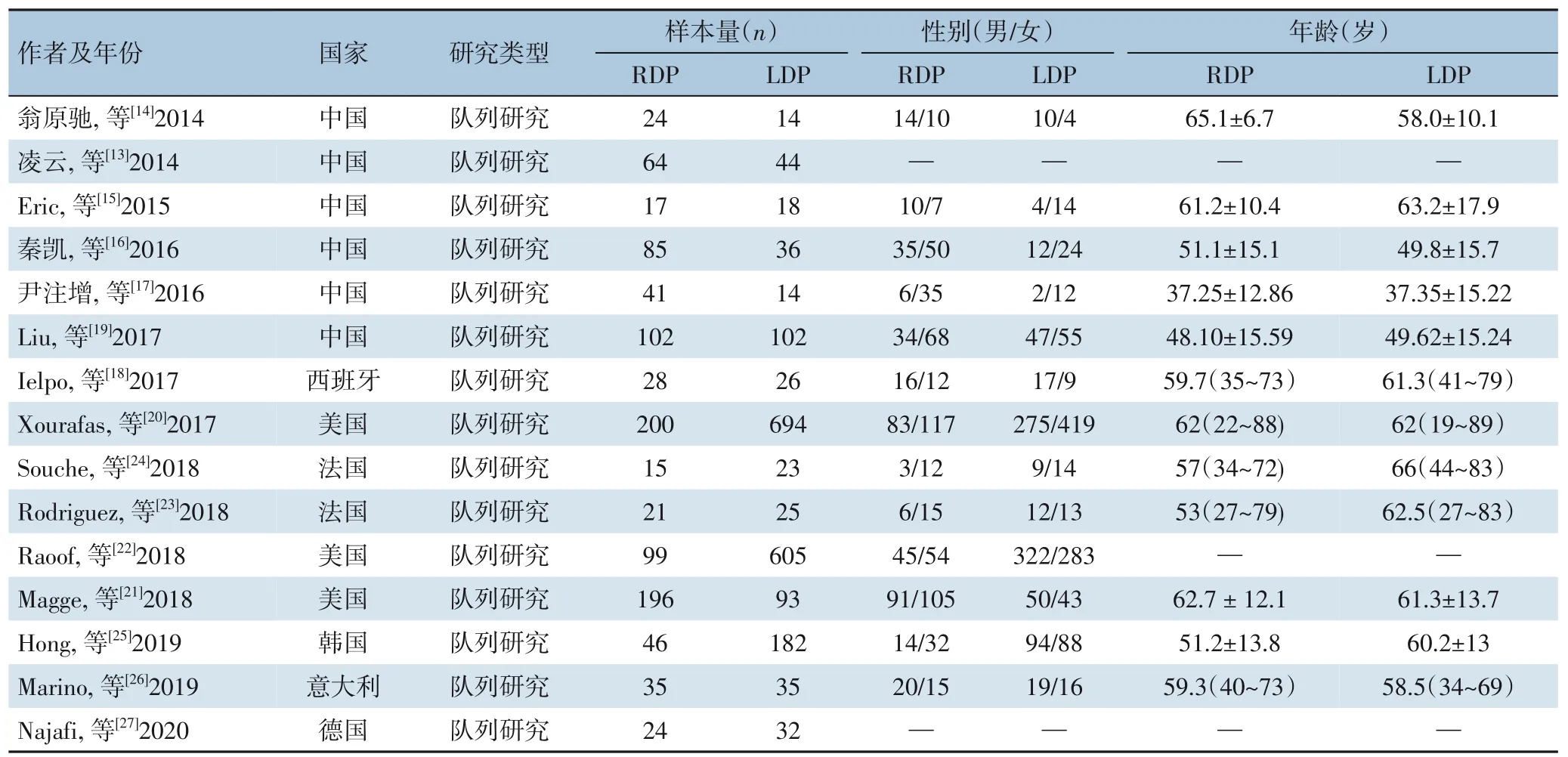
表1 纳入研究的基本特征Table 1 General characteristics of the included studies
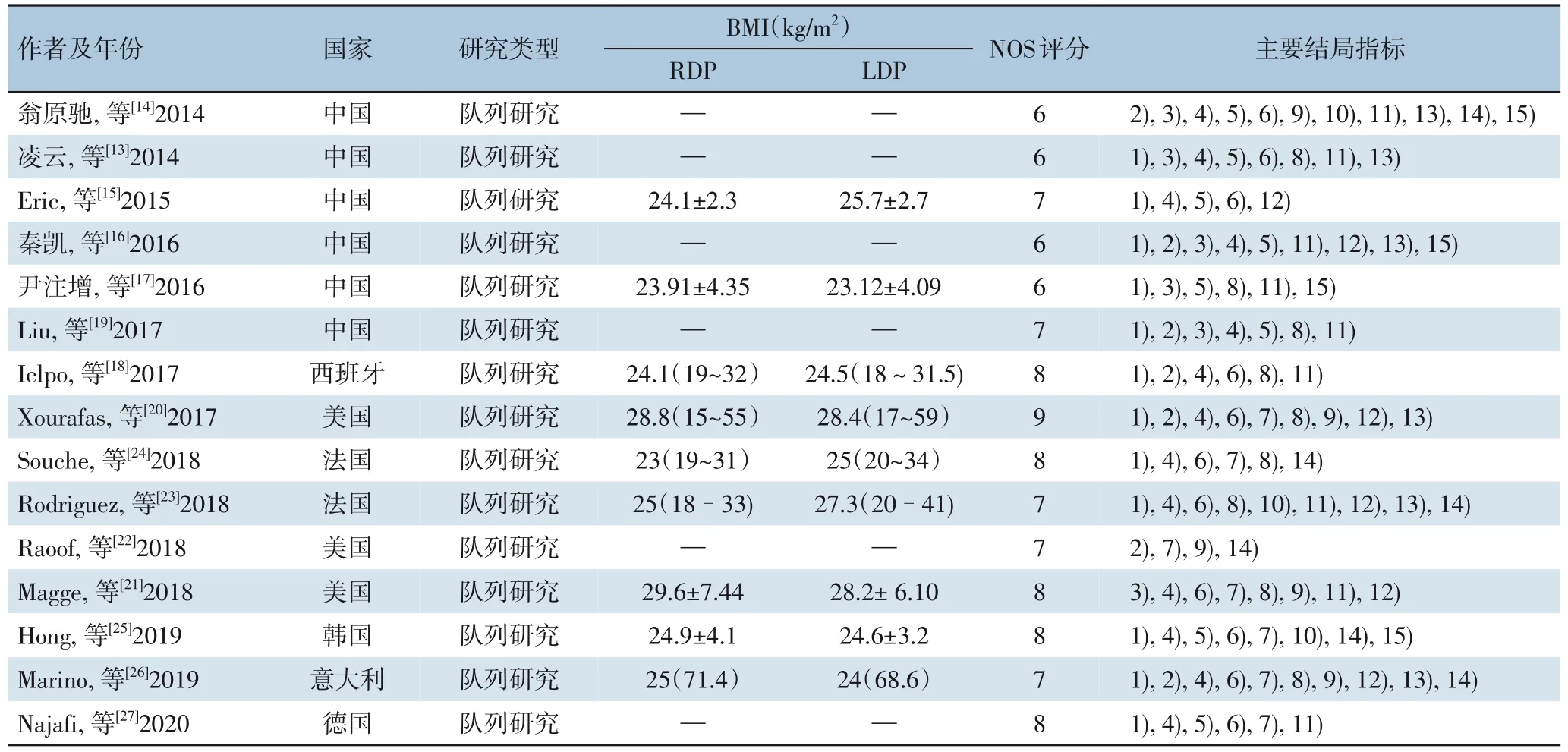
表1 纳入研究的基本特征(续)Table 1 General characteristics of the included studies(continued)
2.2 Meta分析结果
2.2.1 中转开腹率共7 项研究[14,16,18-20,22,26]报道了术中中转开腹情况。异质性检验显示各研究间无明显异质性(I2=0%,P=0.74),采用固定效应模型。Meta 分析结果显示:与LDP 相比,RDP 降低了患者术中中转开腹率(OR=0.36,95%CI=0.24~0.52,P<0.000 01)(图2)。
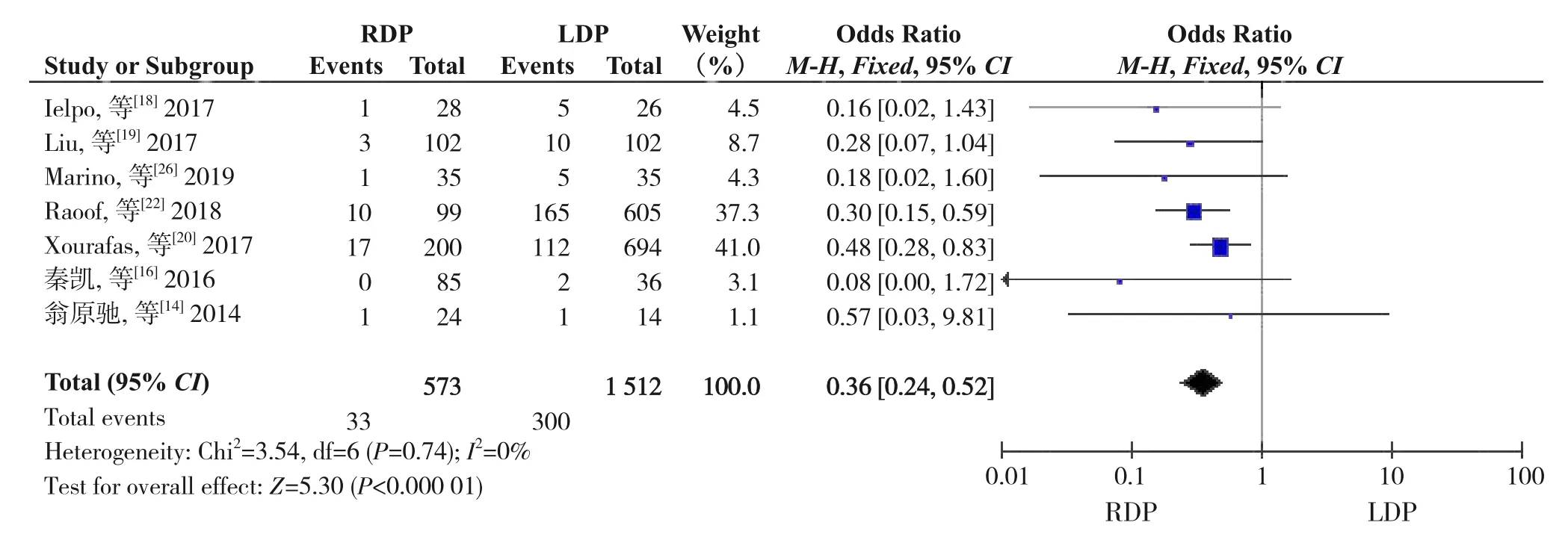
图2 中转开腹率Figure 2 Open conversion rate
2.2.2 保脾率共12 项研究[13,15-20,23-27]报道了保脾率。异质性检验显示各研究间有异质性(I2=69%,P=0.000 2),采用随机效应模型。Meta 分析结果显示:与LDP 相比,RDP 能明显提高患者术后保脾率(OR=2.31,95%CI=1.37~3.90,P=0.002)(图3)。
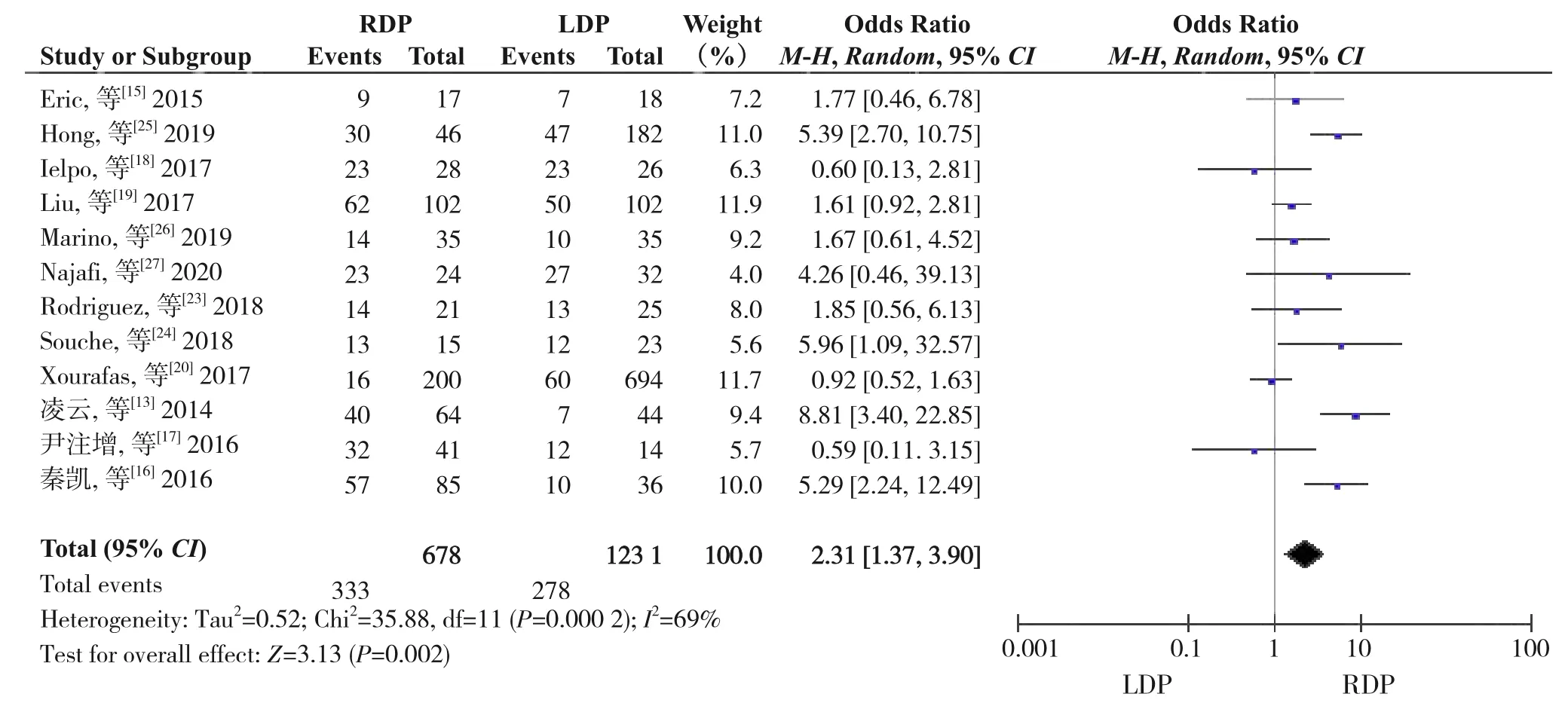
图3 保脾率Figure 3 Spleen preservation rate
2.2.3 总并发症发生率共11 项研究[13-15,18,20-21,23-27]报道了术后总并发症发生率。异质性检验显示各研究间有异质性(I2=54%,P=0.02),采用随机效应模型。Meta 分析结果显示:RDP 与LDP 术后总并发症发生率差异无统计学意义(OR=0.82,95%CI=0.55~1.21,P=0.32)(图4)。

图4 总并发症发生率Figure 4 Overall incidence of complications
2.2.4 胰瘘发生率共13 项研究[13-16,18-21,23-27]报道了胰瘘发生率。异质性检验显示各研究间无明显异质性(I2=0%,P=0.88),采用固定效应模型。Meta分析结果显示:RDP 与LDP 术后胰瘘发生率差异无统计学意义(OR=1.03,95%CI=0.83~1.28,P=0.82)(图5)。
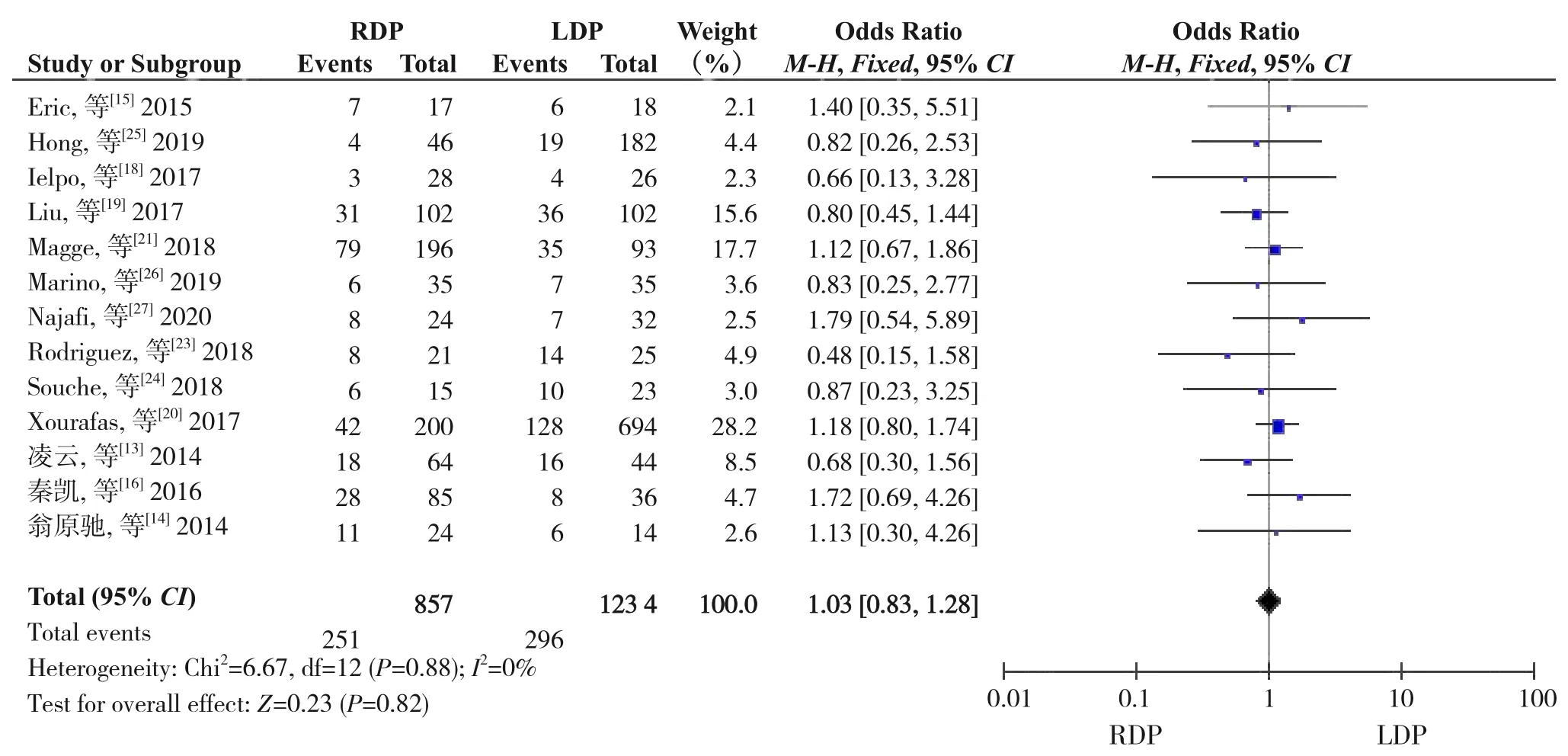
图5 胰瘘发生率Figure 5 Incidence of pancreatic fistula
2.2.5 其他主要结局指标(1)手术时间:共6 项研究[13-14,16-17,19,21]报道了手术时间。异质性检验显示各研究间有明显异质性(I2=91%,P<0.000 01),采用随机效应模型。Meta 分析结果显示,与LDP 相比,RDP明显延长了手术时间(MD=-40.09,95%CI=-77.64~-2.54,P=0.04)。(2)住院时间:共8 项研究[13-17,19,25,27]报道了住院时间。异质性检验显示各研究间无明显异质性(I2=15%,P=0.31),采用固定效应模型。Meta 分析结果显示,RDP 与LDP 住院时间差异无统计学意义(MD=-0.48,95%CI=-1.08~0.13,P=0.12)。 (3)术中出血量: 共9项研究[13-14,16-19,21,23,27]报道了术中出血量。异质性检验显示各研究间有明显异质性(I2=92%、P<0.000 01),采用随机效应模型。Meta 分析结果显示,RDP 与LDP 术中出血量差异无统计学意义(MD=-17.89,95%CI=-56.39~20.61,P=0.36)。(4)90 d再手术率:共9 项研究[13,17-21,23-24,26]报道了90 d 再手术率。异质性检验显示各研究间无明显异质性(I2=0%、P=0.85),采用固定效应模型。Meta 分析结果显示:与LDP相比,RDP 能明显降低患者术后90 d 再手术率(OR=0.46,95%CI=0.24~0.89,P=0.02)。(5)30 d 病死率:共5 项研究[14,20-22,26]报道了30 d 病死率。异质性检验显示各研究间无明显异质性(I2=27%,P=0.24),采用固定效应模型。Meta 分析结果显示,与LDP 相比,RDP 能显著降低患者术后30 d 病死率(OR=0.18,95%CI=0.06~0.53,P=0.002)。(6)90 d再入院率:共7 项研究[20-22,24-27]报道了90 d 再入院率。异质性检验显示各研究间无明显异质性(I2=0%,P=0.64),采用固定效应模型。Meta 分析结果显示:RDP 与LDP 术后90 d 再入院率差异无统计学意义(OR=1.10,95%CI=0.83~1.48,P=0.50)。⑺次要结局指标:除淋巴结清扫数外(均P<0.05),其余次要结局指标差异均无统计学意义(均P>0.05)(表2)。
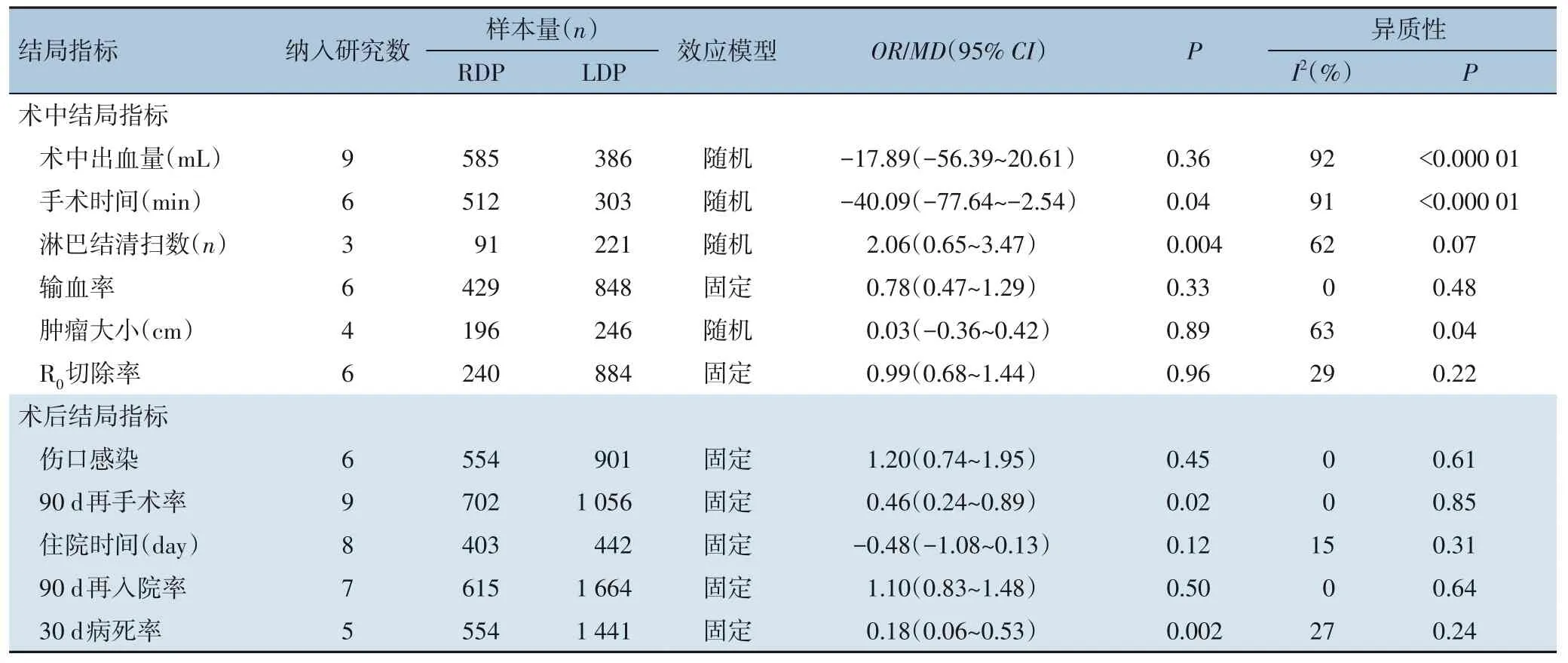
表2 其他结局指标的Meta分析结果Table 2 Meta-analysis results of other outcome variables
2.3 亚组分析结果
Meta 分析结果显示保脾率、总并发症率、手术时间这3 个结局指标异质性较高,在临床中差异较大,所以按照研究来源(国内、国外)、年龄及装机时间进行亚组分析。保脾率的亚组分析结果表明国内研究、年龄≤60 岁的研究可能是其异质性来源。总并发症率的亚组分析结果显示国别和年龄均不是其异质性高的原因,造成异质性高的原因可能是由于纳入研究中未提及关键合并症,术后出血、胆汁漏和脓肿等指标,有待进一步探索。手术时间的亚组分析结果表明国外研究、年龄>60岁、包括装机时间的研究可能是其异质性来源(表3)。
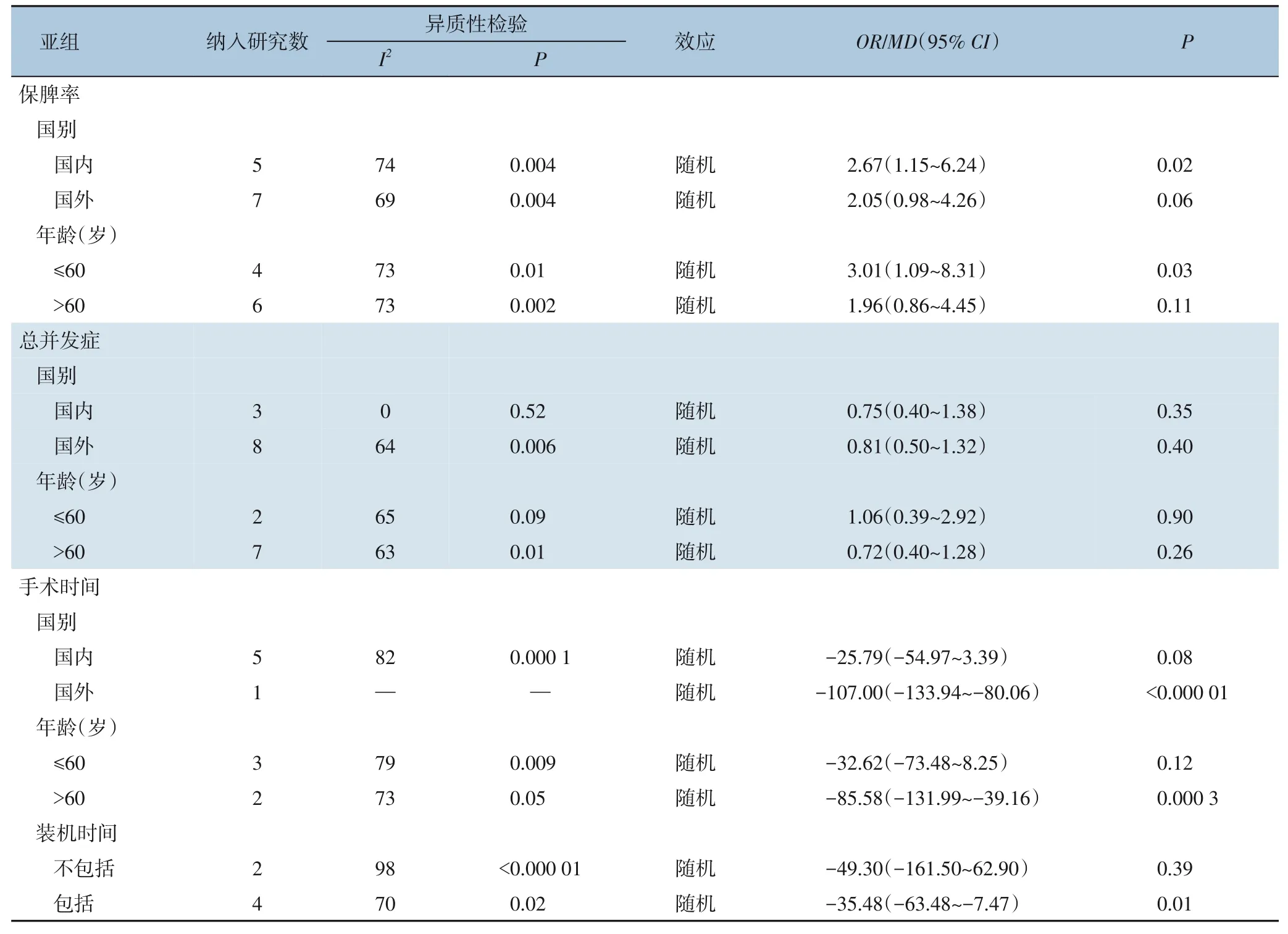
表3 亚组分析Table 3 Subgroup analysis
2.4 敏感度分析结果
对异质性较大的结局指标(保脾率、手术时间、总并发症率)采用逐一剔除纳入研究的方法进行敏感度分析,以检验相关结果的稳定性。对于保脾率和手术时间,逐一剔除研究后发现I2值变化不明显,提示结果较稳定;对于术后总并发症率,当剔除Magge 等[21]研究后异质性明显降低(I2=36%,P=0.12),且研究结果未发生方向性改变(OR=0.94, 95%CI=0.65~1.35,P=0.74);当剔除Xourafas 等[20]研究后异质性明显降低(I2=32%,P=0.15),且研究结果未发生方向性改变(OR=0.73,95%CI=0.50~1.08,P=0.11),说明这两项研究的大样本量是导致术后并发症产生统计学异质性的来源。
2.5 发表偏倚
发表偏倚通过漏斗图进行评估。选用纳入研究较多的胰瘘率这一结局指标为例,结果显示如下:各研究基本呈分布对称,提示无明显发表偏移(图6)。
图6 基于胰瘘的漏斗图Figure 6 Funnel plot based on pancreatic fistula rate
3 讨 论
近十年来,机器人辅助腹腔镜和传统腹腔镜等微创手术已广泛应用于胰腺恶性肿瘤的治疗。多项研究[5,28]表明,与传统腹腔镜手术相比,机器人辅助腹腔镜手术明显减少术中出血量和输血率,说明机器人手术系统的术中损伤远小于传统腹腔镜手术。既往研究[29]报道,机器人手术平台具有术野三维可视化、提高器械灵活性等显著优势,可方便复杂的解剖和手术重建,从而提高微创入路的可行性,减少手术时间、中转开腹率等。到目前为止,一些单独的中心发表了这两种不同技术[5]的结果,他们的比较表明,与LDP 相比,RDP与更少的失血量、更低的术后总并发症和阳性切缘率相关。然而,机器人辅助腹腔镜的安全性和有效性尚未完全确定。本Meta 分析的结果显示,与LDP 相比,RDP 保脾率高、中转开腹率低、淋巴结清扫数多、90 d 再手术率低,30 d 病死率低,但手术时间较长,而在住院时间、术中出血量、术后总并发症率、胰瘘、伤口感染等方面两组技术之间均无统计学差异。
保脾率是个非常重要的结局指标。传统术式认为胰体及胰尾肿瘤应行胰腺远端切除术联合脾切除术。但脾脏作为重要的免疫器官,在胰远端切除术中应尽可能保留,特别是对良性和交界性恶性疾病。Xu 等[30]报道DP 合并脾切除术患者比保留脾胰腺切除术患者更容易发生围手术期并发症和严重的血液病。此外,Kristinsson 等[31]通过一项27年的随访研究证实,切除脾脏的患者更易发生肺炎、脑膜炎、败血症和癌症等疾病,术后10年患病风险急剧升高。这些研究均说明在手术过程中,保脾率越高,患者术后生存时间就会大大延长。此外,Ausania 等[32]强调,RDP 患者的保脾率显著高于LDP 患者(45%vs.19%,P=0.001)。值得注意的是,本研究结果显示RDP 组的保脾率比LDP 组更高,这与最近发表的Meta 分析结果一致[33],但本研究更有优势:首先,纳入样本量多,且单方面比较RDP 和LDP 保脾率这一指标,结果更直观明了。其次,本研究也分析了患者术后再手术率和生存方面的指标,结果均表明术中保脾率越高,患者生存质量越好,再手术率越低。造成之一结果的原因可能是由于机器人手术更高的精准度,更宽阔的三维视野以及更高清的晰度视野,允许精细的手术入路[28]。
术中中转开腹率和再手术率均是对复杂手术处理能力的评价指标。本Meta 分析显示RDP 组的中转开腹率和再手术率低于LDP 组,该结论与已发表的Meta 分析的结果一致[34]。通常造成中转开腹和再手术的原因是血管损伤引起的大出血、血管粘连、肥胖和器械失效。此外,机器人辅助技术由于高清晰度的手术视野,更容易找到血管和神经,这可能是RDP 组中转开腹率和再手术率较低的原因之一。另外,由于中转开腹患者术后并发症发生率较高,预后较差,所以行机器人手术技术更可能会使恶性肿瘤患者术后恢复更快,更早进行辅助化疗。有研究[35]表明,在胰腺恶性肿瘤的微创手术中RDP 组的中转开腹率明显低于LDP 组(OR=0.33,95%CI=0.12~0.92,P=0.003)。
本Meta 分析结果显示,RDP 组的手术时间比LDP 组更长,这与之前发表的Meta 分析结果一致[29]。RDP 手术时间长的可能原因有:首先,机器人程序更复杂,需要较多的时间进行安装和对接以及在控制台花费较长的时间[6,34]。其次,由于缺乏触觉反馈,即使是经验丰富的外科医生也只能通过视觉分析来估计器械对组织的作用力,这在一定程度上延长了手术时间。最后,机器人手术开展时间短、外科大夫的经验相对不足,这也可能造成手术时间长的一个关键环节。虽然RDP 组的手术时间长十几分钟,但这可能不具有实际的临床意义,这是一种可接受的差异。Hourmont 等[36]表明随着外科医生经验的增加,机器人组的手术时间有缩短的趋势。另外,Kristinsson 等[31]指出,随着术者经验的增加,机器人组的手术时间呈下降趋势。因此,有必要进一步探索RDP 和尽快跨过其学习曲线是很有必要的。
本Meta 分析表明术后总并发症在两种技术间无统计学差异,这与以前发表的Meta 分析结果不一致[4],尤其是术后胰瘘发生率。胰瘘是DP 术后常见的并发症。既往关于DP 的报道[37]显示,胰瘘发生率不受胰残端缝合方法(吻合器或缝合)的影响。其他研究[38]也表明,与术后胰瘘相关的主要因素是残体胰腺的厚度和质地,而不是手术入路。而且在其他外科领域应用中[39],机器人手术也并未减少术后并发症的发生。
本Meta 分析表明,与LDP 相比,接受RDP 的患者30 d 病死率更低。Boone 等[40]的一项研究强调,RDP 的中位随访足以达到胰腺癌切除术后的中位生存期(~25 个月)。考虑我们的短期随访和样本量过小,不可能从中得出长期生存期等强有力的证据,还需高质量的RCT 来进一步验证。关于住院天数和术中出血量,本研究表明两种技术之间并无统计学差异。理论上讲,机器人手术是一种更精确的技术,可以减少住院时间和术中出血量。这些优点在结直肠和妇科手术中得到了一致的认可[41-42]。然而,纳入的研究没有提供成本效益数据,导致这两组的比较缺乏可信度。
尽管其他研究表明RDP 通常会给机构带来成本的增加[21],但是这一观点并未在此Meta 分析中体现。机器人手术之所以昂贵的原因可能来源于机器人仪器设备的生产成本及维护,这也导致多数临床医疗中心难以采用机器人技术。尽管机器人手术有这个缺点,但是人们认为,在未来几年,新型机器人系统的发展将增加市场竞争,降低机器人手术的总成本,减少术后并发症发生和缩短住院时间。
本研究的局限性包括:(1)纳入的15 篇文献均为队列研究,没有随机对照试验,导致本研究结果可能存在一定偏倚;(2)部分结局指标的异质性很高,可能原因是每个研究中对结局指标的定义不统一、机器人型号不同以及患者的疾病不一样导致的;(3)由于纳入文献缺少有效数据和相关描述,未能细分手术方式,未来研究者可以从手术方式进行进一步探讨,以求获得更为细致的证据;(4)关于手术费用和术后患者的生存指标方面各研究报道有限,期待未来研究可以提供更多数据;
综上所述,在保脾率,中转开腹率及患者术后生存期等问题上,RDP 凸显出更好的临床优势。但目前机器人手术成本较高和手术时间较长,限制了机器人手术的推广应用。相信随着机器人胰腺手术的不断发展,其适应证不断扩大,越来越多的患者将从中受益。此外,RDP 与LDP 临床疗效的比较仍有待前瞻性大样本的随机对照研究来进一步验证。

