新型冠状病毒相关性急性胰腺炎的认识现状
张韬,朱帅,黄耿文
(中南大学湘雅医院胰腺外科,湖南长沙410008)
新型冠状病毒肺炎(简称新冠肺炎)作为一种新型呼吸系统传染性疾病仍在全球肆虐。据世界卫生组织统计,截至2021年9月21日,新冠肺炎已造成全球2.28 亿例次的感染,累计病亡例数超过460 万[1]。新型冠状病毒(简称新冠病毒)不仅可以造成肺部损伤,还可累及心血管、胃肠道、肝、肾、脑等多种肺外器官[2]。目前已有证据显示,新冠病毒与急性胰腺炎(acute pancreatitis,AP) 的发生可能存在关联,但关联程度尚存争议[3]。在常态化疫情防控背景之下,新冠病毒相关性急性胰腺炎 (SARS-CoV-2 associated acute pancreatitis,SAAP) 存在的可能性值得临床高度重视。
1 新冠病毒与AP的关系
众所周知,胆石症、高甘油三酯血症和酒精是引起AP 的常见病因。病毒也是AP 的确切病因之一,但占比不到1%,常见的可引起AP 的病毒包括巨细胞病毒、腮腺炎病毒和EB 病毒等[4]。
自新冠肺炎疫情暴发以来,已有较多的病例报道和回顾性研究提示新冠病毒与AP 存在关联。Wang 等[5]首先报道,52 例新冠肺炎患者中有9 例(17%)出现血清淀粉酶和/或脂肪酶的异常增高,虽均未达到AP 的诊断标准,但提示胰腺可能是新冠病毒攻击的潜在靶器官。此后,世界各地陆续报道了新冠肺炎合并AP 的病例和队列研究。笔者在PubMed 上检索了2019年12月—2021年5月间已发表的SAAP 病例报道30 篇[6-35],共33 例患者。在这些患者中,32 例(97.0%)患者未发现胆源性、酒精性或高脂血症等常见病因,亦未证实自身免疫性因素或药源性因素等罕见病因,故推测新冠病毒可能为AP 的致病因素。
Inamdar 等[36]对疫情期间美国纽约12 家医院收治的48 012 例住院患者进行回顾性分析,其中AP患者189 例,新冠病毒感染例数为11 883 例。在新冠病毒阴性的AP 患者中,21%(33/157)未明确病因,而在新冠病毒阳性的AP 患者中,这一比例高达69%(22/32)。在Dirweesh 等[37]报道中也有类似结果。新冠病毒感染的AP 患者中,特发性胰腺炎的比例显著高于新冠病毒阴性的AP 患者,提示新冠病毒可能是这部分特发性胰腺炎的致病原因。
然而,需要特别注意的是,由于新冠病毒的传染性,AP 患者合并新冠病毒感染时,临床医师往往顾忌或很难对患者进行充分的辅助检查,如内镜超声(EUS)等,从而可能导致胆道泥沙样结石等AP 病因的漏诊[38-39]。因此,不完善的辅助检查可能是新冠病毒感染的AP 患者特发性胰腺炎比例较高的原因之一。此外,治疗新冠肺炎的药物也可能引起AP[32],且药物源性AP 的诊断很难和病毒性胰腺炎相鉴别。因此,新冠病毒感染患者中特发性胰腺炎比例较高虽然提示新冠病毒可能是AP 的致病因素,但由于偏倚因素较多,尚不足以据此断定新冠病毒就是AP 的病因。根据现有报道,新冠肺炎患者的AP 发病率并未明显增加。西班牙的一项多中心回顾性研究[40]显示,63 822 例新冠肺炎患者中,AP 的发病率仅为0.07%。Inamdar等[36]研究亦显示,新冠肺炎患者中AP 的发病率为0.27%(32/11 883),尚低于队列中AP 的总发病率(0.39%)。
基础研究表明,冠状病毒通过跨膜丝氨酸蛋白酶2 (transmembrane serine protease 2,TMPRSS2)预处理后的刺突蛋白与人体细胞表达的血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)结合进入靶细胞[41],靶细胞上ACE2 和TMPRSS2 共表达是病毒进入细胞的必要条件。这两种蛋白在胃肠道上皮细胞表达丰富。Liu 等[42]通过RNA 测序发现ACE2 mRNA 在胰腺组织中有表达,且在胰腺组织中的表达水平高于肺,并通过单细胞测序发现,胰腺外分泌细胞和胰岛细胞中均表达ACE2 mRNA。Coate 等[43]在胰腺导管上皮细胞中检测到ACE2 和TMPRSS2的共表达。Kusmartseva 等[44]发现ACE2 mRNA 及蛋白在人胰管上皮细胞和微血管内皮细胞中表达水平较高,并且在1 例新冠肺炎患者的胰腺导管上皮中检测到新冠病毒核蛋白。此外,Schepis 等[45]在胰腺假性囊肿囊液中分离出新冠病毒RNA,且病毒载量较高。上述实验研究表明,表达ACE2 受体的胰腺细胞可能成为新冠病毒攻击的靶细胞,SAAP 的分子基础是存在的(图1)。尽管存在上述实验证据,但目前为止,能确切证明新冠病毒就是AP 新病因的证据还不充分,比如,尚未能在动物模型中证明新冠病毒引起AP 的致病性,也没有任何证据表明新冠病毒的载量与AP 发生率相关等。由于新冠病毒刺突蛋白与野生型小鼠模型的ACE2 受体相互作用较弱,构建新冠病毒感染的小鼠模型存在很大困难[46]。而且,由于人群中新冠病毒感染者AP 的发病率很低,新冠肺炎动物模型发生AP 亦可能是罕见的。因此,要在新冠肺炎动物模型中证明新冠病毒就是AP 的病因将面临很大的困难。
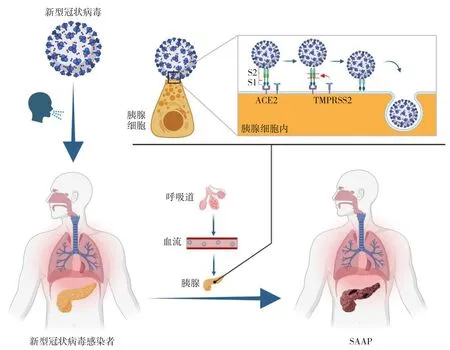
图1 新冠病毒相关性急性胰腺炎的可能发生机制(S1:刺突蛋白亚基1;S2:刺突蛋白亚基2)Figure 1 The potential mechanism of SAAP(S1:spike protein trimer 1;S2:spike protein trimer 2)
2 SAAP的诊断
在新冠病毒核酸检测阳性的基础上,符合急性胰腺炎诊断标准,即以下标准中的任意两条:(1)符合AP 特点的腹痛;(2)血淀粉酶和/或脂肪酶升高至正常上限3 倍以上;(3)影像学表现符合AP特点。同时需排除其他已知的AP 病因。
由于临床医生对于此病的认识不深刻以及病毒的传染性等多种原因,SAAP 可能被漏诊或被低估。多项荟萃分析和观察性研究结果显示,新冠肺炎患者的消化道症状发生率约为17%~20%,其中腹痛发生率为1%~9%[47-49]。在病情危重的新冠肺炎患者中,腹痛的症状可能被掩盖,此时,AP 的诊断主要依赖于血淀粉酶和/或脂肪酶与影像学检查,但AP 的诊断需要由临床表现来启动,故危重症新冠肺炎患者中AP 可能被漏诊[20]。因此,临床医师应重视新冠肺炎患者的消化道症状,尤其是对腹痛症状和体征的评估,尽可能避免SAAP 的漏诊[50]。
研究[42]表明,血淀粉酶和/或脂肪酶升高在新冠肺炎患者中的发生率约为10%~30%,而且重症新冠肺炎患者中淀粉酶增高的比例明显高于轻症患者(17.9%vs. 1.85%)。现已公认,新冠肺炎是一个全身性疾病,可累及肺、心、肝、肾、胃肠道和胰腺等多个器官。血淀粉酶和/或脂肪酶异常并非胰腺炎的特异性指标。酸中毒、糖尿病和肾脏受累等均可导致血淀粉酶和/或脂肪酶的升高。因此,血清淀粉酶和/或脂肪酶异常可能更多地反映患者整体病情的严重程度。
3 SAAP的严重程度分级和预后
修订后的亚特兰大分级标准基于局部并发症和器官功能衰竭两个方面将AP 分为轻症、中度重症和重症[51]。在SAAP 患者中,由于新冠肺炎和AP这两种疾病均可诱发系统性炎症反应,进而导致呼吸、循环、肾脏等多器官功损害。因此,在对SAAP 进行严重程度分级时,应审慎地进行判断。Stevens 等[33]报道1 例10 岁SAAP 患者病程中出现多器官功能衰竭,但CT 仅显示水肿性胰腺炎,并无胰腺坏死积液。作者认为,若将此病例归为重症胰腺炎,显然不妥。Bulthuis 等[52]报道的5 例SAAP亦存在类似情况。根据现有文献资料,SAAP 患者的器官功能损害更可能与新冠肺炎有关,而并非胰腺炎所致。在对SAAP 进行严重程度评估时,一定要结合影像学证据来进行综合评估。
SAAP 有两种临床类型:一类是以AP 为首发表现;另一类是以新冠肺炎为首发表现,继而在病程中发生AP。这两种类型的SAAP 的预后特点不相同。Kumar 等[53]研究表明,以AP 为首发表现的SAAP 患者总体预后优于以新冠肺炎为首发表现的SAAP 患者。这提示,以AP 为首发表现的SAAP 可能是新冠病毒攻击胰腺所致的病毒性胰腺炎,而以新冠肺炎为首发表现的SAAP,其发生可能为全身炎症反应失衡所致的多器官功能损害的表现。
研究[54]表明,新冠病毒感染对AP 的预后有不利影响。一项国际多中心队列研究纳入1 777 例AP患者,其中包括149 例新冠病毒阳性和1 628 例新冠病毒阴性患者。结果显示,新冠病毒阳性组的30 d 病死率显著高于新冠病毒阴性组(分别为14.7%和2.6%)。在Dirweesh 等[37]的队列以及近期的荟萃分析[55]中也得到类似的结果。但目前尚无可靠证据表明,AP 的发生会对新冠肺炎的预后产生影响。现有资料显示,SAAP 大多为水肿性胰腺炎或轻型胰腺炎,对新冠肺炎患者的临床结局影响较小。未来,需要更大样本量的研究来证明AP 对新冠肺炎患者预后的可能影响。
4 总 结
目前有证据表明,新冠病毒与AP 的发生很可能存在密切关联,但根据现有证据,尚不足以确定新冠病毒就是AP 的新病因,未来需要更严谨的科学研究来证明,包括尸检、活检等病理学研究,动物模型的构建以及胰腺原代细胞实验的开展等。在新冠肺炎患者中,临床医师应高度警惕并重视SAAP 发生的可能,并严格按照现行的诊断标准对AP 进行诊断和分级。虽然大多数SAAP 是水肿性胰腺炎或轻型胰腺炎,但一旦出现胰腺坏死或器官功能衰竭,将导致更高的病死率。

