局部高压氧喷联合物理冷疗治疗放射性皮肤损伤的疗效观察▲
胡秀茹 许文秀 沈振艳 何新颖 毕建强 孙云川
(河北省沧州中西医结合医院放化疗一科,沧州市 061000,电子邮箱:han416461@163.com)
放射治疗(简称放疗)是治疗恶性肿瘤的一种重要手段,而急性放射性皮肤损伤是接受放疗的患者最常见的并发症之一。随着放疗剂量的增加,患者照射野皮肤会表现出红斑、色素沉着、瘙痒、水泡、干性脱皮、糜烂等症状,进一步可发展成湿性皮炎,严重者可发生皮肤感染、溃疡及坏死[1]。放射性皮肤损伤不仅严重影响患者的生活质量,还有可能导致其放疗中断,使放疗效果降低。放射性皮肤损伤是因皮肤受到放射线(主要为β和γ射线)作用而产生的一种炎性损伤,其发生和严重程度与放射线种类、照射剂量、患者自身因素等均密切相关[2]。研究显示,皮肤受照射单次剂量达5 Gy就会有红斑出现,剂量达30~40 Gy时会形成湿性反应,甚者会导致感染、放射性坏死及经久不愈的溃疡[3]。目前临床对放射性皮肤损伤还没有统一的防治措施,除了常规放疗护理外,主要给予外用药膏和各种物理疗法对症处理。三乙醇胺乳膏可通过楔合效应使局部创伤皮肤水分丢失减少,微循环速度加快,从而减少放疗对皮肤的损伤作用。局部冷疗是防治放射性皮肤损伤的常用方法,其可降低局部皮肤组织的代谢功能,改变细胞通透性,从而使局部组织渗出减少[4]。研究显示,放疗前采取局部冷疗可以在一定程度上减少皮肤受到的辐射损伤;放疗后采取冷疗能减轻皮肤的灼热感和疼痛感,还能抑制中性粒细胞在受损皮肤的局部浸润,从而减轻组织损伤[5]。但放射性皮肤损伤不仅伴有皮肤完整性的破坏和正常组织的丢失,还伴有皮肤正常功能的损伤。而组织的新生需要足够的氧和营养物质,如局部组织缺氧则会直接导致和加剧皮肤创面的延迟愈合[6]。局部高压氧喷治疗作为一种特殊的治疗手段,可以改善组织缺血缺氧,促进局部血液循环,还对一些病原微生物如厌氧菌等有较强的抑制作用,能减少分泌物的产生,增加局部组织的营养和抵抗力,而且该疗法操作简单,无毒副作用,成本低廉,其在创伤、糖尿病足、压疮和放射性皮肤损伤等方面的应用均取得较好的效果[7]。本研究探讨局部高压氧喷联合物理冷疗治疗放射性皮肤损伤的疗效,现报告如下。
1 资料与方法
1.1 临床资料 选取2016年1月至2019年12月我院收治的90例接受放射治疗且出现放射性皮肤损伤的恶性肿瘤患者作为研究对象。诊断标准:根据美国肿瘤放射协作组制订的急性放射性皮肤损伤分级标准进行诊断和分级[2],放疗后皮肤无变化为0级,出现滤泡样暗红色,出汗减少,干性脱皮等表现为Ⅰ级;皮肤出现鲜红色、触碰性红斑,或中度水肿、或片状湿度脱皮等表现为Ⅱ级;出现皮肤褶皱以外部位凹陷性水肿或融合性湿性脱皮等表现为Ⅲ级;出现皮肤出血、溃疡、坏死等为Ⅳ级。纳入标准:(1)经病理学诊断确诊为头颈部恶性实体肿瘤或乳腺癌;(2)首次接受放射治疗;(3)卡氏功能状态评分≥60分;(4)年龄18~75岁;(5)预计生存时间至少6个月。排除标准:(1)头颈部及胸部皮肤感染或患有皮肤病者;(2)照射区域皮肤有烧伤或烫伤史,皮肤不完整者;(3)敏感性皮肤者;(4)合并糖尿病等易导致皮肤溃疡疾病者;(5)心、肝、肺、肾等重要器官功能严重障碍者;(6)放疗期间同时行化疗者;(7)存在智力及精神障碍,语言表达能力差,对自身情况无法判断者;(8)有结缔组织病史者;(9)孕妇或哺乳期妇女。采用随机数字表法将患者随机分为A组、B组、C组,各30例。A组男性22例,女性8例;年龄24~73(46.73±3.86)岁;肿瘤类型:鼻咽癌9例,乳腺癌12例,喉癌6例,食管癌3例;皮肤损伤分级:Ⅱ级20例,Ⅲ级10例;皮损部位:腋窝16例,头颈部11例,胸壁3例。B组男性24例,女性6例;年龄23~74(46.95±4.10)岁;肿瘤类型:鼻咽癌10例,乳腺癌10例,喉癌6例,食管癌4例;皮肤损伤分级:Ⅱ级21例,Ⅲ级9例;皮损部位:腋窝18例,头颈部8例,胸壁4例。C组男性20例,女性10例;年龄21~75(44.91±5.81)岁;肿瘤类型:鼻咽癌10例,乳腺癌13例,喉癌5例,食管癌2例;皮肤损伤分级:Ⅱ级19例,Ⅲ级11例;皮损部位:腋窝15例,头颈部13例,胸壁2例。3组患者年龄、性别、肿瘤类型、皮肤损伤分级和皮损部位等一般资料比较,差异均无统计学意义(均P>0.05)。本研究获得我院医学伦理委员会审核通过,患者均自愿参与本研究且签署知情同意书。
1.2 方法
1.2.1 放疗的常规护理:所有患者均应用本院放疗科的Elekta Synergy医用直线加速器进行治疗,给予6 MV X射线常规分割照射(5 次/周,靶区域吸收剂量为2 Gy/次),根据患者临床体征和影像学检查结果确定照射范围。放疗过程中均给予患者常规护理干预,具体方法为:治疗前护理人员向患者解释和强调皮肤护理和急性放射性皮肤损伤防治的重要性,指导患者日常用温水清洁皮肤,保持照射野皮肤洁净、完好及照射野界限清楚,避免摩擦;告知患者不佩戴项链,着吸水性好、宽松的棉质衣服;告知患者避免在放射野皮肤使用香水、氧化锌护肤霜、含铝除臭剂等产品,以及碘酒、酒精等刺激性消毒剂;告知患者不可于照射野皮肤进行注射操作或贴胶布,若出现脱皮、瘙痒、脱屑等症状,严禁撕扯、抓挠,可使用温热毛巾轻轻拍打以止痒。在常规护理基础上,所有患者在每日的晨起、睡前和每次放疗后做好照射野局部皮肤的清洁处理,局部应用医用射线防护喷剂涂抹,方法为:于照射野局部皮肤表面约10 cm处喷涂医用射线防护喷剂,范围以超过照射野边缘1 cm为宜,2次/d,从放疗开始用药直至放疗结束。
1.2.2 放射性皮肤损伤的治疗:A组患者清洁皮损创面后常规使用地塞米松混合液、湿润烧伤膏及康复新液喷洒湿敷等,同时给予物理冷疗,即使用包裹冰袋的毛巾进行局部冰敷,时间为20~30 min/次,1次/d,放疗开始前进行,注意避开耳廓和后枕部位,冰袋温度和毛巾厚度以患者耐受为宜,连续治疗直至创面愈合。B组在A组治疗基础上应用本院研制的直流氧喷装置 (实用新型专利,专利号:ZL2012 2 0228057.3)[8]进行高压氧喷治疗,自制高压喷枪连接氧气管后,对皮损创面喷经过70%~80%乙醇湿化后的氧气并进行局部直吹,氧流量为8~10 L/min,20~30 min/次,2~3 次/d,连续治疗直至创面愈合。可根据皮损创面潮湿程度和分泌物情况调整氧喷时间。C组患者使用三乙醇胺乳膏治疗,清洁皮损创面后在照射野皮肤均匀涂抹三乙醇胺乳膏,厚度约1~2 mm,轻轻按摩至药物吸收,2~3 次/d,连续治疗直至创面愈合。
1.3 观察指标
1.3.1 疗效评价[9]:治疗12 h后放射性皮损创面分泌物明显减少,疼痛明显缓解,连续治疗2~3 d后创面基本愈合为显效;治疗后12 h创面分泌物逐渐减少,创面损伤范围明显变小变浅,疼痛减轻,创面愈合面积达30%以上,连续治疗4~5 d后创面基本愈合为有效;治疗5 d及以上疼痛持续,症状无明显好转,创面损伤范围无明显减小,创面愈合面积不足30%,甚至出现局部渗出伴有脓性分泌物增多,需考虑采用其他方法进行治疗为无效。总有效率为显效率和有效率之和。
1.3.2 创面愈合时间及换药次数:创面愈合时间为创面完全上皮化所需的时间(创面愈合标准为创面完全由上皮组织覆盖,无渗出物),换药次数为从出现放射性皮肤损伤到创面愈合过程所需要换药的次数。
1.3.3 疼痛评分和卡氏功能状态评分评价[4]:治疗前和放疗结束后应用视觉模拟量表(Visual Analogue Scale,VAS)评价疼痛情况,用一条长10 cm的横线,标注“0”端和“10”端,“0”为无痛,“10”为剧痛,患者根据自己疼痛的感觉在直线上进行标注。治疗前和放疗结束后采用卡氏功能状态评分评价患者技能状态,包括日常生活和工作能力的评价,总分0~100分,评分越高表示功能状态越好,91~100分表示功能状态良好,适应正常生活;81~90分为非依赖级(生活自理级);60~80分为半依赖级(生活半自理级);60分以下为依赖级,生活需要别人帮助。
1.3.4 局部皮肤感染率和瘢痕形成率:对体温持续超过37.5℃,排除肺、口腔、胃肠道等其他部位感染情况下,采集照射野皮肤分泌物进行培养,若培养出病原体则诊断为感染;首程放疗结束后3个月内跟踪随访患者瘢痕形成情况。
1.3.5 血清表皮生长因子和炎症因子含量检测:分别在治疗前和放疗结束后抽取患者外周静脉血4 mL,室温下放置2 h后离心(2 500 r/min,10 min),取上清液置于-80℃冰箱中保存。应用酶联免疫吸附测定法检测血清表皮生长因子(epidermal growth factor,EGF)和炎症因子肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素(interleukin,IL)-1、IL-6、IL-10水平。试剂盒均购买自深圳欣博盛科技有限公司,严格按照试剂盒说明书进行操作。
1.4 统计学分析 采用SPSS 23.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用t检验;计数资料以例数(百分比)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3组患者疗效的比较 3组患者疗效比较,差异有统计学意义(H=12.879,P<0.001),其中B组疗效优于A组(P<0.05);3组患者总有效率比较,差异具有统计学意义(χ2=10.320,P=0.006),其中B组总有效率高于A组和C组(P<0.05)。见表1。

表1 3组患者疗效的比较[ n(%)]
2.2 3组患者皮肤损伤愈合时间和换药次数的比较 3组患者的皮肤损伤愈合时间、换药次数比较,差异具有统计学意义(P<0.05),B组、C组、A组皮肤损伤愈合时间依次延长,换药次数依次增加(P<0.05)。见表2。
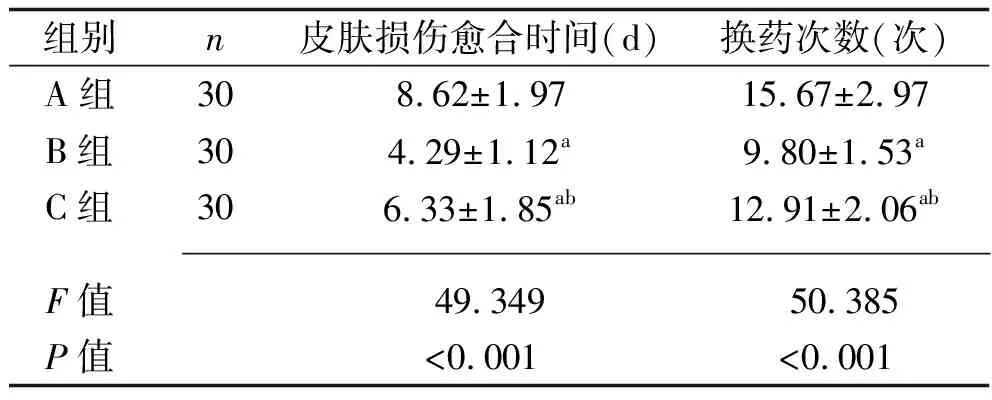
表2 3组患者皮肤损伤愈合时间和换药次数的比较(x±s)
2.3 3组患者治疗前后疼痛VAS评分、卡氏功能状态评分的比较 治疗前,3组患者疼痛VAS评分、卡氏功能状态评分比较,差异均无统计学意义(均P>0.05);治疗后,3组患者疼痛VAS评分较治疗前降低、卡氏功能状态评分较治疗前升高,且B组疼痛VAS评分低于C组、A组,卡氏功能状态评分高于C组、A组(P<0.05)。见表3。

表3 3组患者治疗前后疼痛VAS评分、卡氏功能状态评分的比较(x±s,分)
2.4 3组患者放射性皮肤感染率和瘢痕形成率的比较 A组皮肤感染率、瘢痕形成率分别为10.00%(3/30)和3.33%(1/30),B组无皮肤感染发生和瘢痕形成,C组皮肤感染率、瘢痕形成率分别为6.67%(2/30)和3.33%(1/30),3组皮肤感染率、瘢痕形成率比较,差异均无统计学意义(χ2=2.965,P=0.227;χ2=1.023,P=0.560)。
2.5 3组患者治疗前后血清EGF和炎症因子水平的比较 治疗前,3组患者血清EGF、TNF-α、IL-1、IL-6、IL-10水平比较,差异均无统计学意义(均P>0.05)。治疗后,3组患者血清TNF-α、IL-1水平均较治疗前降低,血清EGF、IL-10水平较治疗前升高,B组和C组血清IL-6水平亦较治疗前降低(均P<0.05);B组血清TNF-α、IL-1、IL-6水平均低于A组和C组,血清EGF、IL-10水平均高于A组和C组(均P<0.05)。见表4。
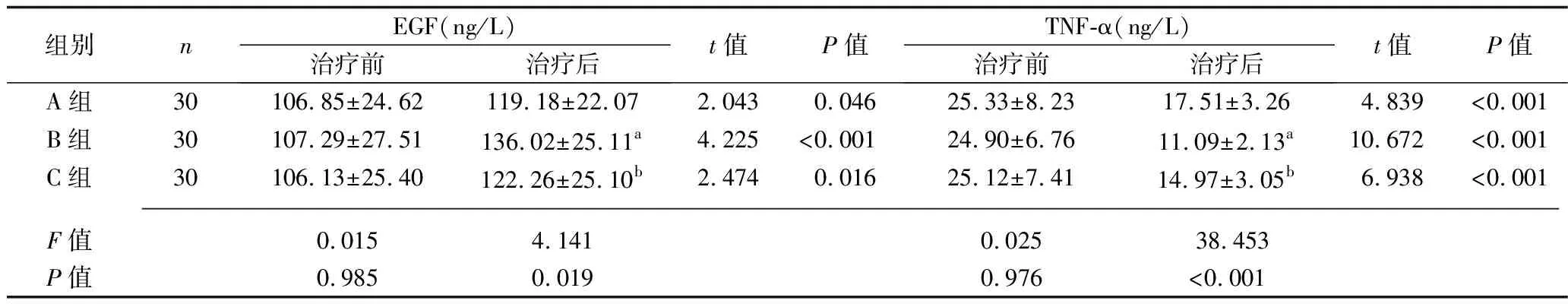
表4 3组患者治疗前后血清EGF和炎症因子水平的比较(x±s)

组别nIL-1(μg/L)治疗前治疗后t值P值IL-6(ng/L)治疗前治疗后t值P值IL-10(ng/L)治疗前治疗后t值P值A组301.97±0.261.62±0.304.829<0.00142.49±7.7439.64±8.521.3560.1807.41±2.309.10±2.982.4590.017B组302.02±0.340.64±0.17a19.884 <0.00141.83±8.5629.31±7.60a5.991<0.0017.19±1.8011.52±2.79a7.143<0.001C组302.10±0.551.20±0.35b7.562 <0.00142.06±7.9635.27±8.44b3.206 0.0027.42±1.6510.32±2.47b5.347<0.001 F值0.79790.1240.05112.0040.1355.788P值0.454<0.0010.950<0.0010.8740.004
3 讨 论
除化疗、手术、靶向治疗外,放疗是恶性肿瘤最主要的一种治疗手段,但几乎所有患者在放疗期间都会产生不同程度的皮肤反应,其出现时间和严重程度与放射性物质的性质、剂量等密切相关。放射性物质穿透皮肤不可避免地造成一定程度的损伤,轻者出现皮肤温度升高、瘙痒、红斑、色素沉着,严重者会出现皮肤表面水肿、破溃、出血、坏死甚至感染。
目前认为放射性皮肤损伤的发生与射线破坏皮肤细胞DNA和(或)DNA合成和分化失衡有关,长时间的放射线照射会对细胞DNA产生电离辐射,导致基底细胞中的前体细胞丧失其再生功能,无法产生新的细胞,同时皮肤上皮细胞持续丢失,脱落的表层细胞如果无法及时增殖,上皮细胞质不能及时补充,就会引起皮肤损伤[10]。辐射首先会导致照射部位的毛细血管发生反射性扩张,局部发生充血性反应,并出现红斑。随着放疗的进行,照射部位血管进一步受损,发生微循环障碍,血管内皮细胞因此会出现肿胀、增生、管腔变窄、管壁增厚、闭塞等病理变化,影响局部组织的血供、氧供,物质交换受阻,进而导致皮肤组织细胞发生变性、坏死和广泛纤维化。放射性皮肤损伤不仅会给患者带来巨大的疼痛,还会影响放疗的正常进行,同时也会加重患者的经济负担。因此,做好放射性皮肤损伤的防治成为临床关注的重点。
对于放射性皮肤损伤,临床上主要采取中断放疗、休息、止痛、抗炎等对症治疗,但中断放疗时间过长会降低放疗的生物效应,影响肿瘤局部控制疗效。有学者提出,治疗放射性皮肤损伤的关键在于早期即给予创面封闭止痛、保护创面、减轻炎症反应、预防感染和刺激上皮再生等[11]。三乙醇胺乳膏的主要成分为三乙醇胺,是一种有良好水合作用的水包油型白色乳膏,涂抹后皮肤可迅速吸收其水分,使照射野皮肤保持湿润,从而降低患者的不适感。其通过渗透和毛细作用原理发挥引流和清洁的双重作用,而且能通过深部水合作用加快皮肤血流速度,促进渗出物的排出,进而可促进皮肤的新陈代谢,补充可促进表皮细胞增殖和代谢的生物活性因子,进而促使受损皮肤细胞的修复和再生[12]。此外,三乙醇胺乳膏还能使损伤皮肤巨噬细胞数量增加,IL-1浓度升高,IL-6浓度降低,进而使炎症反应得到有效缓解,并促进成纤维细胞的增生和胶原合成,修复损伤皮肤,并对上皮组织产生保护作用[13]。有研究显示,三乙醇胺乳膏不仅能延迟急性放射性皮肤损伤的发生,还能有效缓解损伤程度,使患者顺利完成放疗[14]。本研究结果显示,治疗后C组患者疼痛VAS评分、血清TNF-α、IL-1、IL-6水平较治疗前降低,卡氏功能状态评分、血清EGF、IL-10水平均较治疗前升高(均P<0.05),提示采用三乙醇胺乳膏治疗放射性皮肤损伤可以缓解疼痛,减轻炎症反应。
冷疗是在人体表面应用低于人体温度的物质,通过神经传导来降低局部组织温度,具有缓解疼痛、减轻局部充血和水肿、降低体温、控制炎症扩散等作用[15]。研究表明,局部冷疗对放射性皮肤损伤和放化疗引起的口腔黏膜炎有一定的预防和治疗作用[5]。当皮肤温度下降时,末梢血管收缩,血液流速减慢,皮肤细胞受到的毒性作用降低;在低温环境下组织细胞对各种有害刺激的敏感度下降,细胞不会产生应答反应。此外,皮肤温度降低时,细胞耗氧量、代谢率均下降,减少机体因放疗的毒性作用而发生的代谢障碍,从而保护皮肤细胞。有研究指出,在局部皮肤喷涂射线防护剂的基础上联合给予物理冷疗可以降低局部损伤皮肤的温度以及局部神经敏感性,消除疼痛,有效延迟放射性皮肤损伤的发生和减轻其严重程度[12,16]。
局部高压氧喷可在创面形成一个高氧环境,增加局部组织氧供,从而纠正和改善创面的缺血和缺氧状态,提高正常组织细胞氧合,促进坏死组织氧化分解,从而有利于创面的愈合。同时,局部给氧能促进扩张的毛细血管收缩,减少血管渗出,改善局部血液循环,减轻组织肿胀,从而有效延缓和预防放射性皮肤损伤的发生;通过局部高压氧喷的方式能使创面局部氧分压升高,增加创面组织氧供,改善有氧代谢,从而加速肉芽组织的生长,而且作用于创面的高压氧流可以抑制厌氧菌的代谢,还能保持创面的干燥,抑制细菌生长繁殖,减少局部分泌物的产生,从而增强局部组织的抵抗力,减少了放射性皮肤损伤的感染率[17]。在临床上,局部高压氧喷作为一种辅助治疗手段,在创伤、糖尿病足、压疮等疾病的治疗中均获得较好的效果,其用于治疗放射性皮肤损伤也可有效缓解局部创面组织氧供不足的问题,促进伤口愈合[18-19]。本研究结果显示,治疗后3组患者疼痛VAS评分、血清TNF-α、IL-1、IL-6水平较治疗前降低,卡氏功能状态评分、血清EGF、IL-10水平均较治疗前升高(均P<0.05),提示冷疗可以减轻患者疼痛,缓解炎症反应,但B组疼痛VAS评分、血清TNF-α、IL-1、IL-6水平低于C组和A组,卡氏功能状态评分、血清EGF、IL-10水平高于C组和A组(P<0.05),且B组疗效优于A组,总有效率高于A组和C组(P<0.05),提示局部高压氧喷联合冷疗治疗放射性皮肤损伤具有协同作用,能有效减轻放射性皮肤损伤的疼痛程度,减轻机体炎症水平,加速创面的愈合。本研究结果还显示,B组、C组、A组皮肤损伤愈合时间依次延长,换药次数依次增加(P<0.05)。提示局部高压氧喷联合冷疗治疗还可以缩短创面愈合时间,减少换药次数。但3组患者皮肤感染发生率和瘢痕形成率差异无统计学意义(P>0.05),可能与本研究样本量较少有关。
综上所述,局部高压氧喷联合物理冷疗用于治疗放疗后急性放射性皮肤损伤患者可以提高疗效,减轻机体炎症反应,缓解疼痛,促进皮肤损伤的快速愈合,具有较高的临床推广应用价值。

