术后采用不同周期TEC辅助化疗方案治疗局部晚期乳腺癌患者的临床效果▲
陈建生 龚江波 潘淑波 戎吉龙
(南京医科大学附属苏州科技城医院1 普外二科, 2 消化内科,江苏省苏州市 215000,电子邮箱:dopg584p@sina.com;3 温州医科大学附属慈溪医院普外科,浙江省慈溪市 315300)
乳腺癌是临床上常见的恶性肿瘤,严重威胁女性健康,其中Ⅲ期乳腺癌患者原发病灶大、区域淋巴结转移率高,属局部晚期乳腺癌[1]。乳腺癌术后行辅助化疗有助于清除局部区域淋巴结及远处脏器的亚临床微小转移灶,从而降低远处转移风险,延长患者的生存期,其已成为目前治疗局部晚期乳腺癌患者的首选方案[2-3]。因此,提高辅助化疗疗效是局部晚期乳腺癌治疗的重要目标。2020年《NCCN乳腺癌临床实践指南(中国版)》解读[4]推荐使用TEC(多西他赛+表柔比星+环磷酰胺)方案治疗Ⅲ期乳腺癌,但是最佳的使用周期目前尚未统一[5-8]。因此,本研究比较不同周期TEC辅助化疗方案治疗局部晚期乳腺癌患者的临床效果,旨在为该分期患者的临床治疗提供更多依据。
1 资料与方法
1.1 临床资料 回顾性分析2014年4月至2017年2月温州医科大学附属慈溪人民医院及南京医科大学附属苏州科技城医院收治的94例局部晚期乳腺癌女性患者的临床资料,所有患者术后均采用TEC方案进行辅助化疗。纳入标准:(1)均经空心针穿刺活检证实为浸润性乳腺癌,肿物最大径>2 cm或乳腺原发癌灶侵犯皮肤,或腋窝存在融合的肿大淋巴结或锁骨有肿大淋巴结;(2)原发肿瘤-区域淋巴结-远处转移(tumor-node-metastasis,TNM)分期为ⅢA期、ⅢB期和ⅢC期者;(3)预期生存期超过3个月;(4)患者资料完整,患者均知情并签署知情同意书。排除标准:(1)既往有放化疗病史及多发患者;(2)合并心、肝、肾等其他严重性系统疾病者;(3)因精神异常或其他社会心理因素无法完成本次试验者。根据TEC辅助化疗治疗计划方案周期不同将患者分为4周期组44例和6周期组50例,两组患者年龄、病理类型、手术方式、肿瘤大小(T分期)、TNM分期等一般资料比较,差异均无统计学意义(均P>0.05),具有可比性,见表1。本研究经南京医科大学附属苏州科技城医院伦理委员会批准。
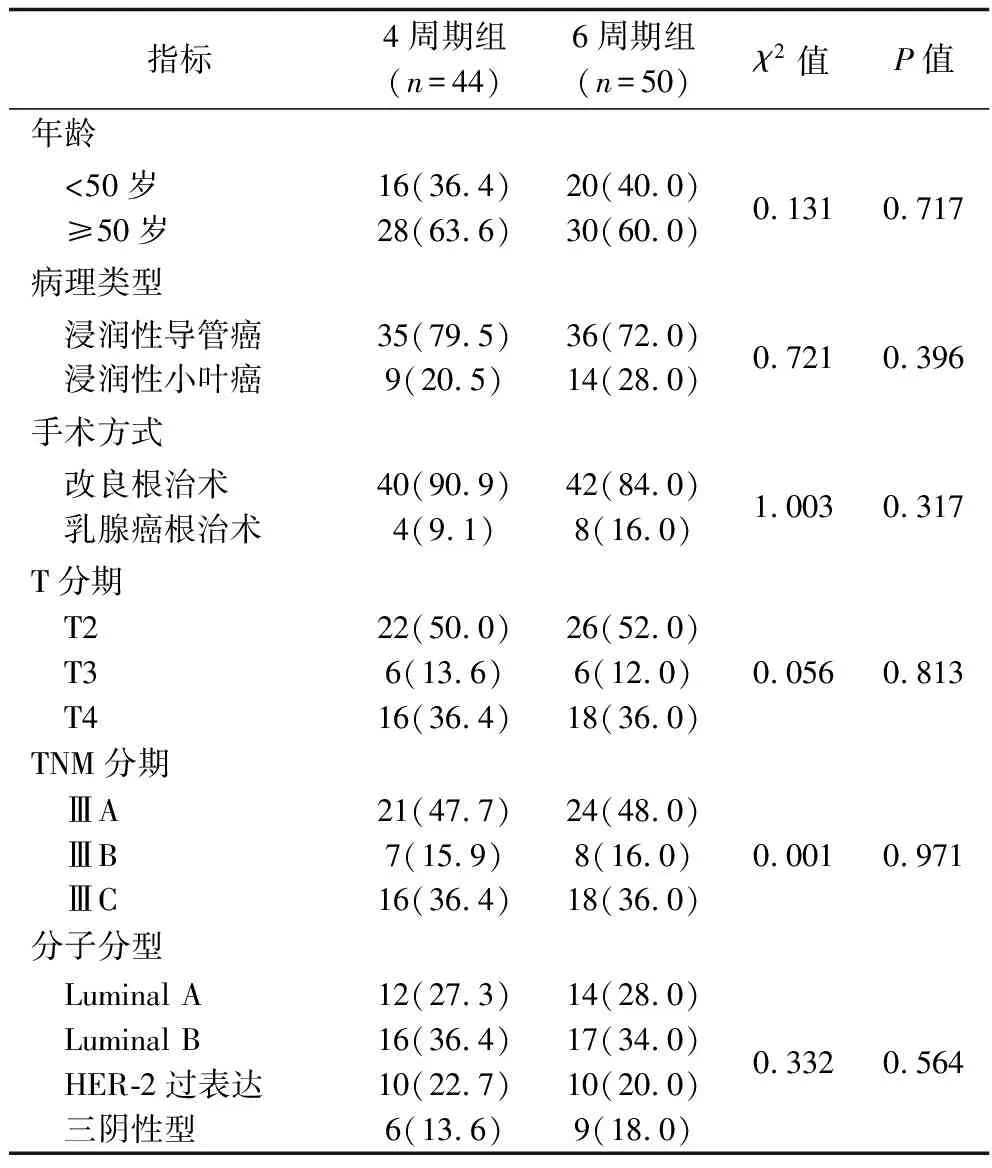
表1 两组患者一般资料的比较[ n(%)]
1.2 治疗方法 两组均在术后1个月采用TEC方案行辅助化疗:静脉滴注多西他赛(江苏恒瑞医药股份有限公司,国药准字:H20020543)75 mg/m2,D1(即每周期的第1天);静脉推注表柔比星(辉瑞制药有限公司,国药准字:H20000496)75 mg/m2,D1~D2(即每周期的第1、2天);静脉滴注环磷酰胺(江苏恒瑞医药股份有限公司,国药准字:H32020857)500 mg/m2,D1。3周为1个周期,4周期组治疗4个周期,6周期组治疗6个周期。两组患者在化疗期间均常规给予地塞米松抗过敏、帕洛诺司琼止吐、门冬氨酸鸟氨酸保肝治疗,并于化疗后第3天给予重组人粒细胞刺激因子促进骨髓造血,首次化疗后的第2周复查血常规及肝功能,白细胞计数<3.0×109/L时给予重组人粒细胞刺激因子治疗。
1.3 观察指标 (1)所有患者均于化疗结束后第1个月行影像学检查(乳腺原发灶及区域淋巴结CT、MRI),并参照世界卫生组织实体瘤疗效评价标准[9]评估近期疗效。近期疗效评价分为完全缓解、部分缓解、疾病稳定、疾病进展,其中病灶完全消失为完全缓解,病灶直径减少超过50%为部分缓解,病灶直径减少≤50%或增加≤25%为疾病稳定,病灶直径增加超过25%为疾病进展。疾病缓解率=(完全缓解+部分缓解)例数/总例数×100%,疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%。参照世界卫生组织《抗癌药物急性和亚急性毒性反应分度标准》[10]评估辅助化疗期间患者的毒副作用发生情况,包括骨髓抑制、脱发、肝功能异常、胃肠道反应等。(2)辅助化疗后随访3年,采用门诊结合电话随访,出院后每3个月随访1次。比较两组患者辅助化疗后2年、2.5年、3年的生存率,总生存时间定义为从首次化疗到因本病死亡或末次随访时间,无肿瘤复发生存时间定义为由随机至第一次发生疾病进展或任何原因死亡的时间[11-12]。
1.4 统计学分析 采用SPSS 19.0软件进行统计学分析。计数资料以例数(百分比)表示,比较采用χ2检验;采用Kaplan-Meier法描绘生存曲线,生存率差异比较采用log-rank检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者近期疗效的比较 化疗结束后第1个月,6周期组疾病缓解率和疾病控制率均高于4周期组(χ2=7.096,P=0.007;χ2=4.747,P=0.029),见表2。

表2 两组患者近期疗效的比较[ n(%)]
2.2 两组患者辅助化疗期间毒副作用发生率的比较 两组患者辅助化疗期间的毒副作用发生率差异均无统计学意义(均P>0.05)。见表3。

表3 两组患者辅助化疗期间不良反应发生率的比较[ n(%)]
2.3 两组患者生存情况的比较 6周期组患者辅助化疗后2年、2.5年、3年的总生存率和无肿瘤复发生存率分别为94.0%、88.0%、84.0%和92.0%、84.0%、78.0%;4周期组患者辅助化疗后2年、2.5年、3年总生存率和无肿瘤复发生存率分别为86.4%、79.6%、72.3%和79.6%、72.7%、59.1%;6周期组患者辅助化疗后3年的无肿瘤复发生存率和总生存率均高于4周期组(χ2=4.676、3.945,P=0.032、0.041)。见图1、2。
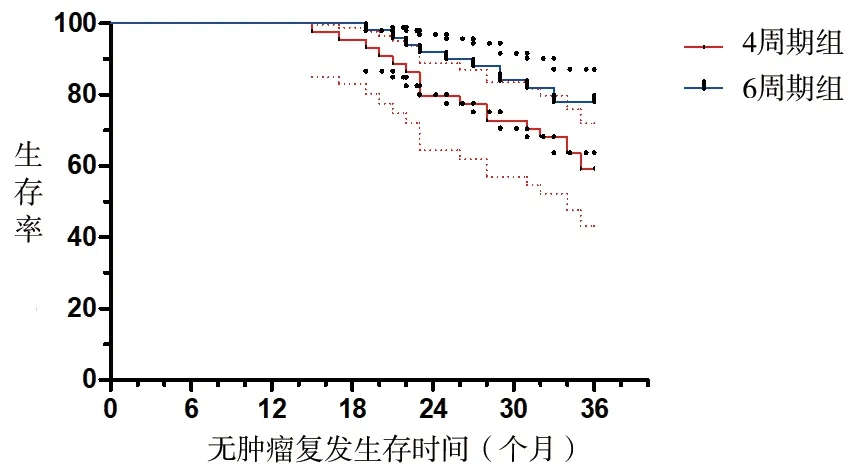
图1 两组患者无肿瘤复发生存曲线

图2 两组患者总生存曲线
3 讨 论
乳腺癌是女性常见的恶性肿瘤之一,由于早期临床表现隐匿,且我国筛查普及率仍较低,其中约有20%的乳腺癌患者首诊时即确诊为局部晚期乳腺癌[13]。新辅助化疗是治疗局部晚期乳腺癌的有效方案,该方法的主要优势是使部分不能保乳的患者获得保乳的机会,同时使部分不能手术的患者获得手术机会[14]。值得注意的是,相较于既往的常规辅助化疗,新辅助化疗在提高局部晚期乳腺癌患者生存率方面并无优势,甚至部分患者可能因疾病进展而丧失手术治疗的机会[15]。因此,临床上有时采取先手术再辅助化疗的治疗策略,目的是提高患者的生存率,而本研究所纳入的研究对象均为术后进行辅助化疗的局部晚期乳腺癌患者。根据美国国立综合癌症网络的指南,针对Ⅲ期乳腺癌患者使用蒽环类和(或)紫杉类联合物进行新辅助化疗可以获得较为理想的效果,临床治疗的有效率超过50%[16]。表柔比星为蒽环类代表药物,其药用机制为抑制肿瘤细胞DNA复制和RNA依赖的RNA酶的合成从而抑制肿瘤细胞生长。Hutchins等[17]的研究表明,含蒽环类的化疗方案在改善肿瘤患者(无论淋巴结阳性或阴性)无复发生存率方面均优于早期环磷酰胺+氨甲蝶呤+5-氟尿嘧啶的化疗方案。环磷酰胺属于细胞周期非特异性药物,其作用机制为与DNA发生交叉联结以抑制DNA的合成,也有干扰RNA的功能[18]。多西他赛的作用与紫杉醇相似,主要是加强微管蛋白聚合作用和抑制微管解聚作用,破坏肿瘤细胞的有丝分裂[18]。
国际乳腺癌研究组开展的研究证实,采用TEC化疗方案治疗乳腺癌患者的无肿瘤复发生存率和总生存率均显著高于表柔比星+环磷酰胺+5-氟尿嘧啶方案[19]。然而目前乳腺癌术后TEC辅助化疗的最佳治疗周期尚无统一标准,临床上多采用4周期治疗[18,20]。本研究结果显示,6周期组患者化疗结束后第1个月的疾病缓解率和疾病控制率均高于4周期组,且辅助化疗后3年的无肿瘤复发生存率和总生存率均高于4周期组(均P<0.05)。本研究中,两组患者辅助化疗期间出现的毒副作用主要为骨髓抑制、脱发、肝功能异常、胃肠道反应、乏力等,其中骨髓抑制均为Ⅱ、Ⅲ度,表现为不同程度的白细胞下降,未出现Ⅳ度毒性反应,肝功能异常主要表现为ALT及AST水平升高,经保肝治疗后可好转或控制,未出现死亡病例。尽管6周期治疗方案在骨髓抑制、乏力、脱发等毒副作用的发生率稍高,但两组差异并无统计学意义(均P>0.05),提示术后6周期辅助化疗方案是一种安全、有效的周期剂量强度,同时提示在临床上针对一些复发风险高危的局部晚期乳腺癌患者,可以适当增加化疗周期以提高患者的近期疗效和中远期生存率。
综上所述,与4周期方案相比,术后6周期TEC辅助化疗方案可更好地改善局部晚期乳腺癌患者的近期疗效,提高患者辅助化疗后3年的无肿瘤复发生存率和总生存率,且并未增加药物毒副作用。但本次研究有一定的局限性,如研究例数较少、随访时间较短且为单中心研究等,结果可能存在一定偏倚,待后续深入研究以证实所得结论。

