CeO2/LaFeO3用于甲烷化学链重整制取合成气反应性能研究
方小杰 ,赵 坤 ,赵增立 ,夏明珠 ,李海滨
(1.南京理工大学 化工学院,江苏 南京 210094;2.中国科学院广州能源研究所,中国科学院可再生能源重点实验室,广东省新能源和可再生能源研究开发与应用重点实验室,广东 广州 510640)
天然气作为清洁、高效、优质能源,其储量巨大,可探明储量每年仍保持一定速率增长,其全球消费量日益增长,根据国际能源署、BP等机构的预测,到2035年左右天然气将超过煤炭成为第二大能源。天然气的主要成分是甲烷,将甲烷转化成高附加值的工业产品,尽可能大的发挥天然气的经济效益,对构建清洁低碳、安全高效的能源体系具有重大意义。目前,工业上主要是通过间接转化法将甲烷转化为合成气(H2和CO),再经费托合成等方法将合成气转化为液体燃料。甲烷转化制合成气的方法主要分为甲烷水蒸气重整制合成气、甲烷二氧化碳重整制合成气、甲烷部分氧化制合成气、以及在此基础上开发的甲烷临氧二氧化碳重整、甲烷三重整法和联合重整法等,目前,已经实现工业化生产的甲烷的水蒸气重整技术是制合成气工艺中应用最为广泛的一种,但由于该技术是一个强烈的吸热反应,所需的设备庞大复杂,操作费用昂贵[1]。
近年来,一种新型的合成气制备技术—甲烷化学链重整越来越多地引起了研究者的关注。该技术是基于化学链燃烧技术(chemical looping combustion, CLC)[2]的概念提出的一种新颖的甲烷转化方法,利用载氧体(金属氧化物)的部分氧化能力以实现甲烷重整制取合成气的新工艺[3]。反应原理如图1所示,在燃料反应器中甲烷与载氧体中的晶格氧反应生成合成气(eq(1)),然后还原后的载氧体经过水蒸气氧化(eq(2))和空气氧化(eq(3))后恢复晶格氧。同时,在水蒸气氧化过程中,还原态的金属氧化物可以分解水蒸气产生氢气。反应过程不需要气相氧与甲烷直接反应,降低了甲烷被深度氧化的可能性,有利于提高合成气的选择性;同时省去了制备纯氧的装置和费用,避免了甲烷与空气直接接触爆炸的危险;通过两步链式循环反应分别得到合成气和氢气,省去了后续气体分离的过程。

图1 甲烷化学链重整过程示意图Figure 1 Chemical looping reforming of methane
近年来,世界各国学者对甲烷的化学链重整制合成气开展了广泛的研究,其中,既起到供氧作用又起到催化作用的载氧体选择是研究的重点。以往的研究中,过渡金属(Ni、Fe、Co、Mn、Cu等)氧化物通常可以用于化学链过程,但是单一的过渡金属氧化物均存在着一定的缺陷。例如Fe、Co、Mn 氧化物的反应活性较低[4 − 6],Cu 的熔点较低使其容易烧结失活[7],Ni虽反应活性高,但是容易导致含碳燃料转化过程中生成大量积炭而导致催化剂失活[8]。以上研究虽然证实了单金属氧化物用于甲烷化学链重整的可行性,但是甲烷的转化效率相对较低、合成气选择性低、积炭严重、循环反应后烧结失活等问题的存在限制了这些载氧体的应用,研究者试图循环新型的载氧体来克服反应中遇到的一系列问题,钙钛矿型金属氧化物由于其突出的热稳定性和氧化-还原能力而受到青睐。
钙钛矿型金属氧化物(ABO3)在结构上类似于CaTiO3,A位一般是稀土或碱土元素离子,结构的稳定性和B位元素价态均与之相关;B位是过渡金属元素离子,作为催化活性中心[1]。学者们将一系列的钙钛矿型金属氧化物ABO3(A= La, Sr, Ba,Ca,B= Fe, Mn, Co, Ni)用于甲烷化学链重整过程,结果表明甲烷可以被钙钛矿型氧化物中的晶格氧选择性地转化为合成气[9 − 11]。其中,LaFeO3(LFO)钙钛矿型氧化物较为优异的反应性能,引起了研究者广泛的关注。Dai等[12]比较了AFeO3(A= La,Nd,Eu)在甲烷化学链过程中的反应性能,实验结果表明LFO具有最佳的反应性能,在化学链重整过程中能够保持活性和结构的稳定性。但是在反应后期,由于甲烷活化与晶格氧迁移速度的不匹配,LFO易催化甲烷直接裂解产生积炭,降低了该载氧体的选择性。甲烷裂解产生的积炭会覆盖在载氧体表面,影响气固相之间的接触,从而抑制了载氧体的反应活性,并且影响水蒸气氧化阶段所产生氢气的纯度。Mihai等[13]研究发现在900 ℃时,LFO与甲烷反应1 min后即因甲烷裂解而使重整产物中氢碳比不断增大。后续研究者通过模板法制备出三维有序大孔结构的LFO,试图通过增大比表面积的方法改善载氧体的供氧能力,但是载氧体的三维有序大孔结构极易在高温的反应条件下坍塌,降低了载氧体的循环再生能力[14]。Dai等[15]研究了LFO/Al2O3-Kaolin的反应性能,虽然Al2O3-Kaolin的加入能够促进晶格氧的迁移,在一定条件下可以提高载氧体的选择性,但是惰性载体的加入却降低了载氧体的反应活性。之后随着研究的进一步深入,研究者们发现甲烷化学链重整反应性能与载氧体结构中的氧空位有关,带有缺陷结构的钙钛矿型载氧体具有更高的反应活性和选择性。例如在A位掺入Sr2+可以提高载氧体的供氧能力[16, 17]。苏迎辉等[18]采用B位 Fe、Co 共取代的方法制备钙钛矿型载氧体 LaMn1−x−yFexCoyO3,甲烷化学链重整结果表明该载氧体具有比LFO更高的甲烷活化能力和晶格氧迁移性能。本课题组在A,B位同时掺杂金属离子合成了La2−xSrxFeCoO6并应用于甲烷化学链重整中,结果表明La0.6Sr0.4FeCoO6表现出最佳的供氧能力,热稳定性以及产氢能力,甲烷的转化率能够达到90%[19]。同时研究发现,利用钙钛矿和其他金属氧化物的相互作用而制备的双组分复合金属氧化物具有更为优异的反应性能。Neal等[20]制备了核壳结构的载氧体Fe2O3@La0.8Sr0.2FeO3−δ,在该体系中Fe2O3可以提供反应所需的晶格氧,而La0.8Sr0.2FeO3−δ则提供反应活性位点和起到传递氧的作用。另一些研究发现,La0.7Sr0.3FeO3−δ, CaTi0.85Fe0.15O3−δ,BaCe0.7Fe0.3O3−δ等作为Fe2O3的载体时较Fe2O3/YSZ的稳定性和反应性均得到明显提高,进一步证实了钙钛矿和活性金属氧化物的相互作用更有利于化学链过程中的晶格氧迁移[21]。虽然钙钛矿型金属氧化物的反应活性强,热稳定性高且具有优异的氧传导能力,但是由于氧迁移速率的限制,在甲烷重整反应中往往易导致积炭的生成。积炭会覆盖在载氧体表面,影响气固相之间的接触,从而抑制载氧体的反应活性,影响水蒸气氧化阶段所产生氢气的纯度。
CeO2作为一种过渡金属氧化物近年来较广泛地应用于甲烷转化过程,由于其晶体表面氧空位含量较大,具有适宜的供氧能力,能够催化甲烷发生部分氧化反应生成合成气[22]。同时由于其可以在Ce3+和Ce4+之间快速转化的特点,使得其具有独特的催化能力和抑制积炭能力,研究表明,CeO2-ZrO2与甲烷的反应过程中几乎没有积炭产生[23]。但是,CeO2的反应活性较低,850 ℃时的甲烷转化率仅为20%。因此,研究者们利用其他高活性的过渡金属与CeO2掺杂来提高CeO2的反应活性[24]。将CeO2与钙钛矿型氧化物复合,可以更好地提高CeO2的循环能力,同时CeO2与钙钛矿金属间的协同作用可以强化甲烷部分氧化的选择性和合成气的产率[25]。因此,本文选用钙钛矿型金属氧化物LaFeO3和CeO2作为载氧体的活性双组分,综合利用钙钛矿的反应活性、热稳定性和CeO2的部分氧化能力,以期制得一种具有合适的反应活性、供氧能力及稳定的氧化-还原循环能力的金属复合氧化物载氧体。考察了载氧体组成、反应温度对反应性能的影响,借助固定床循环实验测试了载氧体在连续的氧化-还原循环中的稳定性,同时对反应机理进行了初步探讨。
1 实验部分
1.1 材料
六水合硝酸镧(La(NO3)3·6H2O,AR, > 99%),九水合硝酸铁(Fe(NO3)3·9H2O,AR, > 99%),六水合硝酸铈(Ce(NO3)3·6H2O,AR, > 99%),柠檬酸(C6H8O7,AR, > 99),氨水(AR)。以上试剂均从上海阿拉丁生化科技股份有限公司购置。
1.2 载氧体的制备
首先称取一定量的CeO2粉末加入到60%乙醇水溶液中搅拌0.5 h使CeO2颗粒得以分散;随后将此悬浊液超声处理2 h并静置12 h;将该悬浮液置于干燥箱中于110 ℃下干燥直至上层清液蒸发完毕,得到CeO2颗粒悬浮液。复合钙钛矿型载氧体通过溶胶-凝胶法制备,按照柠檬酸与金属阳离子物质的量比为1.3的原则依次称取La(NO3)3·6H2O、Fe(NO3)3·9H2O和柠檬酸并溶于蒸馏水中。向混合溶液加入上述步骤中制备的CeO2颗粒悬浮液(CeO2的用量为载氧体质量的5%、10%、20%)并于80 ℃下加热搅拌直至形成凝胶。随后将凝胶转移到蒸发皿中并置于干燥箱中干燥处理以得到干凝胶。最后将干凝胶先于400 ℃下煅烧2 h,再于850 ℃下煅烧6 h得到载氧体粉末。将此实验中制备的 LaFeO3、5%CeO2/LaFeO3、10%CeO2/LaFeO3、20% CeO2/LaFeO3命名为LFO、5CLFO、10CLFO、20CLFO。
1.3 载氧体的表征
1.3.1 X射线粉末衍射(XRD)
本次实验所用的X射线衍射仪为荷兰帕纳科公司的 X’Pert Pro MPD (PW3040/60),Cu 靶Kα辐射λ= 0.15046 nm,管电压 40 kV,管电流 40 mA,扫描角度 (2θ)为 5°−80°,扫描速率 0.00167(°)/s。
1.3.2 氢气程序升温还原(H2-TPR)
测试时样品首先在氦气气氛中以20 ℃/min升温至300 ℃并保温1 h以脱除体系内的空气,当温度降至常温后再通入 10% H2/Ar,并以 10 ℃/min 升温至1000 ℃,反应过程中氢气浓度变化和对应的温度即可反映载氧体中氧物种的反应能力。本次实验所用相关仪器为美国康塔仪器公司的CPB-1型全自动程序升温化学吸附分析仪。
1.3.3 X射线光电子能谱(XPS)
本次实验所用相关仪器为赛默飞科技公司的ESCALA8, 250Xi型 X 射线光电子能谱仪,AlKα射线为激发源,工作电压为20 kV,工作电流为10 mA,功率为200 W,在通道能量为20和100 eV的条件下分别得到总谱图和各个元素谱图。
1.4 固定床实验
固定床反应装置如图2所示,圆柱形电炉内置一根石英管,管子长度为700 mm,外径为30 mm。在管子的中间部分是石英砂烧制的挡板,只能通过气体,石英管的两端采用不锈钢密封接头。实验时首先将适量的石英棉置于管子内的挡板上,然后称取一定量载氧体置于石英棉上,在氩气气氛中加热至设定的反应温度后,关闭氩气,开始通入流量为 50 mL/min 的甲烷混合气(40%CH4+60%N2),待甲烷混合气的流量稳定后开始计时。实验过程中用气袋收集气体产物,在炼厂气气相色谱仪上(Agilent 7890A)测定气体成分。反应结束后,先通入20 min的氩气,将反应器中残留的气体排出。再通入0.1 mL/min的水蒸气,水蒸气氧化时间为10 min,为保证被还原的载氧体再生,最后通入20 min的空气。

图2 固定床反应装置Figure 2 Setup of fixed-bed reactor
1.5 载氧体反应性能评价
载氧体与甲烷反应结果的评价指标有甲烷转化率 (xCH4)、氢气选择性 (sH2)、CO 选择性 (sCO)、合成气的氢碳比 (n(H2)/n(CO))。具体计算方法如下:


2 结果与讨论
2.1 载氧体表征
载氧体的XRD表征结果如图3(a)所示,衍射峰的位置及强度反映了材料的物相组成和晶体结构。从图中可以看出,四种载氧体均形成了钙钛矿结构,在 22.605°、32.181°、39.699°、46.137°、52.001°、57.382°、67.358°、72.054°处的衍射峰分别对应于LFO (JCPDS 标 准 卡 号 75-0541) 的 (100)、(110)、(111)、(200)、(210)、(211)、(220)、(221) 晶面; 位于28.507°的衍射峰则归属于 CeO2(JCPDS 34-0394)的 (111)晶面,且其特征峰强度随CeO2含量的增加而增加。因此结果表明,在LFO钙钛矿的合成中加入CeO2,没有改变钙钛矿结构,但是最强衍射峰的半峰宽有所增大,载氧体的晶粒尺寸变小,有利于活性位点的分散,从而抑制其烧结失活[26]。

图3 载氧体的 XRD、H2-TPR 表征Figure 3 XRD, H2-TPR results of characterization of oxygen carriers
载氧体的H2-TPR结果如图3(b)所示,10CLFO和20CLFO在低温段出现明显的还原峰,而LFO和5CLFO的低温还原峰出峰不明显,表明CeO2含量的增加使得载氧体的表面氧空位和吸附氧含量增大,提高了载氧体的反应性。以往的研究表明,钙钛矿型氧化物中主要存在两种形式的氧,分别是表面吸附氧和内部晶格氧[27],表面吸附氧在较低温度下即可脱附发生还原反应,而晶格氧在较高温度才会与燃料发生反应同时引起金属离子的还原[28]。从图中可以看出,随着温度的升高,四种载氧体在高温段500和715 ℃出现的还原峰,对应化学吸附氧以及内部晶格氧的迁移转化,800 ℃以上出现的还原峰则是载氧体的深度还原过程[29]。CeO2的加入明显增大了715 ℃处还原峰的峰面积,氧空位的增多也有利于晶格氧向载氧体表面迁移并参与反应[30]。
2.2 固定床反应实验
2.2.1 CeO2含量的影响
甲烷化学链重整反应过程如下[31]:在反应的初始阶段,由于载氧体的表面吸附氧浓度较高,甲烷会发生完全氧化反应生成CO2和H2O,反应如eq(8) 所示。随着反应的进行,表面吸附氧浓度下降并产生氧空位,内部晶格氧向表面迁移与甲烷发生部分氧化反应生成CO和H2,反应如eq(9) 所示。进一步地,甲烷还会在载氧体表面发生裂解反应从而导致积炭的生成(eq(10))。
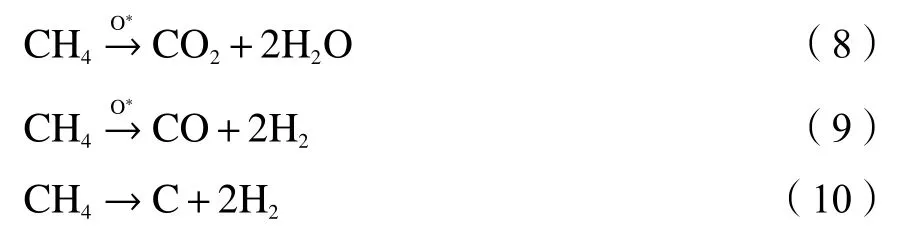
图4为CeO2含量对载氧体反应性能的影响,从图4(a)可以看出,在反应一开始时甲烷转化率较大,随即下降至最小值,随着反应的进行又不断增加。这是由于在反应初始阶段,进入反应器内的甲烷因反应器内原本存在的惰性气体的稀释其浓度水平较低,而载氧体表面存在着浓度较高的表面吸附氧对甲烷转化具有明显地促进作用,因此,在这段时间内甲烷转化率较高;之后随着甲烷浓度的上升和表面吸附氧浓度的下降,此时甲烷转化率开始下降;最后随着内部晶格氧向载氧体表面迁移并参与反应,同时被还原的金属离子具有催化甲烷转化的效果,氧物种和金属元素的协同效应使得甲烷转化率又重新开始增大直至某个稳定值[32]。比较四种载氧体的甲烷转化率变化情况可以发现,CeO2的加入增大了载氧体的反应活性,这表现为一系列的CLFO在反应初始阶段和后期均具有较高的甲烷转化率,其最大值可以达到97%。因为积炭的缘故,LFO的甲烷转化率和H2选择性在第16 min后有明显的下降趋势,而CLFO的反应性能保持稳定,表明CeO2的加入使得载氧体的抗积炭性能得到改善。CO选择性反映了甲烷化学链重整过程合成气产气情况的变化,当CO选择性不断增大时,说明甲烷部分氧化是主要反应过程;而CO选择性不断减小则说明甲烷发生裂解反应的程度不断增大。对于一系列的CLFO,其CO 选择性在 2−6 min不断增大至最大值80%左右,6 min之后CO的选择性开始减小。而LFO的CO选择性在第8 min达到最大值65%。由此可知,CLFO的供氧能力和甲烷部分氧化性能均有所增强,其中,10CLFO的CO选择性最高。从图4(d)n(H2)/n(CO) 随时间的变化情况可以看出,四种载氧体的n(H2)/n(CO)在 2−10 min处于2.0−3.0,结合CO选择性变化情况可知,在该段时间内反应以甲烷的部分氧化为主。之后随着反应的进行,n(H2)/n(CO)不断增大,说明此后发生了较为严重的甲烷裂解。甲烷裂解反应是甲烷化学链重整中应当避免的副反应,因为产生的积炭不仅会影响后续水蒸气氧化过程中所产氢气的纯度,而且大量积炭覆盖在载氧体表面易使载氧体反应活性降低甚至完全失活。

图4 CeO2 含量对载氧体反应性能的影响Figure 4 Influence of CeO2 content on the performance of oxygen carriers
综上,CeO2与LFO的协同作用提高了载氧体的反应活性和选择性。其中,10CLFO的反应性能最为优异,与甲烷反应的前10 min内n(H2)/n(CO)的值保持在2−2.6,甲烷转化率可以达到94%,H2选择性为90%,CO选择性在第6 min达到最大值83%。李琳等[33]研究了Ni-CeO2在甲烷二氧化碳重整反应中的催化性能,结果表明,载体CeO2立方体的形貌和特殊晶面对镍基催化剂在甲烷二氧化碳重整反应性能具有良好的促进作用,甲烷转化率在60%左右。Li等[34]制备了复合金属氧化物CeO2-Fe2O3用于甲烷重整制备合成气,850 ℃时得到40%的甲烷转化率和90%左右的合成气选择性。同课题组[35]采用共沉淀法制备了铈钴物质的量比为1:1的复合氧化物催化剂, 结果表明,铈钴复合氧化物催化剂对甲烷裂解和积炭选择性氧化都有良好的催化性能,600 ℃甲烷裂解转化率达到43%。与以上结果相比,CLFO复合载氧体能够显著地提高甲烷转化率和合成气选择性,具有更为优异的甲烷重整反应性能。
2.2.2 反应温度的影响
为了确定反应温度对甲烷重整反应的影响,选择10CLFO为载氧体,考察其与甲烷在750、850、900 ℃下的反应性能,结果见图5。由图5可知,反应温度对10CLFO的反应性能起着重要的作用。在反应初始阶段,由于反应器内的甲烷浓度较低且载氧体表面吸附氧浓度较高,因此,即使是在750 ℃下甲烷转化率仍能达到75%,但是随着甲烷浓度的升高和表面吸附氧的消耗,甲烷转化率在2−12 min不断下降至15%,与此同时,CO 的选择性不断上升至最大值48%,n(H2)/n(CO)的值从4.6下降至2.4。出现上述结果是因为载氧体催化甲烷活化的速率较小,使得表面吸附氧的消耗速率较低,因此,这段时间内并无太多积炭生成。第12 min以后由于金属活性位点的增多促进了甲烷转化,甲烷转化率在反应后期维持在36%左右,但是因为晶格氧迁移受到限制而导致CO选择性下降和n(H2)/n(CO)上升。显然,当反应温度较低时,甲烷活化和载氧体的晶格氧迁移均受到了限制。在较高反应温度时(850和900 ℃),表面吸附氧的消耗速率和晶格氧的迁移速率加快,因此,甲烷转化率在4−6 min开始继续增大,在反应后期达到99% (900 ℃)和 97% (850 ℃)。通过甲烷转化率变化情况可知,900和850 ℃下载氧体10CLFO催化甲烷转化的反应活性差异较小。在反应的前2−6 min,900 ℃ 时的 CO 选择性和 H2选择性均低于850 ℃,结合这段时间内900 ℃时的n(H2)/n(CO)值不断增大,推断是因为更高温度有利于甲烷的完全氧化反应以及CO的水汽变换等副反应。在两种温度下,无论是CO选择性还是n(H2)/n(CO)在16 min后都是趋于相近,表明此时因为晶格氧含量和传递的限制,升高温度并不能释放更多的晶格氧。而对于H2选择性,在反应初始阶段由于表面吸附氧较多,此时伴随着甲烷完全氧化,因此,H2选择性较低。随着晶格氧的消耗,使得甲烷重整阶段主要为部分氧化继而发生甲烷裂解,因此,H2选择性不断增大至某个稳定值。根据不同温度下的H2选择性变化趋势可以判断较高温度更易导致甲烷裂解,所以在850 ℃以上H2选择性在第8 min后便达到90%,随即稳定在90%左右。

图5 反应温度对 10CLFO 的反应性能的影响Figure 5 Influence of reaction temperature on the performance of 10CLFO
因此,合适的反应温度使得甲烷活化速率与晶格氧迁移速率相匹配,从而提高载氧体的选择性。当反应温度为850 ℃时,甲烷反应的前10 min内载氧体保持着较好的选择性,可以认为850 ℃是比较适宜的反应温度。
2.3 反应机理分析
10CLFO反应前后的XPS表征结果如图6所示,对比反应前后载氧体的XPS谱图可以深入了解载氧体在反应过程中元素的变化,从而有助于反应机理分析。在O 1s的XPS谱图中,529.3、531.6及533.2 eV附近的拟合峰分别归属于晶格氧 (OI),化学吸附氧 (OII)和物理吸附氧 (OIII)[36]。化学吸附氧,又被称为表面吸附氧,即是气相中的氧分子因化学吸附作用吸附在金属氧化物表面形成的O2−或O−;另外,体相中的晶格氧只有先迁移到载氧体表面转化为表面吸附氧,才能在载氧体表面与甲烷发生反应[37]。所以,当满足特定条件时,两个氧物种可以相互转化。当反应温度较低时 (750 ℃),10CLFO的各个氧物种相对含量与新鲜样品的差别较小,表面吸附氧从46.55%降至44.7%,具体见表1。当反应温度达到850 ℃后,晶格氧的相对含量明显降低,晶格氧与吸附氧的比例 (OLat/Oads) 在850和900 ℃与甲烷反应后分别为0.2和0.16,说明在此温度范围内,晶格氧被消耗产生氧空位,大量的晶格氧可以从体相向外迁移并转化为表面吸附氧从而参与反应。Fe 2p的XPS谱图拟合结果如图7所示,723、710.2及 718.5 eV左右的拟合峰对应于Fe3+,而较低结合能处的709.09和707.01 eV则分别归属于Fe2+和Fe0[38]。与O 1s结果相一致,750 ℃反应后的载氧体与新鲜样品相比,Fe3+和Fe2+的相对含量变化不大。而850和900 ℃反应后的低价态Fe含量增多,更多的Fe3+被还原为Fe2+,甚至被还原为Fe0。由此可知,反应温度越高,载氧体越容易被还原,当载氧体被过度还原后势必会导致甲烷活化速率的增大从而降低载氧体的选择性。但是,反应温度又不能过低以致影响晶格氧的迁移转化。因此,在甲烷化学链重整中必须控制反应温度和反应时间以期获得最优结果。
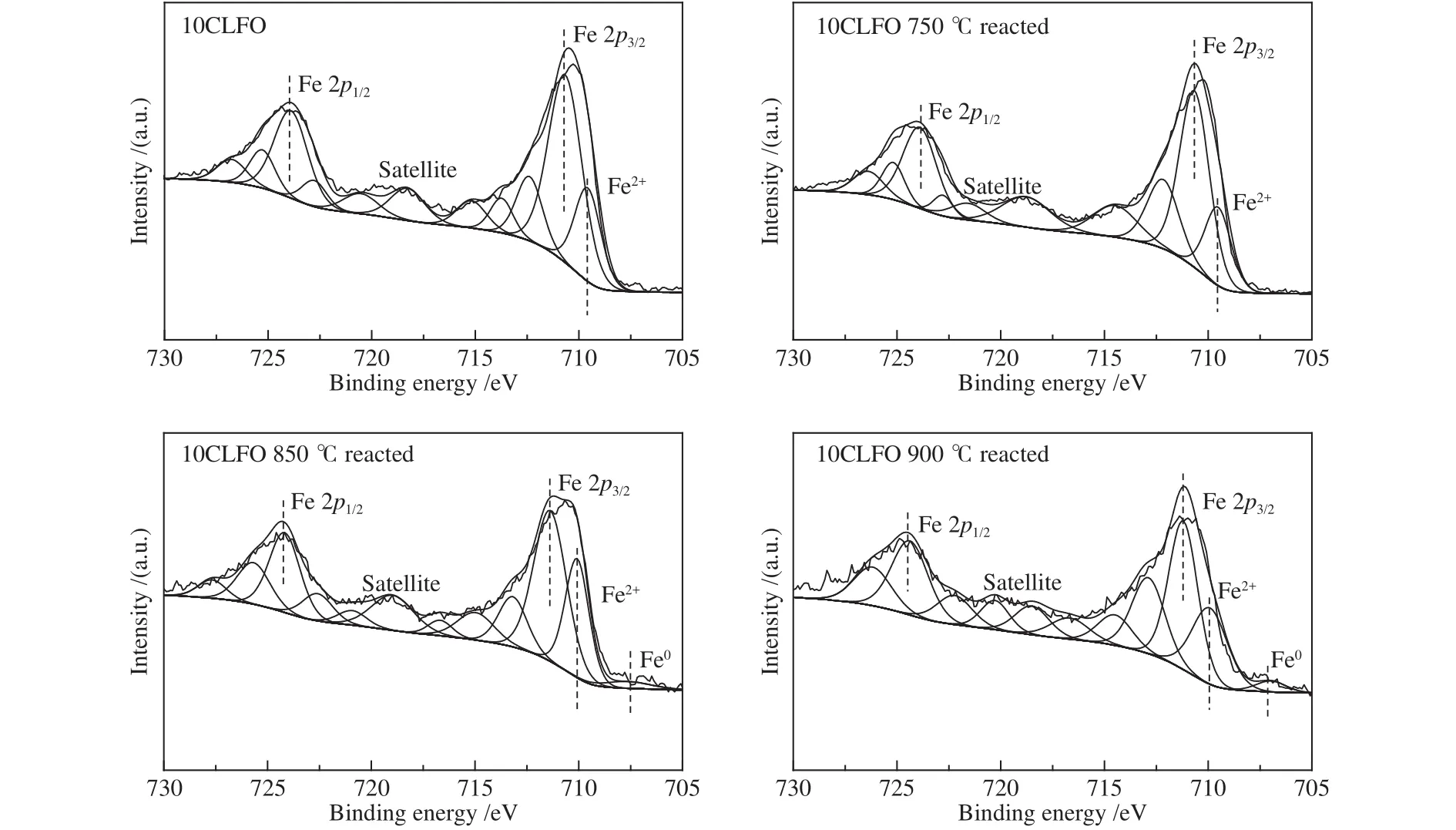
图7 Fe 2p 的 XPS 谱图Figure 7 XPS spectra of Fe 2p
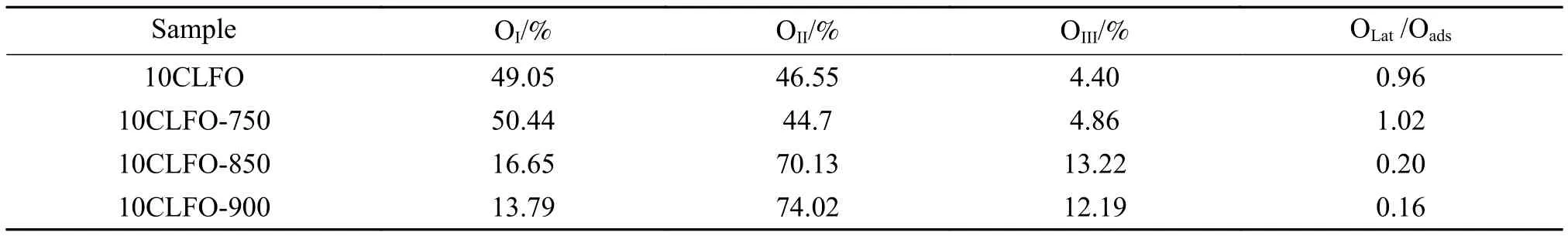
表1 氧物种相对含量Table 1 Contents of different oxygen species

图6 O 1s 的 XPS 谱图Figure 6 XPS spectra of O 1s
2.4 固定床循环实验
10CLFO的10次循环结果如图8所示,甲烷重整阶段反应时间为10 min,反应温度为850 ℃。由图8(a)可以看出,随着循环次数的增加,产物中CH4含量略微降低,H2和CO的含量不断增加,在前3次循环过程中H2和CO含量分别为45%和15%,n(H2)/n(CO)值接近3;在后续4−10次循环中H2含量上升至50%左右,CO含量上升至20%,n(H2)/n(CO) 维持在2.5−2.7。这表明循环再生后的载氧体反应性能得到改善。循环过程中的具体反应性能分析如图8(b)所示,甲烷重整反应中甲烷转化率最后稳定在65%,H2选择性和CO选择性达到50%和40%。图8(c)所示为水蒸气氧化过程的产气情况随循环次数的变化。在水蒸气氧化阶段中,水蒸气会被还原态的载氧体分解反应产生H2。若载氧体表面存在积炭,那么水蒸气会与积炭反应生成CO和CO2。在10次循环的水蒸气氧化阶段所产生的产物中CO2始终低于1%,CO含量仅在第5次循环中达到5%,H2纯度最高可以达到99%,说明甲烷重整反应过程中产生的积炭量较少。反应前后载氧体的XRD对比图如图8(d)所示,被还原的载氧体中出现氧化镧和铁单质,经过氧化处理后,载氧体10CLFO可恢复原有结构,经过10次循环后的10CLFO的结构并未发生改变。综上所述,10CLFO的反应性能和结构在多次氧化-还原的循环中均保持相对稳定。

图8 固定床循环反应性能Figure 8 Results of fixed bed redox cycles
3 结 论
在LFO的合成过程中添加适量CeO2后,LFO的钙钛矿结构并不会受到影响。通过H2-TPR测试结果可知,由于双活性组分间的相互作用,CLFO载氧体的供氧能力得到改善。
固定床实验表明,10CLFO的反应性能最为优异,与甲烷反应的前10 min内n(H2)/n(CO)的值保持在2−2.6,甲烷转化率可以达到94%,H2选择性为90%,CO选择性能够达到83%。在循环实验中,10CLFO的结构和反应性能始终保持相对稳定,循环过程中甲烷转化率稳定在65%,H2选择性和CO选择性能够达到50%和40%;水蒸气氧化阶段所产生的产物中CO2含量始终低于1%,H2纯度最高可以达到99%。
较高的反应温度不仅有利于甲烷转化,而且有利于10CLFO中的晶格氧迁移转化为表面吸附氧。通过调控载氧体的组分和反应条件可以使晶格氧迁移速率和甲烷活化速率相匹配,从而改善载氧体的部分氧化能力。

