PGPR与外生菌根菌互作对樟子松促生作用及根际微生态环境的影响
罗佳煜,宋瑞清,邓 勋,宋 倩,王俊凯,宋小双
(1.东北林业大学 林学院,黑龙江 哈尔滨 150040;2.黑龙江省森林保护研究所,黑龙江 哈尔滨 150040)
根际促生细菌(Plant growth promotiong rhizosphere,PGPR)被称为定殖于植物根际并能够促进植物生长的细菌。PGPR 主要包括伯克霍尔德菌属Burkholderiaspp.、芽孢杆菌属Gemmatimonadetes、假单胞菌属Pseudomonas、沙雷氏菌属Serratia和链霉菌属Streptomyces等[1-2]。PGPR 可以促进植物的生长,其作用机理可归为直接和间接作用两大类。直接作用是PGPR 可以合成促进植物生长的激素(如生长素等),使土壤中某些无机元素转化成有机的形态而利于植物吸收(如固氮、解磷等),促进植物的生长发育;间接作用是PGPR 通过抑制病原菌生长或提高植物抗性,减缓植物病害对植物不利的影响[3]。外生菌根菌(Ectomycorrhizal fungi,ECMF)是植物根部重要的益生菌,可显著提高宿主植物对矿质营养的吸收,尤其是针叶树种,在促进苗木生长、提高苗木耐胁迫方面具有不可替代的作用[4-5]。温祝桂等[6]在研究外生菌根菌对黑松幼苗的影响中发现,接种外生菌根真菌可以有效促进宿主松树幼苗的生长,菌根化使得幼苗的光合能力增强,光合产物增多,增加了植物体内脯氨酸含量;增强了K+的吸收,有效地维持了相对较低的Na+/K+比。益生菌互作在植物促生抗逆方面具有协同增效的作用,复合益生菌剂能调节植物的养分平衡,促进植物的生长和养分的吸收。适合的菌株互作能起到加成效应,相互间促进生长,或者相互提供生长所需的养料和基质[7],部分PGPR 在ECM互作中可发挥菌根辅助细菌(Mycorrhizal helper bacteria,MHB)的作用。Hungria 等[8]发现共接种根瘤菌Rhizobium和巴西固氮螺菌Azospirillam brasilense能提高大豆和菜豆的产量。巴西固氮螺菌和溶磷菌互作能促进高粱和大麦以及其他谷类生长,增加作物的产量和N、P 的吸收量[9]。PGPR 菌株与根瘤菌复合接种,能提高根瘤菌的固氮能力,包括增加根瘤数以及促进根系发育等[10]。根际溶磷菌多粘芽孢杆菌Bacillus polymyxa也可以作为菌根辅助细菌,有利于聚丛球囊霉Glomus aggregatum的定殖[11]。有研究表明同时接种摩西球囊霉Glomus mosseae与根际促生菌,如根瘤菌Bradyrhizobium japonicum或溶磷细菌Burkholderia cepacianBAM-6,不但提高了作物的养分利用效率,还提高了作物的抗逆能力,进而促进宿主植物的生长[12]。菌根菌与辅助细菌之间存在协同进化机制,二者相互的选择特异性较强,Garbaye 等[13]对Pinus radiate-Rhizopogon luteolus菌根际细菌进行分离发现,在菌根际土壤、菌根、菌根菌担子果等分离得到的细菌,多数菌株对菌根合成具有促进作用。菌根菌在提高宿主植物养分吸收和促进生长的同时,对菌根际的细菌种类有定向选择作用,从而使菌根际的微生物类群更加有利于其菌根合成[14]。
樟子松Pinus sylvestnisvar.mongolica是东北地区主要速生用材、防护绿化、水土保持优良树种。樟子松育苗中面临土传病害发生严重、根际土壤微生态环境破坏、苗木长势不好、抗逆性弱等问题,接种根际益生菌可以促进樟子松苗木生长,改善根际微生态环境,提高苗木抗逆性。本研究以根际促生细菌(PGPR)和外生菌根菌(ECM)为研究对象,以促进樟子松苗木生长、提高后续造林成功率为目标,PGPR 与外生菌根菌复合接种后,测定樟子松1年生苗的生长指标、根际土壤理化性状和微生物多样性指标,分析PGPR 与外生菌根菌互作在促进樟子松苗生长、提高樟子松苗抗病性等方面的核心作用,为开发植物促生抗逆作用的生物菌肥提供理论基础。
1 材料与方法
1.1 菌株来源
褐环乳牛肝菌Suillus luteusN94(GenBank 登录号:MT652994)分离自辽宁省彰武县章古台实验林场樟子松人工林。
荧光假单胞杆菌Pseudomonas fluorescens1-42(GenBank 登录号:MK880644)分离自黑龙江省东北林业大学实验林场1年生樟子松苗根际土壤。
菌株保存于东北林业大学森林微生物实验室。
1.2 育苗及菌剂制备方法
育苗基质的制备及播种:草炭土、蛭石和河沙按体积比2∶1∶1 混合配制成育苗基质,121℃下高温高压灭菌2 h,装入营养钵(15 cm×13 cm)中室温放置7 d 后进行播种[18]。樟子松种子催芽后播入营养钵中,每钵播30 粒种子,置于东北林业大学实验林场温室中培养,幼苗出土后,每钵定苗至15 株,进行常规的日常管护[19]。
接种菌剂的制备:4℃保存的褐环乳牛肝菌N94 接种于PDA 平板培养基上,培养20 d 后用无菌打孔器(直径10 mm)切取菌饼,接种于盛有PD 液体培养基250 mL 的500 mL 三角瓶中,每瓶接种3 片菌饼,置于摇床上(25℃、150 r·min-1)振荡培养30 d,接种前用搅拌机将菌丝体搅碎做匀浆处理。
将-20℃保存的荧光假单胞杆菌1-42 划线接种到牛肉膏蛋白胨(NB)固体培养基上,30℃黑暗条件下培养72 h 后,挑取单菌落接种到牛肉膏蛋白胨(NB)液体培养基中,振荡培养(28℃,180 r·min-1)48 h 后,4℃条件下8 000 r·min-1离心10 min,去掉上清液后无菌水冲洗3 次,接种前调整终浓度OD600吸光度为0.6。
1.3 接种试验设计
樟子松出苗14 d后进行接种,共4个接种方式。1)CK:PD 培养基作为对照。2)N94:单接种褐环乳牛肝菌N94。3)1-42:单接种荧光假单胞杆菌1-42。4)N94+1-42:双接种褐环乳牛肝菌N94和荧光假单胞杆菌1-42。采取打孔灌根的方式接种,每盆接种N94 菌剂、1-42 菌剂或PD 培养基50 mL(每盆打直径10 mm、深5 cm 的5 个小孔,注入菌剂)。每个处理20 次重复(每个处理20盆300 株樟子松1年生苗),共80 盆,接种完成后在温室中正常管护。
1.4 植物及土壤取样方法
植物取样:接种处理90 d 后,采集植物及根际土壤样品,用于相关指标的测定。每个处理随机选取1年生苗100 株,用无菌水清洗根际,滤纸吸干后用于指标的测定。
根际土取样:每处理采集樟子松苗的同时,轻轻抖动根际土并收集于无菌样品袋中,2 mm 筛子过筛后放入装有冰袋的保温箱中带回实验室,用于测定土壤养分指标的土壤风干后常温保存;测定土壤酶指标的土壤保存于4℃冰箱;测定微生物多样性的土样保存于-80℃冰箱。
1.5 樟子松生长指标的测定
生物量指标:分别测定1年生苗的苗高、地径、地上部分及地下部分鲜质量,85℃干燥箱烘干后测定地上部分及地下部分干质量。
苗木养分指标:樟子松1年生苗烘干后分为根、茎、叶三部分,研磨成粉状用于测定植物营养成分,包括全氮、全磷、全钾、有机质含量。全氮(Total nitrogen,TN)采用凯氏定氮仪(K9840)测定;全磷(Total phosphorus,TP)采用Mo-Sb 比色法测定;全钾(Total potassium,TK)采用火焰光度计法测定;有机质(Organic matter,OM)采用重铬酸钾外加热法测定[21]。
1.6 土壤养分及酶活指标的测定
土壤养分指标:全氮(TN)的测定采用凯氏定氮法;速效氮(Available nitrogen,AN)用碱性水解法测定;全磷(TP)的测定采用Mo-Sb 比色法;速效磷(Available phosphorus,AP)的测定采用双酸浸出的钼锑抗比色法;全钾(TK)的测定采用火焰光度计;速效钾(Available potassium,AK)的测定采用乙酸铵(CH3COONH4)浸提剂火焰光度计;用重铬酸钾氧化加热法测定有机质(OM)。
土壤酶活性的测定:采用南京建成生物土壤酶测定试剂盒,按照说明书测定土壤酸性磷酸酶、过氧化氢酶、蔗糖酶及脲酶活性。
1.7 根际微生物多样性分析
采用E.Z.N.A.® Soil DNA Kit 提取土壤总DNA,以土壤总DNA 为模板,采用341F(5′-ACTCCTACGGGAGGCAGCAG-3′) 和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16 S rRNA 基因的V3-V4 高变区片段进行PCR 扩增,采 用ITS1F (5′-ATATGCTTAAAT TCAGCGGG-3′)和ITS2R (5′-ATATGTAGGATGAAGAACGYAGA A-3′)对真菌rDNA 基因的ITS 区片段进行PCR扩增。扩增后的PCR 产物用2%琼脂糖凝胶回收PCR 产物,使用AxyPrep DNA Gel Extraction kit进行纯化,Tris-HCl 洗脱,2%琼脂糖电泳检测。利用QuantiFluor ™-ST 进行检测定量,然后根据测序量需求对各样品按相应比例混合,构建Miseq文库,使用Illumina MiSeq 平台测序。通过Flash软件拼接成一条序列,同时使用Trimmomatic 软件进行质控过滤。利用UPARSE 软件对所得序列进行分析,按照97%的相似性将序列划分可操作分类单位OUT (Operational taxonomic units),使用UCHIME 软件剔除嵌合体。利用RDP classifier 对每条序列进行物种分类注释,置信度阈值为0.7。
1.8 数据处理和分析
数据采用Excel 2019 软件进行初步处理,数据由平均值±标准误(mean±SE)表示;每个指标设置3 个重复,使用SPSS19.0 统计学分析软件对植物生物量、土壤理化性质、土壤酶活性、植物营养成分进行单因素方差分析,使用Origin 2019软件处理植物生物量数据并绘图;使用Usearch软件进行OTU 聚类分析;利用mothur 软件进行alpha 多样性指数分析和rarefaction 分析,用Coverage 指数表示测序深度指数,用Chao1 指数表示群落丰度,用Shannon 和 Simpson 指数表示真菌群落物种的丰富度和多样性;采用Pearson 法进行相关性分析(0.05 水平);冗余分析(RDA)、ANOSIM 和Heatmap 分析使用R 语言vegan 包作图;Beta 多样性采用Unifrac 距离计算,使用R 语言vegan 包完成。
2 结果与分析
2.1 1-42 与N94 互作对樟子松生物量指标的影响
由图1得出,1-42 处理组樟子松苗高、地径、根长、地上部分鲜质量、地下部分鲜质量、地上部分干质量、地下部分干质量同对照相比均存在显著性差异(P<0.05),分别增加了16.79%、33.17%、66.33%、87.67%、74.55%、42.44%、67.04%;N94 处理组樟子松苗高、地径、地上部分鲜质量和干质量、地下部分鲜质量同对照相比存在显著性差异(P<0.05),分别增加了23.29%、20.83%、73.46%、30.97%、99.31%;N94+1-42 处理组苗高、地径、地上部分鲜质量和干质量同对照相比存在显著性差异(P<0.05),分别增加了35.28%、16.75%、65%、38.31%。1-42处理组的根长、地径和地下部分干质量相对于N94处理组分别增加了70.87%、10.21%和61.46%;N94+1-42 处理组的苗高和地上部分干质量相对于N94 处理组分别增加了9.73%、5.60%。结果说明1-42 与N94 互作可以促进樟子松幼苗的生长。

图1 不同接种处理对樟子松1年生苗生物量的影响Fig.1 Effects of different inoculation treatments on 1-year seedling biomass of P.sylvestris var. mongolica
2.2 1-42 与N94 互作对樟子松1年生苗养分指标的影响
如表1所示,樟子松1年生苗主要营养成分指标在不同处理间具有显著性差异(P<0.05)。

表1 1-42 与N94 互作对樟子松幼苗养分指标的影响Table 1 The interaction between 1-42 and N94 affected the nutrient index of P.sylvestris var. mongolica
同对照(CK)相比,N94 与1-42 单接种和复合接种处理均可显著提高樟子松1年生苗根、茎和叶的养分含量。其中N94 单接种处理对幼苗养分指标全氮(TK)含量在根、茎、叶上均有显著提高,分别提高了76.56%、87.21%、42.66%。1-42 单接种幼苗养分指标有机质(OM)含量在根和叶上提高最显著,分别提高了28.28%、20.68%。N94+1-42 复合接种处理幼苗养分指标全钾(TK)含量在根、茎、叶上提高最显著,分别提高了161.1%、120.88%、206.12%;全氮(TK)含量在根和叶上均有提高,分别提高了145.31%、47.55%;全磷(TP)含量在根、茎上均有显著提高,分别提高了48.72%、24.77%;有机质(OM)含量在茎和叶上显著提高,分别提高了34.98%、26.31%。其中N94+1-42 复合接种处理效果优于N94 与1-42 单接种处理。
2.3 1-42 与N94 互作对樟子松根际土壤养分和酶活性的影响
如表2所示,同对照(CK)相比,N94 与1-42 单接种和复合接种处理均可显著提高樟子松1年生苗根际土壤养分指标含量(P<0.05)。其中N94 单接种处理对根际土壤养分指标过氧化氢酶活性(Catalase activity)、速效氮(AN)、全氮(TN)、磷酸酶活性(Phosphatase activity)、速效钾(AK)含量均有显著提高,分别提高了109.26%、116.66%、74.29%、24.69%、14.11%。1-42 单接种对根际土壤养分指标有机质(OM)、脲酶活性(Urease activity)有显著提高,分别提高了34.78%、25.41%。N94+1-42 复合接种处理对根际土壤养分指标速效氮(AN)、全磷(TP)、全氮(TN)、脲酶活性(Urease activity)、速效磷(AP)、有机质(OM)、蔗糖酶活性(Sucrase activity)、磷酸酶活性(Phosphatase activity)均有显著提高,分别提高了158.33%、96.13%、57.14%、43.77%、40.42%、36.95%、24.29%、23.12%。其中N94+1-42 复合接种处理效果优于N94 与1-42 单接种处理。

表2 1-42 与N94 互作对樟子松根际土壤养分和酶活性的影响Table 2 The interaction between 1-42 and N94 affected soil nutrients and enzyme activities in the rhizosphere of P.sylvestris var. mongolica
2.4 根际土壤细菌和真菌多样性分析
2.4.1 alpha 和beta 多样性分析
物种多样性是衡量群落生物组成的重要指标,可以反映群落内物种的多少,能够客观地比较各样品的差异性及相似性。4 组土壤样品的细菌、真菌多样性高通量测序分别获得229 555 103、393 991 268 条优化数据的序列条数,平均长度分别为412.78、256.57 bp。以97% 相似度划分,分别得到6 009、1 001 个OTU。4 组土壤样品的Coverage 指数细菌、真菌群落分别为0.994 8~0.979 3、0.999 5~0.998 7,表明测序数据基本包含了樟子松幼苗土壤中所有微生物类群,能够反映樟子松幼苗真实土壤环境中微生物的特性。如图2~3所示,细菌群落稀释性曲线、真菌群落稀释性曲线趋于平缓,说明试验对土壤样本微生物群落的检测比率接近饱和,目前的测序量能够覆盖样本中的绝大部分物种。

图2 细菌群落稀释性曲线Fig.2 Dilution curve of bacterial community

图3 真菌群落稀释性曲线Fig.3 Dilution curve of fungal community
alpha 多样性分析如表3所示,结合图4~图5群落OTU 分布Venn 图,比较4 组处理的细菌OUT,N94+1-42 与其他3 组有差异性(P<0.05),真菌OUT 无差异性。用chao1 算法估计样本中所含OTU 数目的指数,chao1 在生态学中常用来估计物种总数,比较不同处理的chao1 值,细菌群落存在差异性(P<0.05),N94+1-42 处理组和对照组大于单接种N94、1-42 处理组,真菌群落无差异性,说明1-42 与N94 互作的根际土壤细菌物种总数最多,但真菌物种总数差异性不大。Simpson 是用来估算样本中微生物多样性指数,Simpson 指数值越小,说明群落多样性越高。Shannon 是用来估算样本中微生物多样性指数,它与Simpson 多样性指数常用于反映alpha 多样性指数,Shannon 值越大,说明群落多样性越高。比较不用处理细菌的Simpson 值,N94+1-42处理组同其它3 组相比Simpson 降低,而真菌的值为N94+1-42 处理组大于对照组和单接种N94、1-42 处理组,比较Shannon 值细菌群落无差异性,N94+1-42 处理组同其它3 组相比真菌Shannon 降低,两者相互印证说明1-42 与N94 互作的根际细菌群落多样性最高,而N94 和1-42 互作会降低真菌群落的多样性,可能是N94 在1-42 的互作下,生物量增加,挤占了其它真菌的生长空间,使真菌群落多样性降低。

表3 α 多样性数据Table 3 α Diversity data

图4 细菌群落OTU 分布Venn 图Fig.4 Bacterial community OTU distribution Venn map
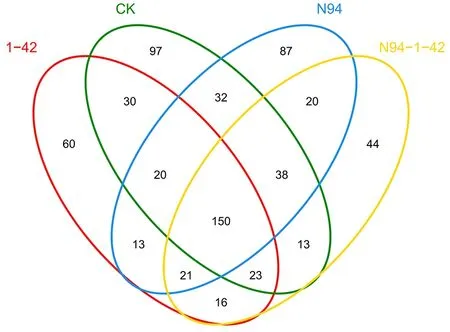
图5 真菌群落OTU 分布Venn 图Fig.5 Fungal community OTU distribution Venn map
beta 多样性分析可分析不同样本的OTU(97%相似性)组成,用于反映样本间的差异和距离。PCOA 利用方差分解,将多组数据的差异反映在二维坐标图上,坐标轴取能够最大反映方差值的两个特征值。样本组成越相似,在PCOA 图中的距离越近。如图6~7所示,4 组不同处理的土壤根际细菌群落和真菌群落相似性都较高。
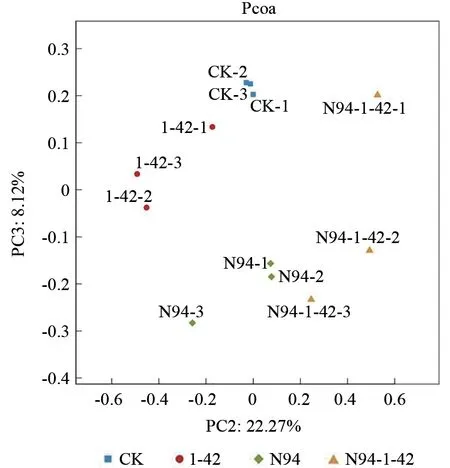
图6 细菌群落多样本PCOA 分析Fig.6 Multiple samples PCOA analysis

图7 真菌群落多样本PCOA 分析Fig.7 Multiple samples PCOA analysis
2.4.2 根际细菌群落组成分析
4 组不同处理的樟子松幼苗根际土壤样品的细菌群落分属于48 门120 纲309 目513 科994属1 522 种,真菌群落分属于6 门22 纲57 目115科202 属348 种,为了得到每个OTU 对应的物种分类信息,采用RDP classifier 贝叶斯算法对97%相似水平的OTU 代表序列进行分类学分析,结果如图8~9所示。4 组处理组的优势细菌群落为变形菌门Proteobacteria(57.2%)和酸杆菌门Actinobacteria(13.08%),此外单接种1-42处理组中拟杆菌门Bacteroidetes(7.24%)为优势群落,单接种N94 处理组(5.92%)和对照组(5.75%)中芽单胞菌门Gemmatimonadetes 为优势群落,N94+1-42 处理组中绿弯菌门Chloroflexi(10.8%)为优势群落。子囊菌门Ascomycota(81.78%)是4 组处理组相对丰度最高的真菌群落,其中N94+1-42 处理组中子囊菌门相对丰度高达93.54%,此外单接种1-42 处理组(9.66%)、单接种N94 处理组(17.85%)和对照组(9.75%)中担子菌门Basidiomycota 相对丰度较高。如图10~11所示,细菌群落中4 组不同处理中拉姆杆菌属Ramlibacter(7.87%)、芽单胞菌属Gemmatimonadetes(4.47%)为最优势菌属,此外马赛菌属Massilia在对照组(3.59%)和N94+1-42处理组(2.31%)中相对丰度较高,鞘脂单胞菌属Sphingomonas在单接种1-42 处理组(2.99%)和单接种N94 处理组(3.53%)中相对丰度较高。对比4 组不同处理的真菌群落,单接种N94 处理组(21.92%)、N94+1-42 处理组(53.43%)和对照组(25.47%)中芽孢杆菌Sphaerosporella为最优势菌属,N94+1-42 处理组相对于单接种N94 处理组提高了芽孢杆菌的相对丰度,也说明了N94 在1-42的互作下,挤占了其它真菌的生长空间,使真菌群落多样性降低;镰刀菌属Fusarium(38.05%)是单接种1-42 处理组的最优势菌属,同时在N94+1-42 处理组(8.06%)和对照组(22.97%)中相对丰度较高;单接种1-42 处理组的盘菌属Peziza(14.99%)相对丰度较高,单接种N94 处理组的革菌属Tomentella(14.84%)相对丰度较高。

图8 细菌相对丰度的柱状图(门水平)Fig.8 Bar chart of relative abundance of bacteria (phylum level)

图9 真菌相对丰度的柱状图(门水平)Fig.9 Bar chart of relative abundance of fungal (phylum level)

图10 细菌群落Heatmap 图(属水平)Fig.10 Bacterial community Heatmap (genus level)
3 结论与讨论
假单胞杆菌1-42 与褐环乳牛肝菌N94 互作提高了樟子松幼苗的生物量,同时说明根际细菌和菌根真菌互作可以提高植物的生物量,促进植物生长。Hungria 等[8]发现共接种根瘤菌和巴西固氮螺菌能提高大豆和菜豆的产量。巴西固氮螺菌和溶磷菌互作能促进高粱和大麦以及其他谷类生长,增加作物的产量和N、P 的吸收量[9]。还有试验表明菌根辅助细菌(如假单胞菌Pseudomonas)可以通过减少病原菌附着胞的形成,抑制病原菌生长,从而提高植物抗病能力,并引发JA 和乙烯(ethylene,ET)依赖性诱导的系统抗性反应(Induced systemic resistance,ISR),在植物抵御干旱、盐碱等非生物胁迫过程中发挥重要作用[22]。菌根辅助细菌可以提高菌根菌与宿主植物菌根合成的效率,同时菌根菌的存在对辅助细菌生物量和功能也存在显著影响[23]。菌根的存在也可以对植物根际土壤细菌类群起到正向调控作用,对根际的细菌尤其是荧光假单胞杆菌类群和功能多样性的研究表明,菌根菌在提高宿主植物养分吸收和促进生长的同时,对菌根际的细菌种类有定向选择作用,从而使菌根际的微生物类群更加有利于其菌根合成[24]。根际细菌和菌根真菌互作对樟子松幼苗根的营养成分如全氮、有机质、全钾、全磷含量都有显著影响。Plassard 等[25]研究证明低磷状态下宿主植物吸收磷主要依靠外生菌根的菌丝体。外生菌根可以增加小分子有机酸分泌量,将土壤中的不溶性磷转化为可溶性磷,磷酸酶将大量无机态磷元素转化为矿化态供植物利用[26],前人从菌根真菌Hebeloma cylindrosporum中分离出磷转运蛋白HPPT1 和Hc PT2,使得宿主植物磷有效吸收率大幅度提高[27]。研究发现,花旗松Pseudotsuga sinensisDode 菌根化后,根际的溶磷和嗜铁荧光假单胞杆菌数量明显高于未菌根化的根系,相同结果在Quercussessiliflora-Scleroderma citrinum菌根化根系中得到验证,根际的溶磷细菌明显高于未菌根化根系,菌根化根际细菌多数具有释放矿物元素的能力,菌根菌可以显著提高植物对磷元素的吸收能力[28]。

图11 真菌群落Heatmap 图(属水平)Fig.11 Fungal community Heatmap (genus level)
试验结果说明假单胞杆菌1-42 与褐环乳牛肝菌N94 对樟子松根际土壤养分如速效氮、速效磷,全氮、全磷、全钾、有机质和速效钾有显著影响,对土壤酶中的蔗糖酶活性影响不显著,但对土壤中磷酸酶、过氧化氢酶和脲酶活性有显著影响。Landis 等[29]对我国亚热带地区浙江常山县的3年田间试验发现,杂草物种丰富度的增加(0、4、8和12)直接影响土壤碳与氮含量以及显著提高了植物生物量积累。有研究证明部分内生细菌和根际细菌可分泌甲酸、乙酸等有机酸,将土壤中的不溶性有机磷和无机磷转换为可溶性的磷酸盐,供寄主植物吸收和利用[30]。土壤磷酸酶可以水解土壤中的有机磷酯,将土壤中的有机磷转化为植物可吸收的无机磷,土壤脲酶酶促反应的产物为氨,其活性代表着土壤氮从有机态向有效态转化的能力。蔗糖酶可以表征土壤生物活性强度[31]。过氧化氢酶能通过水解过氧化氢分解为水和氧的反应,解除过氧化氢对植物的毒害作用,可以用来表征土壤的生化活性,过氧化氢酶与土壤有机质转化密切相关,在土壤物质和能量转化中占重要地位[32]。本试验结果与沈甜等[33]对施用PGPR 混合菌剂的蒲儿根研究结果一致,施用了PGPR 混合菌剂的蒲儿根株高、根长以及氮、磷、钾含量均优于未施加菌剂的对照组,施加PGPR 混合菌剂可提高植物对养分的利用,例如碱解氮、有效磷、速效钾均有所增加,并且加入植物根际促生菌处理的土壤脲酶、蛋白酶、蔗糖酶、磷酸酶活性都显著提高,分别提高了80.28%、217.11%、43.26%、61.89%。
假单胞杆菌1-42 与褐环乳牛肝菌N94 互作可以提高根际细菌和真菌群落的多样性和丰富度。尹大川等[20]在研究复合接种褐环乳牛肝菌N94 与绿木霉T.virensT43 对樟子松根际土壤生物活性年际变化的影响时,发现N94 与T43 互作可以有效提高苗木根际细菌数量、真菌数量以及放线菌数量。有研究表明无机肥和微生物肥配施可以改良玉米根际土壤环境,增加土壤酶活性,提高土壤有机质和土壤养分含量。同时配施微生物肥料可以影响土壤细菌群落结构和多样性,促进根际优势菌群的定殖,进而加快植物的生长发育[34]。姚晓远[35]在研究微生态调控对烟草根腐病的田间防治时,发现哈茨木霉Trichoderma harzianum和多粘类芽孢杆菌Paenibacillus polymyxa均能抑制病原菌生长,对烟草根腐病有显著防控效果,并均能显著增加根际中溶杆菌属Lysobacter、鞘脂单胞菌属Sphingomonas和芽单胞菌属Gemmatimonas的相对丰度,抑制红球菌属Rhodococcus和镰刀菌属Fusarium的相对丰度;能显著增加根际有益微生物的数量、抑制病原菌的丰度,促进根际土壤微生态环境向健康方向发展。菌根辅助细菌可以提高菌根菌与宿主植物菌根合成的效率,同时菌根菌的存在对辅助细菌生物量和功能也存在显著影响[36]。菌根的存在也可以对植物根际土壤细菌类群起到正向调控作用,对菌根际的细菌尤其是荧光假单胞杆菌类群和功能多样性的研究表明,菌根菌在提高宿主植物养分吸收和促进生长的同时,对菌根际的细菌种类有定向选择作用,从而使菌根际的微生物类群更加有利于其菌根合成[37]。本研究仅在盆栽条件下进行,未涉及野外林间试验,PGPR 与外生菌根互作对根际土壤微生物群落的影响仅能说明两者之间的变化,且对于PGPR与外生菌根菌互作是通过什么途径来影响宿主植物对其他营养以及微量元素的吸收与利用?PGPR与外生菌根菌的互作机制如何?这些问题还需要进一步的研究。本试验仅以假单胞杆菌与褐环乳牛肝菌作为代表,涉及菌株单一,但土壤微生物往往互相影响形成丛枝菌根网络,PGPR 与外生菌根二者相互的选择特异性较强,下一步试验可丰富菌株种类,增加野外林间试验。除了上述的生理生化影响以外,对于PGPR 对外生菌根菌定植宿主植物的影响是否存在最适方法?接种方式对试验的最终结果是否会有影响?如何制备可以量产的菌根肥料将成为后续菌根技术应用的一个重要方向。

