马尾松优良家系不定芽诱导及腋芽高效增殖组培体系构建与优化
尚瑀琪,杨模华,段润梅,徐 萌,张 钰,陈 艺,李亚婧
(中南林业科技大学 林学院,湖南 长沙 410004)
马尾松Pinus massonianaLamb.是我国南方重要的乡土造林用材树种和工业原料树种,具有适应性强、耐干旱瘠薄、速生丰产等优点;当前,马尾松松材线虫病严重威胁着马尾松林产工业的健康发展,选育和栽培抗松材线虫病的马尾松优良家系或无性系,开展抗性杂交育种或倍性育种,并对育种选育成果进行扩繁利用、栽培推广,是从根本上防治和减轻松材线虫病及其危害的重要途径之一。针叶树器官发生组培快繁体系的构建是短期内实现对珍贵稀有种质快速扩繁、保存和利用的生物技术育种手段之一,构建马尾松优良家系种胚不定芽诱导及其腋芽高效增殖的组培快繁植株再生体系在对马尾松抗性育种所获得的珍贵抗性育种材料的扩繁利用中将发挥重要作用。
马尾松组织培养植株再生已得到林木育种界的普遍关注,现有的报道表明,分别采用马尾松成熟胚、无菌苗或幼胚等为外植体,应用6-BA、KT、NAA 等细胞分裂素类或生长素类植物生长调节剂经器官发生不定芽诱导,已取得马尾松组培植株再生的成功[1-3]。姚瑞玲等[4-6]以马尾松组培继代芽、茎段芽等材料为外植体,经不定芽诱导获得完整再生植株,并将获得的马尾松组培苗成功应用于造林实践。然而,高质量不定芽诱导困难仍旧是马尾松组培快繁应用的技术瓶颈之一,尤其是对珍贵稀有的育种材料或少量的优良抗性种质而言,构建一个稳定、高效的对珍贵稀有种质进行扩繁利用的组培体系,是保障优良种质安全的基本要求。
为稳定地诱导出高质量的不定芽,一般采用不同生长调节剂种类及其水平组合来调控松属Pinusspp.树种组培不定芽诱导与分化。许多研究已普遍关注到6-BA 等细胞分裂素类物质的浓度水平对松类组培不定芽诱导具有显著性影响[7-10],然而仅有少量研究关注到生长调节类物质持续作用于外植体的诱导时长也会对松类组培不定芽诱导产生显著性影响[11-13]。如Pérez-bermúdez 等[11]在湿地松Pinus elliottii不定芽诱导中发现,6-BA不同诱导时长水平对湿地松外植体不定芽诱导有显著的影响;Webb 等[12]在北美乔松Pinus strobus不定芽诱导植株再生研究中发现,植物生长调节剂的诱导时长过短或过长均不利于北美乔松不定芽的诱导分化。近些年来,在火炬松Pinus taeda[13]、意大利松Pinus pinea[8,14]等松属树种的组培研究中也发现,子叶胚外植体在6-BA 长时间持续作用下对其不定芽诱导质量及其不定芽伸长均有较大影响,且植物生长调节剂诱导时间较长时,外植体易发生愈伤化、玻璃化现象,还易产生矮小芽。Cortizo 等[15]开展了不同诱导时长下意大利松成熟合子胚对外源6-BA 吸收与代谢的生理响应研究,结果表明外植体对外源6-BA 的吸收及代谢等生理响应在不同时长处理下具有显著性差异。因此在松属树种器官发生不定芽诱导过程中,探讨获得一个适宜的外源植物生长调节剂持续作用的诱导时长对诱导获得高质量不定芽也十分关键。为诱导获得高质量的不定芽,对培养基中植物生长调节剂浓度及其处理时长的交互作用对芽诱导影响的研究,值得探讨。另外,不定芽的伸长培养、腋芽增殖发生、生根诱导等,同样是培养基环境中的营养供应、植物生长调节剂浓度与时长处理共同作用于培养物的结果。因此,本研究为构建稳定、高效的马尾松成熟胚芽诱导与增殖组培快繁植株再生体系,在马尾松成熟胚不定芽诱导、不定芽伸长培养、茎段腋芽增殖发生、茎段腋芽伸长培养与生根诱导过程中,开展植物生长调节剂6-BA、IBA 浓度及其诱导时长的优化探讨,为马尾松抗性育种、杂交育种或倍性育种获得的少量珍稀优良种质的保存利用提供稳定、高效的组培扩繁利用平台。
1 材料与方法
1.1 试验材料
本试验材料所用的马尾松成熟种子来自浙江省淳安县姥山林场国家马尾松良种基地二代种子园的56 号优良家系,由中国林业科学研究院亚热带林业研究所馈赠。
1.2 试验方法
1.2.1 种子预处理
选择饱满、完整的马尾松成熟种子备用,先用自来水快速冲洗,捞出饱满种子沥干水分,再用镊子小心地去除外种皮,把去皮种子置于4℃冰箱冷藏备用,不超过24 h 接种处理。
1.2.2 外植体消毒灭菌处理
马尾松去皮种子先在烧杯中用 0.5% K2MnO4溶液搅拌浸泡30 min,无菌水清洗2~3 次,去除K2MnO4残留液;然后将种子转移至无菌烧杯中,置于超净工作台上进行去皮种子灭菌处理:先用75%的酒精浸润30 s,无菌水清洗3 次,再用0.1%升汞溶液搅拌浸泡处理6 min,最后用无菌水冲洗3~5 次;将灭菌处理后的去皮种子转移到无菌培养皿中备用;外植体接种处理时,先用无菌手术刀片小心划开胚乳,无菌剥取种胚,放置于相应实验处理的培养基中,进行不定芽诱导。
1.2.3 马尾松成熟胚初代不定芽诱导
马尾松不定芽诱导以WPM 为基本培养基(WPM1),添加30.0 g·L-1蔗糖和8.5 g·L-1琼脂,培养基pH 值调至5.8,装入组培玻璃瓶中,121℃高温高压灭菌20 min,冷却凝固后使用。6-BA 浓度设置3 个水平处理:4.4、11.1、44.4 μmol·L-1。6-BA诱导时长设置5 个水平处理:2、4、8、16、32 d。以上浓度和诱导时长按因素和水平进行完全随机组合,计15 个处理,另加一个对照处理CK(6-BA 0.0 μmol·L-1,0 d),共16 个处理。每处理接种36 个马尾松成熟合子胚,每处理3 次重复。每一浓度与时长诱导处理完成时,该处理下的外植体均及时转接到WPM 初次继代培养基(WPM2)(含3.0 g‧L-1活性炭,不含植物生长调节剂)中培养28 d,然后再转接至WPM 继代培养基(WPM3)(无活性炭,无植物生长调节剂)中继代培养。定期观察记录外植体在诱导培养基中的生长状态及其变化,接种处理开始后40 d 观察记录丛生芽诱导数量、芽长、芽生长状况等,计算不定芽诱导率及其增殖系数,进行数据统计分析。
1.2.4 马尾松不定芽伸长培养
将经过6-BA 不同浓度和不同时长诱导处理后的外植体,初次转接至WPM2 初次继代培养基中培养28 d,然后再转接至WPM3 继代培养基中进行继代培养,继代周期为28 d。伸长培养过程中,定期拍照、观察记录外植体上不定芽伸长生长状态,记录不定芽数量、长度、长势等表型数据,对各个处理自接种后第60 天或连续继代3~4 次后的不定芽伸长培养记录得到的各项观察指标进行统计分析。
1.2.5 马尾松茎段腋芽增殖培养
以经过伸长培养后的不定芽为外植体,无菌条件下切割为单个不定芽或1.5~2.0 cm 长的茎段,作为腋芽增殖用外植体。将切割的茎段芽接种至WPM 基本培养基(WPM4)中,进行茎段腋芽增殖培养,分别开展6-BA 浓度和诱导时长的单因素处理试验。6-BA 设置3 个水平:4.4、11.1、22.2 μmol·L-1,诱导32 d。诱导时长设置3 个 水平:8、16、32 d。附加6-BA 浓度为11.1 μmol·L-1。茎段腋芽增殖培养结束后,将茎段外植体转接至伸长培养基中进行腋芽伸长培养(WPM5),见1.2.6处理。自增殖处理开始后第40 天观察记录从叶腋诱导出的腋芽数,测量芽长,观察记录腋芽诱导生长状态,计算腋芽增殖系数,进行数据统计分析。
1.2.6 马尾松茎段腋芽伸长培养
将丛生腋芽于无菌条件下切割为单芽,进行腋芽伸长培养。腋芽伸长培养分别考虑WPM 基本培养基中铵硝比(NH4+/ NO3-)或IBA 与6-BA 的添加对芽伸长的影响(WPM5),分别开展不同铵硝比(NH4+/ NO3-)或IBA+6-BA处理的单因素试验。铵硝比(NH4+/ NO3-)设置4 个水平:0、0.2~0.4、0.5(对照)、0.8~1.0。IBA+6-BA 设置5 个水平(μmol·L-1):0+0.44(IBA 对照)、0.49+0.44、0.98+0.44、1.96+0.44、0.98+0(6-BA 对照)。腋芽伸长培养过程中,每30 d 观察记录腋芽长度、生长状况等,进行数据分析。
1.2.7 马尾松伸长腋芽生根诱导
将经伸长培养获得的长度大于1.5 cm 的单芽转到1/2WPM(大量元素减半)生根培养基中进行生根诱导(WPM6),附加IBA 浓度0、4.9、9.8、19.6 μmol·L-1,28 d 后,将已观察到带根原基的组培苗转接至无激素的1/2WPM 培养基(WPM7)中。自生根诱导培养开始后第40 天统计生根情况,包括生根的外植体数、生根率、不定根数量、不定根长度、根系生长状态等。
1.3 培养条件
以上所有处理均放置于培养室中,培养室环境设置:培养温度(23±2)℃,光照强度为2 000~3 000 lx,光暗周期16 h/8 h。
1.4 数据统计与处理
利用Excel 2010 和SPSS 20.0 统计软件对试验数据分别进行双因素方差分析和单因素方差分析,在ɑ=0.05 水平上进行LSD 重比较。每处理中不定芽诱导率和增殖系数按以下公式计算:
不定芽诱导率=(诱导出不定芽的外植体数 /接种成活外植体总数)×100%;
增殖系数=诱导出的不定芽总数/已诱导出不定芽的外植体数;
生根率=(诱导出根的外植体数/接种成活外植体总数)×100%。
2 结果与分析
2.1 马尾松成熟胚芽诱导及腋芽增殖组培快繁体系的构建
通过对组织培养体系中植物生长调节剂6-BA、IBA 浓度及处理时长影响效应的探讨,成功优化并建立了马尾松优良家系成熟胚不定芽诱导与腋芽增殖的植株再生快繁体系(图1)。以成熟合子胚为初始外植体进行不定芽诱导(图1A),经高浓度44.4 μmol·L-16-BA 诱导处理中长时长16 d,继代伸长培养后可诱导出大量翠绿健壮的不定芽丛(图1B),其增殖系数约为8;无菌条件下将丛生芽切割为 单个不定芽(图1C),在低硝铵比WPM 伸长培养基中获得较好的伸长培养效果(图1D);待芽长>1.5 cm 时,添加中高浓度22.2 μmol·L-16-BA 诱导32 d 的时长处理,进行腋芽增殖培养,其增殖数量平均可达10 左右,最高可达36~40(图1E);将丛生腋芽分割为单芽进行腋芽伸长培养(图1F),最后对其进行生根诱导,获得再生植株(图1G)。

图1 马尾松成熟合子胚器官发生植株再生体系的构建Fig.1 Micropropagation via organogenesis using mature zygotic embryo in masson pine tissue culture
2.2 6-BA 浓度及其诱导时长处理下马尾松成熟合子胚不定芽诱导发生的形态学观察
图2为6-BA 浓度及其诱导时长不同处理下马尾松成熟合子胚不定芽诱导与生长的形态学观察不同阶段的表型表现,结果表明,随着6-BA 浓度的增加或处理时长的延长,不定芽诱导和不定芽生长状态呈现规律性的增强效应,且浓度与时长处理间不定芽诱导的交互效应明显(图2)。低浓度(4.4 μmol·L-1)6-BA 诱导处理4 d 后,种胚开始萌动,胚轴增粗,颜色由白色变为粉红色,子叶张开,其颜色也由淡黄色逐渐变为黄绿色(图2B1);诱导处理8 d 后的合子胚外植体,子叶为嫩绿色,胚轴膨大量比处理4 d 的更粗,并开始弯曲(图2C1);诱导处理16 d 的合子胚外植体,子叶完全张开,胚轴和子叶均增粗明显,表面出现颗粒状突起,胚轴基部出现膨大的粉色团状物(图2D1)。诱导处理32 d 的合子胚外植体,子叶增粗伸长,在近子叶的胚轴处发现有较多明显突出的芽原基突起(图2E1)。而在中、高浓度6-BA(11.1,44.4 μmol·L-1)处理下,不同诱导时长的合子胚外植体状态与低浓度处理时比较,胚轴和子叶均有显著的增粗、愈伤化逐渐明显的表 现,尤其在高浓度6-BA(44.4 μmol·L-1)处理32 d 时,子叶顶端及胚轴处出现明显的淡黄色愈伤组织(图2O1)。各个诱导处理结束后,将合子胚外植体分别转移至继代培养基中进行不定芽伸长培养。在低浓度6-BA(4.4 μmol·L-1)诱导培养条件下,短时长(2、4 d)诱导处理,对不定芽诱导无明显效果,常出现单芽苗(图2A2—B2);中时长(8 d)诱导处理,可诱导产生1~2 个不定芽(图2C2);中时长(16 d)和长时长诱导(32 d)的处理,其诱导分化出的不定芽数量明显增多,不定芽针叶翠绿,茎段粗壮(图2D2—E2)。在中浓度6-BA(11.1 μmol·L-1)诱导培养条件下,诱导2、4 d 时,其诱导分化出不定芽数量较少,单株外植体仅能分化1~2 个不定芽(图2F2—G2);诱导8、16 d 的处理相比于同时长的低浓度6-BA 培养条件下,外植体不定芽数明显增多(图2H2—I2);诱导32 d 时,其不定芽丛显著增多,但表面开始出现愈伤组织,且芽体矮小(图2J2)。在高浓度6-BA(44.4 μmol·L-1)诱导培养条件下,与低、中浓度6-BA 短时长(2、4、8 d)不同诱导时长处理相比较,其高浓度时诱导产生的不定芽数量显著增多(图2K2—O2);而在诱导16 d 的中时长处理下,外植体上仅有少量不定芽伸长,更多的是形成密集的增殖芽点(图2N2);诱导时长为32 d 的长时长处理中,不定芽的顶端和叶均分化不明显,仅形成矮小芽丛,且与培养基接触的基部形成了大团状愈伤组织(图2O2)。马尾松合子胚外植体在6-BA 不同浓度与不同诱导时长处理下所获得的不定芽,继代伸长培养不定芽生长状态主要可分为三类:一是不定芽数量少,芽体纤细,生长较弱;二是不定芽数量多,芽体粗壮,颜色翠绿,生长状态良好;三是不定芽基部较多愈伤组织,不定芽生长不良。

图2 6-BA 浓度一定时不同诱导时长处理下不定芽诱导初期和继代培养后形态学观察Fig.2 Morphological observation of adventitious bud induced at a specific concentration of 6-BA with different induction durations in two stages
2.3 不同6-BA 浓度及其诱导时长对不定芽诱导的影响
以时长为分组,分别对6-BA 低、中、高(4.4、11.1、44.4 μmol·L-1)不同浓度处理下不定芽数和芽长进行统计作图,结果(图3A—B)表明,特定时长处理下6-BA 不同浓度处理间具有显著性差异(P<0.05)。诱导时长较短时,6-BA 浓度对不定芽数量的诱导起显著的促进作用,但诱导时长较长时,浓度效应不太明显。如诱导时长为4 d时,6-BA 高浓度处理下不定芽的增殖系数可达到低浓度处理下的4.76 倍(5.15 与1.08);而在中时长(16 d)诱导处理时,低浓度处理也能达到6.02的增殖系数,与中浓度处理(6.56)差异不显著(P>0.05),与高浓度处理(7.78)有显著性差异(P<0.05),但高、低浓度增殖系数的比值也仅为1.29(7.78 与6.02)。过短的诱导时长(2 d)处理下,6-BA 无论是低、中还是高浓度水平,均只得到了1.0~2.5 倍的不定芽增殖率(1.00、1.47、2.49);而诱导时长过长(32 d)时,各浓度处理下所获得的正常不定芽数出现减少的现象(图3A),芽体也较矮小(图3B)。因此,植物组培高质量的不定芽诱导中,既要考虑培养基中植物生长调节剂的浓度水平,也要同时重点关注外植体置于诱导培养基上的处理时长。

图3 6-BA 浓度及其诱导时长对不定芽诱导及其芽长生长的影响Fig.3 Effects of 6-BA with different concentrations and its durations on induction of adventitious bud and its bud length in masson pine tissue culture
分别以6-BA 低、中、高浓度为分组,展示不同诱导时长(2、4、8、16、32 d)处理下不定芽诱导及芽长的变化趋势(图3C—D)。结果表明,特定6-BA 浓度处理下,不同诱导时长对马尾松不定芽诱导增殖及其芽生长有显著性差异(P>0.05)。在特定浓度内,随着诱导时长的延长,不定芽数量先增加后下降(图3C),而不定芽的长度则随6-BA 浓度的增加呈现规律性下降(图3D)。在6-BA 低浓度(4.4 μmol·L-1)处理下,不定芽分化的数量在两个短时长(2、4 d)处理间差异不显著(P>0.05),但两短时长处理与中、长时长(8、16、32 d)处理间有显著性差异(P<0.05),以上4 种处理下,芽长均在1.0 cm 以上。6-BA 中、高浓度(11.1、44.4 μmol·L-1)处理下,诱导8、16 d 的处理均获得了比诱导32 d 的处理较好的不定芽诱导增殖效果(图3C),而在诱导32 d 处理下,其芽长仅在0.5 cm 左右(图3D),在后期继代培养时芽的生长势严重受限,这说明在中高浓度下增加诱导时长会严重抑制芽的生长。在6-BA 不同浓度水平内,诱导时长为16 d 的处理均达到最高的不定芽诱导增殖系数,分别为6.02、6.56、7.78,且不定芽长势良好,该浓度及其时长的处理可以作为今后马尾松高质量不定芽诱导的推荐方案。
6-BA 浓度水平与诱导时长对不定芽诱导具有显著的交互效应(P<0.05)。6-BA 浓度与时长的交互处理,不仅影响成熟胚不定芽的增殖数量,也极大地影响成熟胚不定芽的芽长及其生长势。研究发现6-BA低浓度(4.4 μmol·L-1)、长时长(32 d)处理与6-BA 高浓度(44.4 μmol·L-1)、短时长(4 d)处理,不定芽分化效果基本一致,不定芽数量多,平均增殖系数均在5 左右,且芽体颜色翠绿,茎段粗壮(图2E2、L2);同时6-BA 浓度与时长的交互效在两个极值水平的组合上表现得尤为突出。当同为6-BA 短时长(2 d)处理时,6-BA低浓度(4.4 μmol·L-1)处理中几乎没有不定芽诱导发生(图2A2),而 6-BA 高浓度(44.4 μmol·L-1)则能诱导出少量不定芽(图2K2),其增殖系数在1.0~3.0 之间变动,具有相对较高的芽长生长量,单芽的芽长在2.0~2.5 cm 范围,不定芽生长状态较纤细;当同为6-BA 长时长(32 d)处理时,6-BA 低浓度就能诱导产生数量较多、质量较高的不定芽(图2E2),增殖系数可达5.12,可芽长相对其他诱导时长下较矮,仅在1.0 cm 左右,而6-BA的高浓度却诱导产生了大量愈伤组织团,并从愈伤组织团上再分化出较多不定芽(图2O2),然而,尽管此处理下不定芽数量较多,但芽丛矮小,且这些矮小芽在后期的继代培养中很难伸长培养长成正常的芽苗。因此,在组织培养不定芽诱导中,关注不定芽诱导数量多少的同时,也需考虑不定芽的诱导质量高低,而不定芽诱导的数量和质量问题,可以通过调控诱导培养基中植物生长调节剂浓度及其诱导时长予以解决。
2.4 马尾松茎段腋芽继代增殖
2.4.1 6-BA 浓度对马尾松茎段腋芽继代增殖的影响
在诱导时长为32 d的处理下,不同浓度的6-BA(4.4、11.1、22.2 μmol·L-1)对马尾松茎段不定芽继代增殖有显著影响(P<0.05)。由表1可知,腋芽增殖数随6-BA 浓度的升高而显著提高,呈现规律性地增加,而腋芽长度却随6-BA 浓度升高呈现规律性地降低。在6-BA 低浓度(4.4 μmol·L-1)和中浓度(11.1 μmol·L-1)处理下,两者腋芽增殖系数的比值仅为1.11(4.29 与3.85),腋芽长度均在1.1~1.3 cm 之间,均无显著性差异(P>0.05)。在6-BA 高浓度(22.2 μmol·L-1)处理下,腋芽增殖系数最高,为10.15,与6-BA 低浓度和中浓度处理相比,增殖系数分别明显提高了2.63、2.37 倍,处理间具有显著性差异(P<0.05),但腋芽长度明显降低,降低至0.75 cm 左右。这说明6-BA 高浓度可以有效促进腋芽的增殖分化,但会抑制其芽伸长生长。
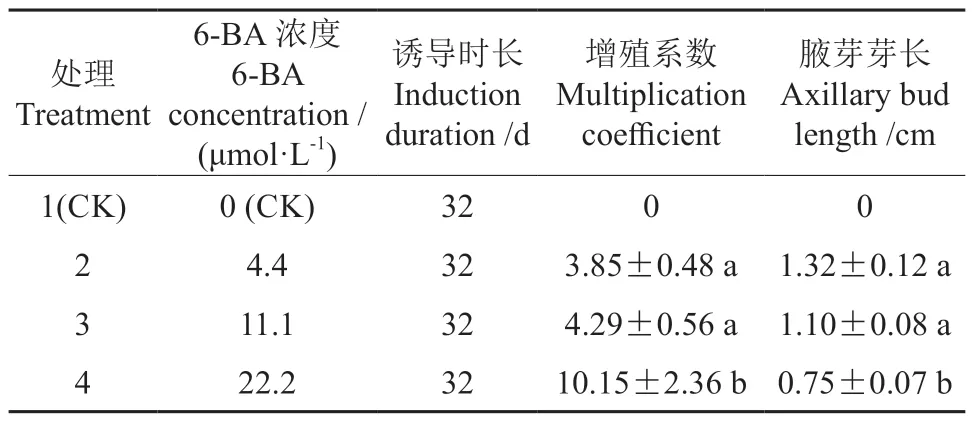
表1 一定诱导时长下不同6-BA 浓度对马尾松腋芽增殖的影响†Table 1 Effect of 6-BA concentrations under specific induction duration on the proliferation of axillary buds in masson pine tissue culture
不同6-BA 浓度对马尾松腋芽增殖的差异表现见图4。由图4可知,6-BA 低浓度(4.4 μmol·L-1)与中浓度(11.1 μmol·L-1)处理下单株外植体的腋芽分化数量为3~5 个,每个叶腋诱导出1~2个腋芽,腋芽颜色翠绿,生长正常(图4B—C)。6-BA 高浓度(22.2 μmol·L-1)处理下,单株外植体腋芽分化数量均在7 个以上,最高可达36~40个,每个叶腋诱导出多个腋芽,且芽体健壮翠绿(图4D)。通过图4不同处理的比较,可以更加直观地观察到6-BA 浓度对腋芽增殖效应的差异,高浓度6-BA(22.2 μmol·L-1)对马尾松腋芽增殖处理的效果更显著。

图4 诱导时长一定时,不同 6-BA 浓度对腋芽增殖的差异表现Fig.4 Differential performance of axillary bud proliferation in different 6-BA concentration under an specific induction duration
2.4.2 6-BA 诱导时长对马尾松茎段腋芽继代增殖的影响
不定芽单芽在含6-BA 11.1 μmol·L-1的培养基中进行继代增殖培养,结果(表2和图5)表明,不同诱导时长(8、16、32 d)对马尾松腋芽增殖及芽生长具有显著性影响(P<0.05)。随着诱导时长的延长,腋芽分化数量随之增加,而腋芽长度却呈现下降趋势。短时长(8 d)诱导处理下,腋芽增殖系数仅为3.72,其腋芽长度在1.43 cm 左右,均与中时长(16 d)和长时长(32 d)存在显著性差异(P<0.05)。诱导时长为16 d 和32 d时,其腋芽增殖系数均较高,分别为5.79 与6.11,此时腋芽长度较短时长处理下较矮,均在1.1 cm左右。从图5可以看出,中时长(16 d)和长时长(32 d)与较短时长(8 d)相比,腋芽增殖数量明显增加,差异显著,且中、长时长(16、32 d)处理下的外植体均未出现愈伤化现象,芽体颜色翠绿,生长状态良好,这说明在该6-BA 浓度(11.1 μmol·L-1)处理下,延长诱导时长对马尾松茎段腋芽增殖具有显著的正向促进效应。

图5 6-BA 浓度一定时不同诱导时长对马尾松茎段腋芽增殖的影响Fig.5 Effect of different induction duration with a specific concentration of 6-BA on the axillary bud proliferation in masson pine tissue culture
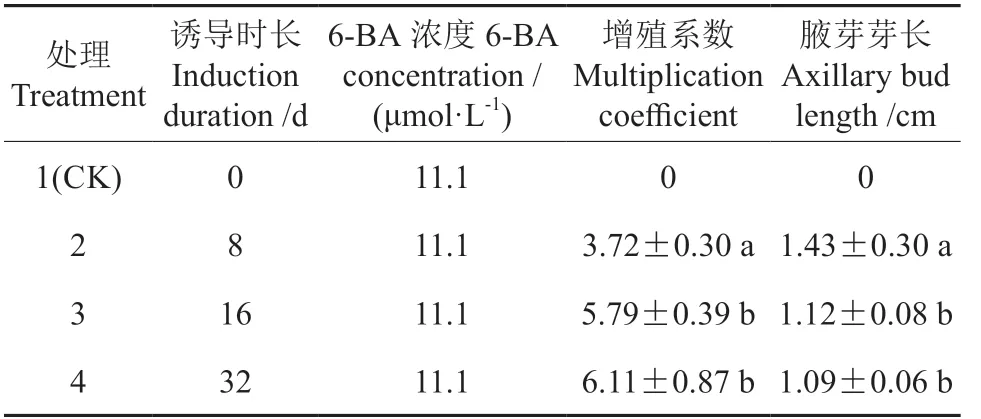
表2 6-BA 一定浓度下不同诱导时长对马尾松茎段腋芽增殖的影响Table 2 Effect of different induction durations with a specifci concentration of 6-BA on the proliferation of axillary bud in masson pine tissue culture.
2.5 马尾松茎段腋芽伸长培养
2.5.1 铵硝比(NH4+/NO3-)对腋芽伸长的影响
由表3可知,WPM 基本培养基中不同铵硝比(NH4+/NO3-)对腋芽伸长培养具有显著性影响(P<0.05)。培养30 d 时,各处理中腋芽伸长培养的长度由高到低的排序为WPM52>WPM53>WPM51>WPM54,且WPM52 和WPM53 均与WPM54 具有显著性差异(P<0.05),而与WPM51 差异不显著(P>0.05),WPM52 和WPM53 之间无显著性差异(P>0.05);培养60 d 时,各处理苗高伸长量由高到低依次为WPM53>WPM52>WPM51=WPM54,此 时WPM52 和WPM53 均 与WPM51 和WPM54 存 在显著性差异(P<0.05),而WPM52 与WPM53之间差异不显著(P>0.05)。综合培养 30、60 d的伸长培养处理的结果发现,WPM 基本培养基中去NH4+处理和低铵硝比水平(NH4+/NO3-:0.2~0.4)处理对腋芽伸长培养具有更好地促进作用,而中铵硝比水平(NH4+/NO3-:0.5)处理和高铵硝比水平(NH4+/NO3-:0.8~1.0)处理均对腋芽伸长培养的效果低于低铵硝比水平,这说明低NH4+水平有利于马尾松腋芽的伸长生长。
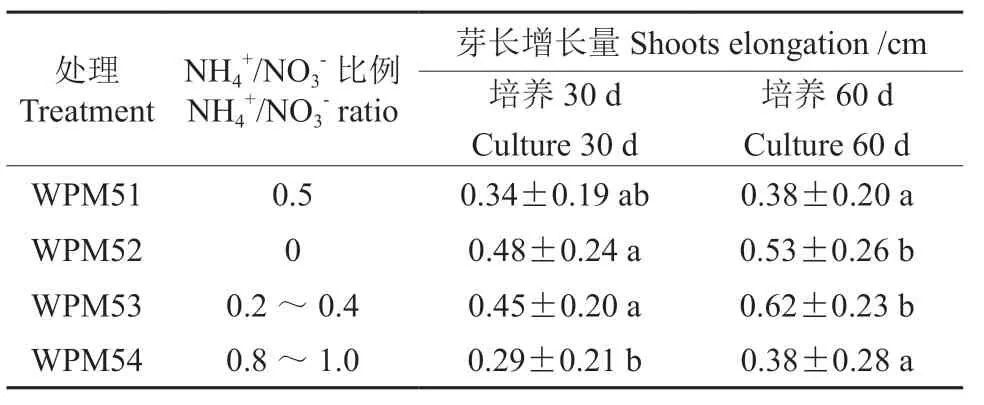
表3 不同铵硝比(NH4+/NO3-)对马尾松腋芽伸长培养的影响Table 3 The effect of NH4+/NO3-ratio on the elongation of axillary bud of masson pine
2.5.2 IBA 与6-BA 处理对腋芽伸长培养的影响
由表4可知,培养基中添加不同浓度的IBA与6-BA处理对腋芽伸长培养具有显著性影响(P<0.05),芽长排序为B3>B5>B4>B2>B1,较优的两个处理B3 与B5 之间差异不显著(P>0.05),B3 与其他处理B1、B2、B4 之间存在显著性差异(P<0.05);培养60 d 时,各处理芽长伸长量由高到低依次为B3>B5>B2>B4>B1,B3 与B5 仍为较优的两个处理,且两者之间差异不显著(P>0.05),与其他处理B1、B2、B4 之间存在显著性差异(P<0.05)。综合培养30、60 d 的腋芽伸长培养的生长情况,发现腋芽伸长趋势随IBA 浓度的升高而呈现先升高后下降的现象,这说明适宜的IBA 浓度(0.98 μmol·L-1)对腋芽的伸长培养生长具有更好地促进作用。

表4 IBA 与6-BA 浓度对马尾松腋芽伸长培养的影响Table 4 Effects of IBA and 6-BA concentration on the elongation of axillary bud of masson pine
2.6 马尾松茎段芽生根诱导
把经腋芽伸长培养获得的长度大于1.5 cm 的单芽接种在含IBA 不同浓度的1/2WPM 生根培养基中进行生根诱导,约3 周后观察到部分茎段芽基部开始出现乳白色的不定根原基(图6A);4 周后不定根逐渐伸长,长度为1 cm 左右(图6B);5 周后不定根继续增粗伸长至2 cm 左右(图6C)。生根诱导处理40 d 后,统计生根率、生根数、根长等数据,统计结果见表5。由表5可知,不同浓度的IBA对茎段芽不定根诱导具有显著性影响。生根处理40 d 后观察,对照CK 无不定根发生(图7A);随着IBA 浓度由低浓度(4.9 μmol·L-1)向高浓度(19.6 μmol·L-1)升高,生根的数量先增加后降低,不定根的生根状态也有差别。具体表现为当IBA 浓度为中浓度(9.8 μmol·L-1)时,单个茎段生根处理中无明显主根,长出数量较多的侧根和须根,并出现根系的二级分支,生根效果较好,培养40 d 时统计其生根率为45.83%,根长为2 cm左右,且根系发达(图7C);随着IBA 浓度的升高,与培养基接触的茎段基部发生少量团状愈伤组织,此时生根率降低。IBA 低浓度(4.9 μmol·L-1)和高浓度(19.6 μmol·L-1)处理时,生根情况均较差,生根率分别为31.82%和40.91%,且低浓度处理时根系状态较差,白色,细弱,少侧根(图7B);而高浓度处理下,在茎段芽与培养基接触的基部出现较多愈伤组织,而经愈伤组织分化出的不定根其质量较差,根数量少。因此,IBA 浓度为9.8 μmol·L-1时,有利于马尾松茎段芽不定根的诱导(图7D)。

图6 马尾松茎段芽生根诱导时IBA 处理下不定根随时间变化的发生过程Fig.6 The process of rooting at different stages with the treatment of IBA on rooting induction in masson pine tissue culture.
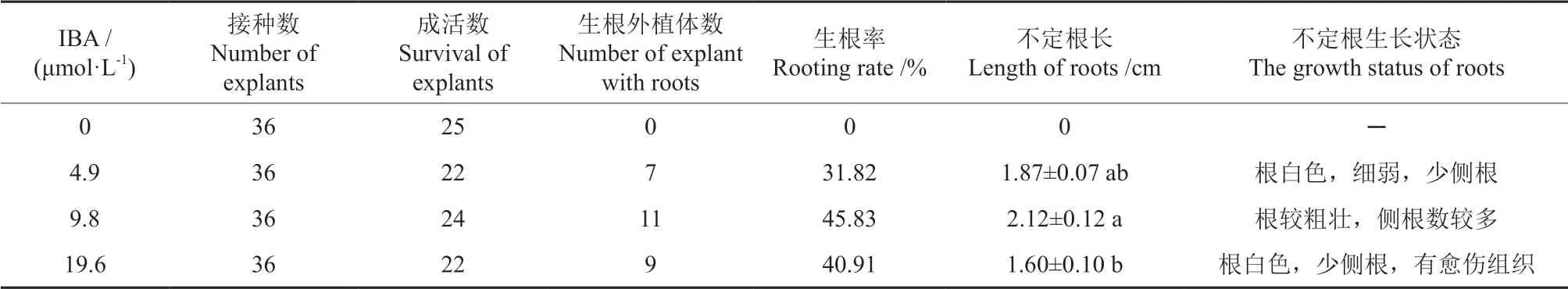
表5 IBA 浓度对马尾松茎段芽生根诱导的影响Table 5 Effect of IBA concentration on root induction in masson pine tissue culture

图7 马尾松茎段芽生根诱导不同浓度IBA 处理的生根状况Fig.7 Rooting performance with different IBA concentrations on rooting induction in masson pine tissue culture
3 结论与讨论
3.1 结 论
本研究针对植物生长调节剂浓度和处理时长影响外植体芽分化数量及质量这一问题,从6-BA不同浓度及诱导时长两方面开展了马尾松不定芽诱导植株再生的研究,主要结论是:植物生长调节剂浓度和诱导时长之间对不定芽诱导存在显著的交互作用,在组培不定芽诱导过程中,既要关注植物生长调节剂的浓度效应,同时也需要重点考虑不同诱导时长下不定芽诱导的时长效应,合适的浓度和时长处理是提高不定芽诱导质量的保障,而高质量的不定芽诱导也是对有限的优良抗性材料实现资源扩繁以芽繁芽组培快繁体系建立的关键环节。本研究结果得出,马尾松成熟胚适宜的不定芽诱导培养条件为6-BA 44.4 μmol·L-1+WPM培养基以及诱导处理时长8 d 或16 d;不定芽继代增殖的最适宜培养条件为6-BA 22.2 μmol·L-1+WPM,诱导处理时长32 d;WPM 培养基中低铵硝比(0.2~0.4)对芽伸长培养的促进效果最佳;生根诱导中,IBA 为9.8 μmol·L-1时,茎段芽诱导生根的质量高,根系状态良好。本研究建立了一套对有限马尾松优良家系种胚开展成熟胚不定芽诱导、继代增殖以芽繁芽的组培快繁体系,理想情况下,单颗成熟种胚的增殖扩繁系数在一年半的时间内可达到500~1 000 倍,且随着时间的延长,增殖倍数可呈几何级扩增。
3.2 讨 论
已有研究表明,组培体系中6-BA 浓度水平与诱导时长的交互作用会导致外植体细胞内激素环境发生变化,而内源激素的平衡差异又会影响到细胞的分化方向[16]。组培不定芽的发生无论是直接器官发生还是间接器官发生,其实质是在外源环境胁迫下细胞内源基因差异表达重编程的结果[17]。本研究中发现,6-BA 低浓度、长时长或高浓度、短时长处理下,马尾松不定芽诱导发生方式主要是直接器官发生,而在6-BA 高浓度44.4 μmol·L-1、长时长32 d 诱导处理下,不定芽诱导发生方式主要转变为间接器官发生,即先形成愈伤组织再分化出不定芽,可是其芽丛矮小。这说明6-BA 高浓度(44.4 μmol·L-1)、长时长处理不利于高质量芽的诱导,而高浓度6-BA、短时长(4 d)的处理则对不定芽的诱导形成有利,且不定芽的诱导质量较高。
Tereso 等[18]的研究表明,细胞分裂素类生长调节剂的浓度对海岸松Pinus pinasterAit.组培芽诱导与增殖有显著影响,培养基中6-BA 水平差异会引起培养物细胞内的内源激素平衡差异,对植物的生长以及形态变化起到重要的调节作用[19]。6-BA 作为应用得最为广泛的外源植物生长调节剂,已成功地诱导出许多松属树种的不定芽及腋芽增殖[20-21]。松属树种不定芽诱导培养中的6-BA浓度范围一般为1~50 μmol·L-1[20-22],本试验中得到的最佳的不定芽初代诱导处理方式(WPM+6-BA 44.4 μmol·L-1,16 d)和不定芽继代增殖处理方式(WPM+6-BA 22.2 μmol·L-1,32 d)均在此范围内。植物的内源激素平衡也的确受到外源植物生长调节剂调控,进而影响细胞的分化方向及芽诱导器官发生的效应[23]。本研究高浓度 6-BA 较低浓度6-BA 对不定芽诱导促生效果更显著,马尾松成熟合子胚在6-BA 44.4 μmol·L-1中培养4 d 与在6-BA 4.4 μmol·L-1中标准培养32 d 相比,两者之间对不定芽诱导效果无显著差异,但可将诱导时长缩短4 周,这一结果与Moncaleán 等[14]的研究结果一致,原因可能是高浓度6-BA 诱导4 d 与低浓度6-BA 诱导32 d 的两种处理下能使得所培养的外植体细胞内获得类似的植物内源激素平衡环境,而内源激素水平可以决定离体组织的器官发生能力[24]。Nunes 等[10]在湿地松器官发生植株再生的研究中发现,在含有较高水平6-BA 的培养基上形成的不定芽具有较低的伸长速率,而本研究中高浓度6-BA 诱导得到的不定芽也同样发生矮小化或愈伤化现象。这表明高水平的6-BA 虽然可以促进不定芽的诱导增殖,但可能会干扰芽的正常发育,影响芽的伸长培养效果。
培养基中外源植物生长调节剂作为环境胁迫因子对所培养的外植体细胞会产生非生物胁迫效应[19],细胞分裂素类生长调节剂作用的时长会持续影响植物细胞受刺激的强度,迫使植物内源激素动态平衡发生持续性改变。本研究发现,在不定芽诱导过程中,外源激素诱导时长过短(2 d),不同6-BA 水平对不定芽诱导效果均较差,各处理间无显著性差异。Cortizo 等[15]在意大利松不定芽诱导中发现,不定芽的诱导发生与合子胚外植体对6-BA 的吸收与代谢有关,诱导期较短时合子胚外植体对6-BA 吸收率及内源代谢物含量均较低,这会导致较少的细胞分裂素受体与其结合,从而芽诱导信号的敏感性较低[25]。马尾松合子胚外植体长时间(32 d)放置在含高浓度6-BA 的培养基中易出现严重愈伤化现象,这种情况在Álvarez 等[26]和Alonso 等[8]的研究中均有发生,这表明细胞持续受到外源和内源激素信号作用会导致细胞分化加速向愈伤组织方向分化[27]。此外,Zhang等[28]的研究发现,马尾松成熟合子胚在6-BA 浓度1.0 mg·L-1(4.4 μmol·L-1)及以上时,易形成较多玻璃化的不定芽,而本研究结果显示6-BA 浓度达 到44.4 μmol·L-1且诱导时长为32 d 时,也 发生玻璃化现象,而当6-BA 浓度为4.4 μmol·L-1和11.1 μmol·L-1时均未出现此现象。这可能是由于Zhang 等[29-30]研究不定芽诱导培养时长比本试验中的诱导处理时长较长的缘故,外源植物生长调节剂长时间地持续供给是外植体形成玻璃化苗的诱发因素之一,且温度、光照和蔗糖浓度等其他因素也会影响玻璃化苗的发生。因此,在组培不定芽诱导过程中,不仅需考虑植物生长调节剂的浓度水平,也需重点关注植物生长调节剂的诱导处理时长对芽诱导数量和质量的影响。
培养基中的铵硝比(NH4+/NO3-)对植物生长形态发育具有很大的影响。本研究中,低水平的铵硝比(0.2~0.4)对马尾松茎段腋芽伸长促进效果最好,同等时间下获得最高伸长量,而高水平的铵硝比(0.8~1.0)处理却获得了最低腋芽伸长量。这可能是与培养基中的NH4+浓度有关,一般而言,NH4+浓度相对较高时,会对植物的发育产生毒害作用,抑制植物的分化及生长。在野生蔷薇Rosa canina的组织培养研究中,得出了较低NH4+浓度可以获得更好的芽增殖与伸长效果[31],与本试验结果一致;Heydari 等[32]在林荫鼠尾草Salvia nemorosa细胞悬浮培养研究也得出了与此类似的结果。培养基中适宜的铵硝比是植物在组织培养过程中获得更好生长发育的又一重要因素。马尾松属诱导生根困难型树种,不定根形成困难[33]。本研究中对照CK 处理未形成不定根,这说明添加一定的生长素类物质处理是马尾松诱导不定根形成的关键。在植物组织培养中,IBA 是生根诱导的常用植物生长调节剂,其适宜的诱导浓度因植物种类不同而不同,杜梨Pyrus betulaefolia不定芽生根组织培养的研究结果得出,适宜的IBA 浓度为0.5 mg·L-1(2.5 μmol·L-1)[34]。在矾根Heucheraspp.不定芽诱导植株再生组织培养研究中,1.0 mg·L-1(4.9 μmol·L-1)的IBA 对其不定芽生根诱导效果最佳[35]。Zhang 等[28]和Zhu 等[2]在马尾松组培生根诱导过程中,分别添加IBA 2.0 mg·L-1(9.8 μmol·L-1)时,获得了较好的生根效果,本研究中马尾松不定根诱导适宜的IBA 浓度也为9.8 μmol·L-1。本研究得到的最高生根率为45.83%,这可能与统计数据时生根处理后观察的时长有关,继续延后生根数据的统计时间,可能会得到更高的生根率。此外,植物在生根诱导过程中,除受外源激素种类及浓度调控影响外,蔗糖含量、基本培养基和光照等因素也会对植物不定根发生产生影响[36-37]。
本研究通过调节外源激素浓度及诱导时长水平,有效地提高了马尾松成熟合子胚不定芽芽诱导与腋芽增殖系数,缩短了不定芽诱导时长,这一结果对建立高效、稳定的马尾松不定芽诱导与腋芽增殖体系十分重要。但本研究仍存在一定的局限性,在马尾松茎段芽不定根诱导方面,获得的生根诱导率还不算高,这可能是因为本试验仅研究了生长素类生长调节剂IBA 浓度这一因素对其生根诱导的影响,而培养温度、培养基成分以及激素组合均起着重要的作用,因而在后续的试验中应从多种因素方面考虑生根诱导的影响因子,以提高马尾松茎段芽的不定根诱导率,完善马尾松不定芽诱导与增殖植株再生组织培养快繁体系。

