人参皂苷Rg3对H2O2诱导人卵巢颗粒细胞氧化应激损伤的保护作用
周平,裴文迪,孙异凡,于洋,金丹
卵泡作为卵巢组织中重要的内分泌和生殖相关结构,由一层或多层颗粒细胞包围的中央卵母细胞组成。颗粒细胞在卵泡生长发育过程中起到至关重要的调控作用,颗粒细胞代谢和凋亡速率变化与卵泡闭锁、卵母细胞质量下降、卵巢衰老以及多种生殖内分泌相关疾病均具有密切关系[1-3]。氧化应激是活性氧(ROS)过量产生和(或)抗氧化防御机制受损的结果,是颗粒细胞凋亡的主要原因[4]。在生理条件下,与年龄相关的ROS积累驱使颗粒细胞凋亡[5]。同时,细胞内因素(如线粒体突变、营养剥夺和局部缺血)以及外部因素(包括吸烟、空气污染、电磁辐射)产生的ROS积累会加速颗粒细胞凋亡,并导致多囊卵巢综合征、卵巢功能不全等卵巢功能障碍[2,6]。因此,寻找合适的药物修复颗粒细胞在氧化应激过程中的损伤,改善其抗氧化应激和凋亡的能力,具有重要的临床意义。人参为多年生草本植物,具有较高的药用价值。人参皂苷Rg3是从人参中分离得到的一种活性皂苷,具有广泛的药理作用,如抑制肿瘤、延缓衰老、治疗心血管疾病以及调节免疫系统,也是一种天然的抗氧化剂,能够有效清除ROS的过量累积[7-9]。本研究采用H2O2诱导人卵巢颗粒细胞(KGN)建立氧化应激损伤模型,通过细胞及分子生物学技术探讨人参皂苷Rg3对KGN氧化应激损伤的保护作用及相关作用机制。
1 材料与方法
1.1 细胞 KGN由北京大学第三医院生殖医学中心赵越老师课题组惠赠。
1.2 主要药物、试剂及仪器 人参皂苷Rg3(纯度>98%)购自成 都植标化 纯公司,DMEM/F12(11320033,Thermo Scientific),澳洲胎牛血清(10099141C,美国Gibco),BCA蛋白定量试剂盒(71285-3,北京中生华美),乳酸脱氢酶(LDH)试剂盒(A020-2-2,南京建成),DCFH-DA荧光探针ROS检测试剂盒(ab113851,Abcam),一抗抗体:β-Actin(66009-1-Ig,Proteintech,鼠抗人),细胞色素C(Cyt C,10993-1-AP,Proteintech,兔抗人),Bcl-2(ab182858,Abcam,兔抗人),BAX(ab32503,Abcam,兔抗人)。CCK-8试剂盒(C0038)、羊抗兔、兔抗鼠二抗购自北京碧云天公司。超敏ECL化学发光液(LD-8012,LDBIO)。细胞培养箱(德国Eppendorf公司);Anexxin V FITC细胞凋亡试剂盒(V13241)、多功能酶标仪(Multiskan GO)购自美国Thermo Scientific公司,全自动化学发光成像分析系统(Tanon-5200,上海天能公司);电泳、转膜装置(美国Bio-Rad公司),流式细胞仪(FACSAriaⅢ,美国BD公司)。
1.3 CCK-8法检测细胞活力 将KGN种植培养于96孔板中,参阅文献[10],采用25、50、100、200、300、400μmol/L的H2O2孵育细胞2 h,建立H2O2刺激的KGN损伤模型,并用2.5、5、10、20、40 mg/L的Rg3预孵育细胞24 h,H2O2处理细胞2 h以筛选人参皂苷Rg3的有效剂量,每孔加入CCK-8溶液(10μL/孔),37℃、5%CO2培养箱中继续孵育2 h,采用酶标仪于450 nm处检测各孔吸光度(A450)值,检测细胞活力,筛选有效的干预剂量作为后续试验的Rg3药物处理组条件。
1.4 细胞内ROS的检测 细胞接种于6孔板,分为空白组、H2O2模型组、H2O2+Rg3组和Rg3组。其中,H2O2+Rg3组和Rg3组以人参皂苷Rg3预处理24 h,随后H2O2模型组和H2O2+Rg3组加入H2O2作用2 h。空白组采用荧光探针DCFH-DA检测胞内ROS的含量,收集各组细胞,加入终浓度为20μmol/L的DCFH-DA并于37℃孵育30 min,以磷酸盐缓冲液(PBS)洗涤3次,利用流式细胞仪进行分析。
1.5 流式细胞术检测细胞凋亡比例 将KGN种植培养于6孔板中,按照1.4的分组方法处理后收集各组细胞,以预冷的PBS洗涤2次,室温下与100μL含PI(1 mg/L)的1×AnnexinⅤ工作溶液避光孵育15 min。随后加入400μL 1×结合缓冲液并迅速涡旋后,立即使用FACSAriaⅢ流式细胞仪(Becton,Dickinson and Company,CA,USA)分析细胞。
1.6 Western blot检测相关蛋白表达 收集细胞,加入哺乳动物蛋白抽提剂超声提取1 min。裂解终止后,将细胞裂解液在4℃、12 000 r/min离心15 min,收集上清液用于蛋白表达分析。采用BCA蛋白定量法确定蛋白浓度,然后用10%或12%SDS-PAGE电泳分离。电泳完毕后,将蛋白转移至PVDF膜上,脱脂奶粉室温封闭2 h。分别加入相应的一抗抗体Bcl-2(1∶2 000)、BAX(1∶5 000)、Cyt C(1∶4 000),β-actin(1∶5 000),4℃孵育过夜。TBST洗涤后,加入HRP标记的二抗,室温孵育1.5 h,TBST洗涤3次,每次15 min。显影5 min,采用化学发光法曝光,并用Gel pro软件进行条带定量分析。
1.7 统计学方法 采用软件GraphPad 5.0进行数据分析。计量资料均采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析(One-Way ANOVA),组间多重比较采用SNKq检验,P<0.05为差异有统计学意义。
2 结果
2.1 H2O2处理对细胞活力的影响 空白组及25、50、100、200、300、400μmol/L组细胞活力分别为1.00±0.03、0.92±0.05、0.75±0.07、0.68±0.08、0.47±0.02、0.48±0.02、0.48±0.01,组间比较差异有统计学意义(n=5,F=111.528,P<0.01),其中25μmol/L H2O2组与空白组比较差异无统计学意义,50、100、200、300、400μmol/L H2O2组较空白组显著降低(P<0.05)。200μmol/L H2O2可使细胞活力降低至空白组的50%左右,后续采用200μmol/L H2O2作用2 h作为造模条件。
2.2 人参皂苷Rg3预处理改善H2O2诱导的KGN细胞活力下降 空白组,H2O2模型组与H2O2+Rg3的2.5、5、10、20、40 mg/L组细胞活力分别为1.00±0.05、0.57±0.04、0.65±0.04、0.66±0.06、0.69±0.05、0.66±0.06、0.64±0.05,组间比较差异有统计学意义(n=5,F=30.063,P<0.01),与H2O2模型组比较,2.5、40 mg/L H2O2+Rg3组细胞活力差异无统计学意义(P>0.05),5、10、20 mg/L H2O2+Rg3组与模型组比较细胞活力显著升高(P<0.05)。后续的实验中使用10 mg/L人参皂苷Rg3进行干预。
2.3 人参皂苷Rg3抑制H2O2诱导的KGN细胞氧化应激 与空白组相比,H2O2模型组的细胞内ROS含量明显增加(P<0.05),人参皂苷Rg3预处理明显减少了ROS的产生(P<0.05),人参皂苷Rg3单独处理细胞对ROS水平无影响,见表1、图1。
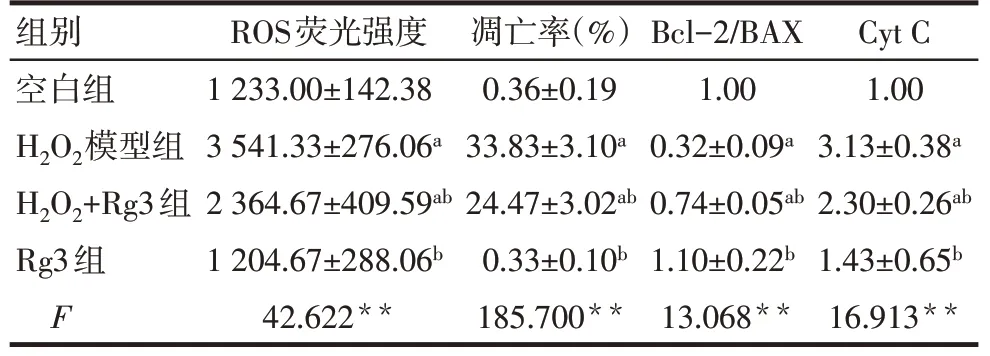
Tab.1 Comparison of ROS fluorescence intensity,apoptosis rate and expression of Bcl-2/BAX and Cyt C between the four groups of cells表1不同组间KGN细胞ROS荧光强度、凋亡率以及Bcl-2/BAX、Cyt C表达的比较(n=6,x±s)
2.4 人参皂苷Rg3抑制H2O2诱导的KGN细胞凋亡 与空白组相比,H2O2模型组细胞凋亡率显著增高,人参皂苷Rg3可显著降低H2O2诱导的细胞凋亡率,见表1、图2。
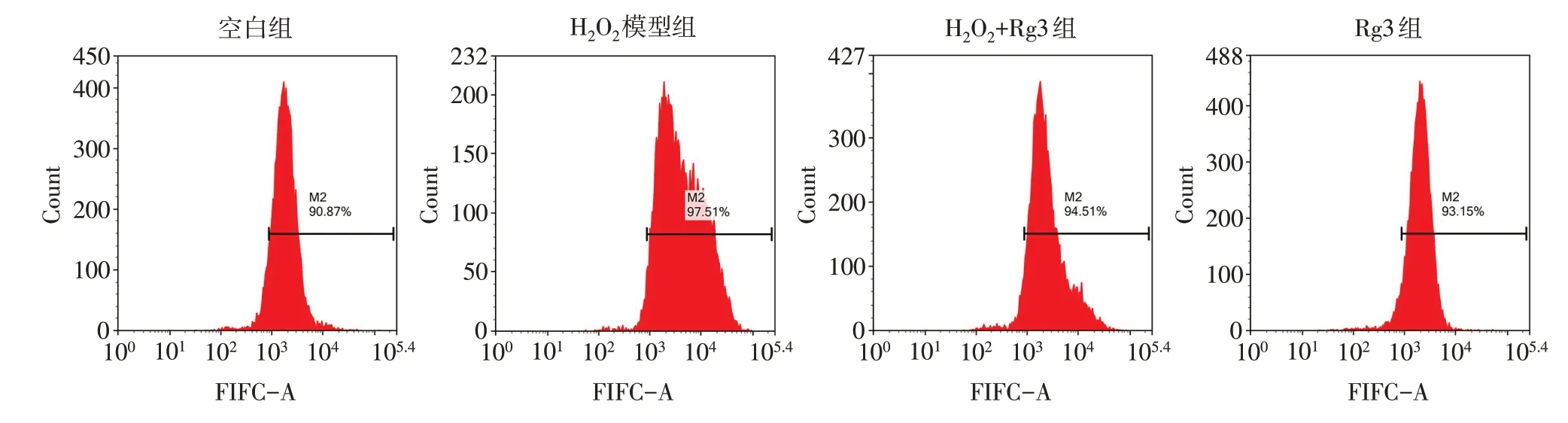
Fig.1 The effect of ginsenoside Rg3 on H2O2 induced ROS production in KGN cells图1 人参皂苷Rg3对H2O2诱导KGN细胞ROS的影响
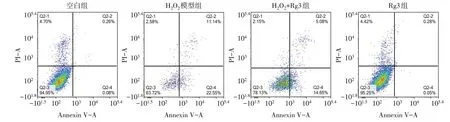
Fig.2 The effect of ginsenoside Rg3 on the apoptosis of KGN cells induced by H2O2图2 人参皂苷Rg3对H2O2诱导KGN细胞凋亡的影响
2.5 人参皂苷Rg3调控线粒体凋亡途径相关蛋白的表达 与空白组相比,H2O2模型组Cyt C表达升高,Bcl-2/BAX降低(P<0.05),而H2O2+Rg3组可逆转H2O2诱导的Cyt C上调以及Bcl-2/BAX的降低(P<0.05),见表1、图3。
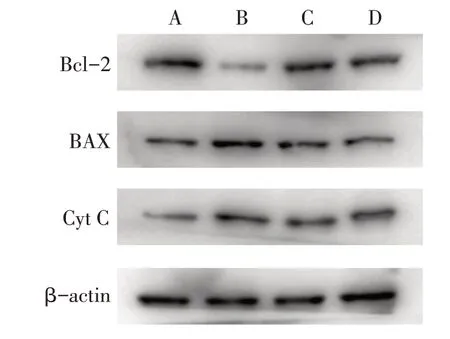
Fig.3 Expression levels of apoptosis-related proteins in the four groups图3 各组凋亡相关蛋白表达水平
3 讨论
卵泡异常闭锁可致卵巢功能障碍。颗粒细胞是卵泡的重要组成部分,颗粒细胞氧化应激诱导的凋亡可能由衰老或病理刺激触发,并在卵泡异常闭锁以及多种卵巢功能损伤中起重要作用[4,11-12]。ROS是细胞内信号转导通路的重要信号分子,但细胞内过多的ROS累积会导致细胞损伤,进而诱发细胞凋亡。卵泡颗粒细胞处于高水平代谢状态,易导致代谢产物增加,进而引发ROS的过度累积[13-14]。因此,保护颗粒细胞,避免颗粒细胞受氧化应激损伤,对于改善卵巢功能障碍,以及卵巢早衰等生殖内分泌相关疾病的治疗具有重要意义。
H2O2作为一种较强的氧化剂,极易进入细胞内,形成高活性的氧自由基或羟基自由基;H2O2产生的羟自由基可引发脂质过氧化反应,促进ROS产生;过量ROS能够攻击细胞生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并形成脂质过氧化物,导致机体内抗氧化物和氧化物生成之间的不平衡状态,诱导细胞氧化损伤,同时导致线粒体膜电位下降,进一步加剧ROS产生,形成恶性循环[15-16]。本研究通过给予不同剂量的H2O2作用2 h,筛选出200μmol/L H2O2诱导颗粒细胞的氧化应激损伤模型,结果表明,H2O2作用2 h后,ROS水平显著升高,说明颗粒细胞处于氧化应激状态;同时,细胞存活率下降,凋亡率增加,说明氧化应激抑制了细胞增殖,诱导了KGN凋亡。上述指标表明,H2O2诱导的颗粒细胞氧化应激损伤模型构建成功。
人参皂苷Rg3是从人参中分离得到的,属于人参二醇型最具代表性的单体成分之一,具有药用价值。现代药理学研究表明,人参皂苷Rg3具有调节免疫、改善心血管功能及抗肿瘤等作用[17-18]。除上述功效外,Rg3还是一种天然的抗氧化剂,能够清除过多的ROS。但是,人参皂苷Rg3能否有效抑制氧化应激所致的卵巢颗粒细胞损伤,并对卵巢功能障碍发挥治疗作用,尚未见报道。
线粒体作为活性氧产生的主要细胞器,其功能改变是介导细胞凋亡的重要途径。Bcl-2蛋白家族,特别是抗凋亡蛋白Bcl-2与促凋亡蛋白BAX的动态变化对线粒体凋亡途径起关键调控作用[19-20]。线粒体凋亡是细胞凋亡的重要途径之一,是一种由凋亡基因调控的高度保守的死亡过程。大多数凋亡信号作用于线粒体,通过改变线粒体膜的通透性,导致相关活性因子释放至胞质,进而介导线粒体及细胞的凋亡;其中Bcl-2蛋白家族和caspase家族是关键的凋亡调控基因。Bcl-2/BAX降低可导致线粒体功能障碍,并引起细胞释放大量的Cyt C;Cyt C不仅能够在线粒体呼吸中起到传递电子的作用,同时作为一个凋亡的起始因子也扮演重要角色;其能够与凋亡蛋白酶激活因子Ⅰ结合,激活下游细胞凋亡过程中关键的执行分子caspase家族蛋白的表达,启动型caspases先通过结合特异辅助因子而激活,发挥水解蛋白的作用,从而激活下游效应型caspases,其可大范围水解细胞内的靶物质,进而降解细胞内蛋白,最终诱导细胞凋亡[21-23]。在本实验中,人参皂苷Rg3(10 mg/L)预给药24 h能够明显改善H2O2诱导的KGN细胞的凋亡,减少ROS的过度产生,提高细胞Bcl-2/BAX,减少Cyt C的释放,表明其可通过改善线粒体介导的凋亡途径发挥细胞保护作用,减缓氧化应激损伤。
综上,人参皂苷Rg3可以通过调节线粒体通路相关凋亡蛋白表达,抑制H2O2诱导的颗粒细胞凋亡,提高其抗氧化应激损伤能力。Rg3可能在抗氧化损伤及维持卵巢功能稳定方面具有较好的应用前景,本研究为进一步开展体内研究奠定了实验基础。

