表儿茶素对大鼠脑缺血再灌注损伤的保护作用及抗氧化能力的影响
黄凡,胡婉湘,蒋嫦月,李德丽,谢露
脑缺血再灌注损伤(cerebral ischemia reperfu‑sion injury,CIRI)是指脑缺血一定时间恢复血液供应后,大脑功能不仅没有得到及时恢复,反而出现更加严重的脑神经功能障碍[1-3],此过程涉及氧化应激、炎症反应、神经元凋亡等多种机制。氧化应激不仅能通过活性氧过度积累直接造成细胞损伤,还能激活其他信号通路而间接造成细胞损伤。因此,如何改善机体的抗氧化能力是当前研究的一个重要方向。表儿茶素(Epicatechin,EC)是从茶多酚中分离出的单体化合物,具有抗氧化、降血压、降血脂等作用[4]。已有研究表明其衍生物表儿茶素没食子酸酯对脑、心脏、骨骼肌缺血损伤具有保护作用[5-7],但EC对CIRI影响方面的报道较少。本研究旨在观察EC对大鼠CIRI后的保护作用及抗氧化能力,以期为临床研究提供理论依据。
1 材料与方法
1.1 实验动物 雄性清洁级SD大鼠90只,体质量200~240 g,购自广西医科大学实验动物中心,动物许可证号SCXK(桂)2020-0003,于(23±2)℃环境下定时喂养,自由饮水。实验中的所有操作均符合广西医科大学实验动物福利与伦理委员会的相关要求。
1.2 主要试剂与仪器 EC购自索莱宝公司,纯度≥98.0%;2,3,5-氯化三苯基四氮唑(TTC)购自Biosharp公司,高效液相色谱测定纯度≥98.0%;BCA蛋白浓度测定试剂盒、丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)活性检测试剂盒、谷胱甘肽过氧化物酶(GPx)检测试剂盒均购自碧云天生物技术有限公司。
1.3 分组与造模 将90只大鼠按随机数字表法分为6组,每组15只,分别为假手术组(Sham组)、CIRI模型组(I/R组)、EC 5 mg/kg组、EC 10 mg/kg组、EC 20 mg/kg组、依达拉奉(ED)3 mg/kg组。适应性喂养1周后,除Sham组外,其余组采用线栓法制备大脑中动脉栓塞(MCAO)模型[8]。大鼠经2%戊巴比妥钠(50 mg/kg)麻醉后,仰卧位固定于手术板上,颈部去毛,消毒,纵向切开颈部正中皮肤,逐层钝性分离颈总动脉、颈内动脉、颈外动脉,结扎颈外动脉,在颈总动脉上距离颈内动脉交叉5 mm处造口,插入线栓,至有微弱阻力时停止,扎紧线栓以防止滑落,缝合伤口,缺血后2 h拔栓,恢复血流供应;Sham组相同处理但不进行结扎、造口和插栓操作。各组术后于(23±2)℃条件下喂养,正常饮食进水。
1.4 给药 EC 5 mg/kg组、EC 10 mg/kg组、EC 20 mg/kg组、ED 3 mg/kg组分别于再灌注后0、12、24 h腹腔注射相应剂量的EC或ED,Sham组和I/R组注射同容积的生理盐水。
1.5 神经功能损伤评分 利用Longa 5分法[9]分别于术后12、24 h进行神经功能损伤评分。0分:无神经功能损伤症状;1分:未能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失。分值越高,说明大鼠神经功能行为学损伤越严重。
1.6 缺血侧脑梗死面积百分比测定 采用TTC染色法检测大鼠脑梗死面积百分比。于再灌注后36 h取大鼠脑组织,置于-20℃冰箱冷冻15 min,去除嗅球、脑干等多余部位,沿冠状面切成2 mm厚的脑片,切片放入37℃的2%TTC溶液中孵育15 min,每5 min翻动1次。取出后置于10%福尔马林溶液中避光过夜。拍照并采用Image J软件计算脑梗死面积,缺血侧脑梗死面积百分比=梗死区面积/缺血侧脑面积×100%。
1.7 缺血侧脑组织形态学观察 采用HE染色法观察缺血侧脑组织形态。于再灌注后36 h取大鼠脑组织,甲醛固定,石蜡包埋,切片,按照HE染液说明书进行染色,在病理显微镜下拍照。
1.8 血清及缺血侧脑组织中MDA、SOD、GPx检测 采用比色法将再灌注后36 h获取的血清和缺血侧脑组织按照试剂盒说明书测定其MDA含量、SOD和GPx活力。
1.9 统计学方法 采用SPSS 22.0软件对实验数据进行统计分析,计量资料以均数±标准差(x ±s)表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 EC对大鼠CIRI后神经功能行为学评分的影响 与Sham组比较,I/R组神经功能损伤评分升高(P<0.05);与I/R组比较,EC 10 mg/kg组、EC 20 mg/kg组、ED 3 mg/kg组神经功能损伤评分降低(P<0.05),EC 5 mg/kg组无明显差异;与EC 5 mg/kg组比较,EC 20 mg/kg组、ED 3 mg/kg组神经功能评分降低(P<0.05),EC 10 mg/kg组无明显差异,见表1。
2.2 EC对大鼠CIRI后缺血侧脑梗死面积百分比的影响 与Sham组比较,I/R组脑梗死面积百分比增大(P<0.05);与I/R组、EC 5 mg/kg组比较,EC 10 mg/kg组、EC 20 mg/kg组、ED 3 mg/kg组减少(P<0.05),I/R组与EC 5 mg/kg组比较差异无统计学意义(P>0.05),见图1、表1。

Fig.1 Cerebral infarction of rats in six groups(n=5)图1 各组大鼠脑组织梗死情况(n=5)

Tab.1 Comparison of the neurological function scores and the percentage of cerebral infarction area in ischemic side of rats between six groups表1 各组大鼠神经功能评分及缺血侧脑梗死面积百分比比较 (x±s)
2.3 EC对大鼠CIRI后缺血侧脑组织形态学变化的影响 Sham组细胞数量较多,排列紧密,形态圆润且轮廓清晰,核仁居中。与Sham组比较,I/R组细胞数量减少,排列疏散,细胞形态不规则,部分发生核固缩,存在病理损伤;与I/R组比较,EC各组、ED 3 mg/kg组细胞数量明显增加且形态规则,核质间隙明显;与EC 5 mg/kg组比较,EC 10 mg/kg组、EC 20 mg/kg组、ED 3 mg/kg组改善更为明显,见图2。
2.4 EC对大鼠CIRI后缺血侧脑组织中MDA含量、SOD和GPx活力的影响 与Sham组比较,I/R组脑组织中MDA含量增多、SOD和GPx活力下降(P<0.05);与I/R组比较,EC 10 mg/kg组、EC 20 mg/kg组、ED 3 mg/kg组脑组织中MDA含量减少、SOD和GPx活力升高(P<0.05),EC 5 mg/kg组SOD活力升高;与EC 5 mg/kg组比较,EC 10 mg/kg组、EC 20 mg/kg组、ED 3 mg/kg组脑组织中MDA含量减少、SOD活力升高(P<0.05),EC 20 mg/kg组和ED 3 mg/kg组脑组织中GPx活力升高(P<0.05),见表2。

Tab.2 Comparison of the content of MDA,activity of SOD and GPx in ischemic brain tissue between six groups表2 各组大鼠缺血侧脑组织中MDA含量、SOD和GPx活力比较 (n=8,x±s)
2.5 EC对大鼠CIRI后血清中MDA水平、SOD活力的影响 与Sham组比较,I/R组血清中MDA含量增多、SOD活力下降(P<0.05);与I/R组、EC 5 mg/kg组比较,EC 10 mg/kg组、EC 20 mg/kg组、ED 3 mg/kg组血清中MDA含量减少、SOD活力升高(P<0.05),I/R组与EC 5 mg/kg组间差异无统计学意义(P>0.05),见表3。
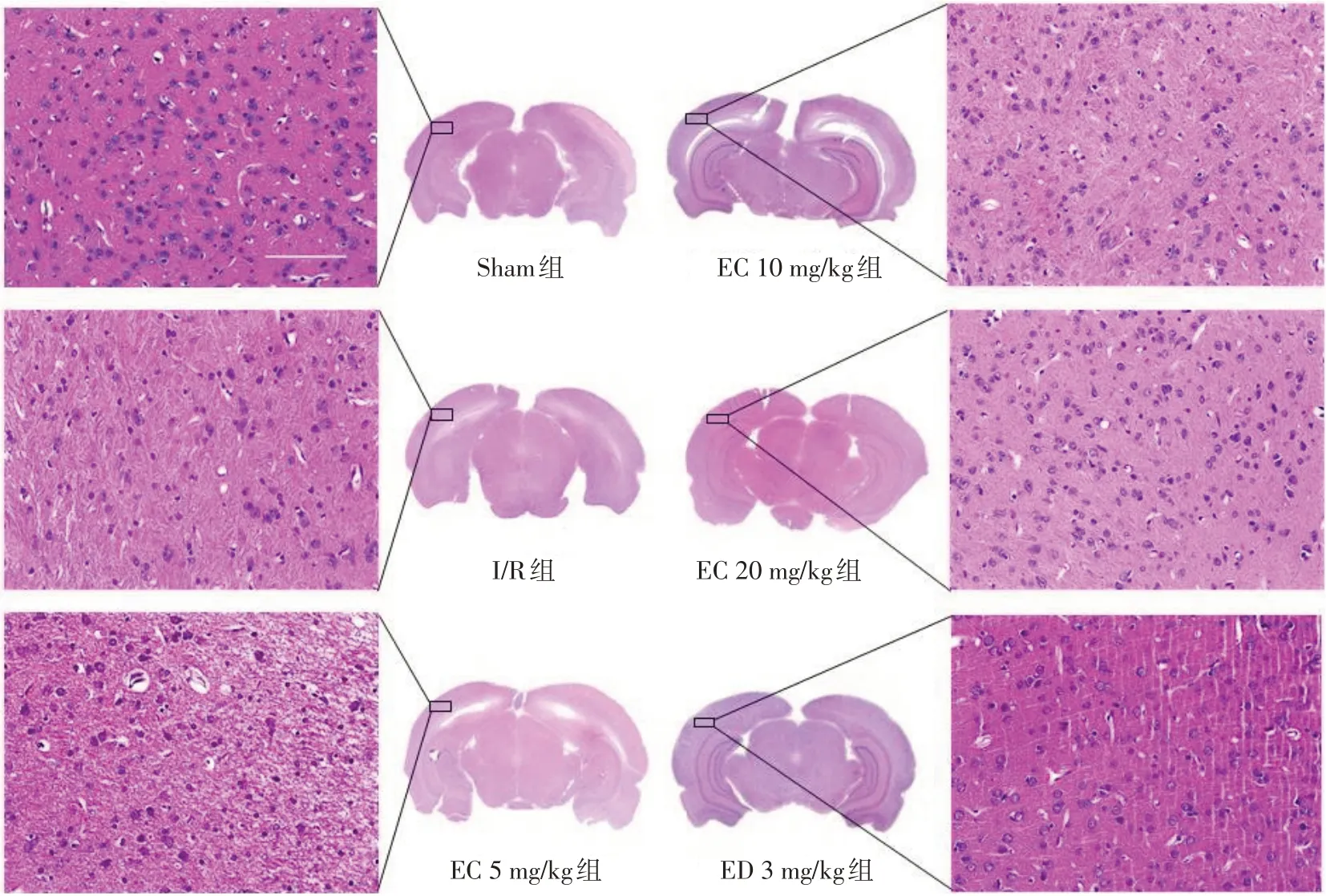
Fig.2 Morphological observation of cerebral cortex on ischemic side of rats in six groups(HE,×400,n=3)图2 各组大鼠缺血侧脑组织皮质部分形态学观察(HE,×400,n=3)

Tab.3 Comparison of the serum content of MDA and the activity of SOD between six groups of rats表3各组大鼠血清中MDA含量、SOD活力比较(n=8,x±s)
3 讨论
缺血再灌注会对机体造成严重的损害,而脑作为对缺血缺氧高度敏感的组织,CIRI更为严重,因此研究改善CIRI的药物尤其重要。
研究表明,在大鼠急性脑出血模型中,绿茶多酚可降低神经功能损伤评分,改善脑组织病理损伤,从而对脑出血后的脑组织发挥保护作用[10]。另有研究表明,口服EC能通过减轻神经功能损伤,减小病变体积,改善小鼠创伤性脑损伤[11]。本研究采用线栓法制备大鼠MCAO模型,结果显示,EC各组和ED组神经功能损伤评分、缺血侧脑组织梗死面积百分比、缺血侧脑组织皮质区形态均较I/R组明显改善,表明EC对大鼠CIRI具有保护作用,且呈一定的剂量依赖性,与Chang等[12]的研究结果一致。
氧化应激是缺血再灌注损伤的核心病理环节,活性氧的过度生成、SOD和GPx等抗氧化酶的过度消耗是氧化应激损伤的根本原因。过度产生的活性氧攻击不饱和脂肪酸,从而破坏细胞膜并对核酸造成损伤,引发DNA的断裂,促使细胞凋亡。MDA是脂质过氧化的终产物,当发生氧化应激时,MDA含量升高,进一步加重氧化应激损伤,因此MDA可间接反映氧化应激损伤的程度[13]。SOD是重要的内源性抗氧化酶,能够减轻氧自由基引起的脑损伤[14]。GPx是体内的氧自由基清除酶,可反映体内脂质过氧化程度和清除自由基的能力[15]。当SOD、GPx在氧化应激损伤过程中被过度消耗时,机体的抗氧化能力减弱,同时使得机体中MDA合成增加,从而加重损伤。
EC是从茶多酚中分离出的一种具有抗氧化活性且能透过血脑屏障的天然成分。本课题组此前研究发现,在高糖高脂诱导的H9C2细胞模型中,EC预处理可使细胞中还原型谷胱甘肽(GSH)含量及SOD活性升高,对心肌细胞发挥保护作用,同时在大鼠心脏骤停/心肺复苏模型中,茶多酚可提高脑组织内源性抗氧化酶SOD1和SOD2的表达[16-17],提示EC在CIRI中发挥抗氧化效应,具有治疗脑卒中的潜在价值。ED是一种抗氧化剂,临床上常用于治疗脑卒中,因此作为本研究中的阳性对照药。本研究发现,EC和ED用药组缺血侧脑组织和血清中MDA含量降低,抗氧化酶SOD和GPx的活力增强,表明EC可减少氧自由基的生成,同时提高机体自由基清除能力,且呈一定的剂量依赖性,与Al-Maghrebi等[18]的研究结果一致。
综上所述,EC可明显降低CIRI大鼠神经功能损伤评分,减少缺血侧脑组织梗死面积,改善脑组织病理学损伤,降低血清和缺血侧脑组织中的MDA含量并增强SOD活力,同时增强脑组织中的GPx活力,表明表儿茶素可提高脑抗氧化水平,从而对抗大鼠脑缺血再灌注损伤,且在一定范围内呈剂量依赖性。今后将深入研究EC发挥脑保护作用的分子机制,进一步为其应用于临床治疗缺血性脑卒中提供理论基础。

