葛根总皂苷调控NAMPT-Sirt1轴诱导BMSCs向髓核样细胞分化
岳宗进,刘汝银,于露,王新立,冯仲锴,王西彬
中老年人椎间盘退变加重常引起腰痛和下肢疼痛,甚至引起尿便失禁及其他功能障碍。椎间盘退变的典型症状是髓核细胞数目减少、椎间盘内细胞外基质减少、终板软骨钙化等[1]。其主要治疗方法包括基因治疗、细胞因子治疗、细胞或髓核移植及组织工程技术等[2-3],但这些方法均无法恢复脊柱的原有解剖结构,甚至造成相邻椎间盘的病变。随着干细胞治疗研究的深入,诱导干细胞分化成髓核细胞修复椎间盘有望成为一种新治疗手段,但是其调控机制尚不清楚。葛根属于豆科植物,具有促进人体新陈代谢、提高肝脏解毒能力的功效。葛根中的三萜及皂苷类化合物主要为齐墩果烷型,主要有黄豆皂苷元A、B,葛根皂苷元A、B、C等。药理实验证明葛根总皂苷(total saponins of pueraria lobata,TSPL)可改善小鼠免疫性肝损伤[4]。目前有关TSPL促进软骨细胞增殖的研究鲜有报道。本研究旨在探讨TSPL对骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)定向分化成髓核样细胞的调控作用及机制,为TSPL改善椎间盘退变提供实验基础。
1 材料与方法
1.1 材料
1.1.1 细胞和动物 大鼠BMSCs(Cat NO.RBM-005F)购自美国ALLCELLS公司。SPF级雄性SD大鼠32只,体质量(230±13)g,由河南省中医院(河南中医药大学第二附属医院)实验动物中心提供,动物生产许可证号SYXK(豫)2017-0012。饲养条件:温度为25℃,相对湿度为50%~70%,保持动物房环境及鼠笼清洁、透气,自然光照,自由进食和饮水。大鼠适应性喂养1周后进行实验。所有动物实验均经河南省中医院实验动物伦理委员会批准(批准文号Z1.0/612)。
1.1.2 试剂 DMEM/F12培养基、0.25%胰蛋白酶(含EDTA)、Ⅱ型胶原蛋白酶、Alcian Blue、DMEM培养基(高糖)、胎牛血清(Sigma公司);二甲基亚甲基蓝(DMMB)比色法定量检测试剂盒(上海赫澎生物公司);引物合成(上海生工生物公司);Trizol(美国Invitrogen公司);反转录试剂盒、实时荧光PCR(qPCR)试剂(大连TaKaRa公司);总蛋白提取试剂盒、Prestained Protein Ladder(Thermo Fisher Scientific公司);Lipo‑fectamineTM2000转染试剂(美国Invitrogen公司);兔抗COL2A1多克隆抗体(货号:ab34712)、兔抗Aggrecan单克隆抗体(Aggrecan,货号:ab186414)、兔抗Sox9单克隆抗体(货号:ab185230)、兔抗Tie2单克隆抗体(货号:ab221154)、兔抗Sirt1单克隆抗体(货号:ab189494)、山羊抗兔IgG(货号:ab205718)和过氧化物酶(HRP)购自英国Abcam公司;烟酰胺腺嘌呤二核苷酸(NAD+)/NADH检测试剂盒(Biovision公司);腺苷三磷酸(ATP)检测试剂盒(北京索莱宝公司);烟酰胺单核苷酸(NMN)和烟酰胺磷酸核糖转移酶(NAMPT)抑制剂FK866(北京福珺生物科技有限公司);沉默交配型信息调节2同系物1(Sirt1)检测试剂盒(美国Invitrogen公司);细胞增殖检测试剂盒(CCK-8,北京百泰克生物公司);去离子水设备Milli-Q水纯化系统(美国Millipore公司);SRT2104试剂(上海普迈生物科技有限公司)。
1.1.3 仪器 细胞培养箱、酶标仪、凝胶成像系统(iBright)购自美国Thermo Fisher Scientific公司;qPCR仪(型号:ABI-7300)购自美国ABI公司;蛋白免疫印迹电泳系统(型号1659001)购自美国Bio-Rad公司;紫外/可见分光光度计(型号752)购自上海光谱仪器有限公司;倒置电子显微镜(型号FM-500)购自上海普丹光学仪器有限公司。
1.2 方法
1.2.1 建立大鼠腰椎间盘退变模型 采用随机数字表法将大鼠分为假手术组、模型组、30 mg/kg TSPL治疗组和50 mg/kg TSPL治疗组,每组8只。腹腔注射6.5%水合氯醛麻醉大鼠,取俯卧位,固定四肢,腰背部备皮,沿腰背部棘突做后正中切口。切开皮肤后,沿骨膜下剥离,咬骨钳去除以L3为中心的L1~S1的棘突、关节突和棘上及棘间韧带,切断双侧竖棘肌,逐层缝合皮下筋膜、皮肤。假手术组仅切开皮肤,然后进行缝合,处理结束后将大鼠放入单独笼中饲养。治疗组大鼠分别给予30、50 mg/(kg·d)TSPL灌胃治疗,假手术组和模型组大鼠给予等量生理盐水灌胃。饲喂8周后,处死大鼠,显微镜下采集大鼠L5~S1椎间盘组织。
1.2.2 TSPL的提取 采用乙醇热回流及大孔吸附树脂方法提取制备葛根总皂苷[3],含量>50%。称取葛根饮片1 kg(广州中医药大学大药房有限公司,批号:20100319),碾碎后,加入75%乙醇,水浴加热回流提取3次后,浓缩收集提取液,称质量。然后,大孔吸附树脂为固态相,分别用水和不同梯度(30%、40%、50%、60%和70%)乙醇进行洗脱,浓缩收集洗脱液,再次称质量。最后,将TSPL样品溶解于去离子水,质量浓度为2 g/L,去离子水作为参照组。采用分光光度计于400~800 nm处测定TSPL的吸光度。
1.2.3 BMSCs的培养和处理 取生长状况良好的大鼠BMSCs,使用含10%胎牛血清、100 mg/L链霉素、100 U/mL青霉素的DMEM/F12培养液,在37℃、5%CO2饱和湿度的培养箱中培养。当细胞融合度达80%时按1∶3传代,选取第3代细胞,胰酶消化后,调整细胞浓度为1×109/L,接种于6孔板中。体外实验分为:(1)BMSCs组,给予生理盐水处理。(2)BMSCs-TSPL组,分别给予不同剂量(10、20、30、40、50μmol/L)TSPL处理。(3)BMSCs-TSPL-FK866组,分别给予30μmol/L TSPL和2.5μmol/L FK866处理。(4)BMSCs-TSPL-SRT2104组,分别给予30μmol/L TSPL和10μmol/L SRT2104处理。
1.2.4 DMMB比色法检测糖胺聚糖含量 分别取各组大鼠L5~S1椎间盘组织0.5 g,加入1 mL HEPENGBIO清理液清洗1次,匀浆器研磨成匀浆,置于离心管中,加入5 mL HEPENGBIO萃取液,漩涡震荡后,分别在56℃恒温水槽中孵育16 h,90℃恒温水槽中孵育10 h。离心后取50μL上清液,加入0.1 mL HEPENGBIO染色液,室温孵育30 min后,离心弃上清液,加入0.1 mL HEPENGBIO解离液,震荡后转移到比色皿中,在656 nm处用分光光度计检测吸光度值,根据标准曲线获得样品对应的糖胺聚糖含量。细胞实验中,收集第1、4、7、10、14天的细胞,通过高盐萃取细胞中可溶性糖胺聚糖,与DMMB染料结合,在丙醇解离溶液中,产生不溶性紫色或粉红色糖胺聚糖染料复合物释放出染料,分光光度计于656 nm处定量分析糖胺聚糖的含量,操作步骤同组织测定。
1.2.5 CCK-8法测定髓核样细胞增殖情况 按照CCK-8试剂盒检测各组细胞的增殖情况。将经过不同处理的细胞以1.5×104/孔的密度接种于96孔培养板中。孵育24、48和72 h后,丢弃上清液,并向每孔中添加10μL CCK-8溶液。37℃孵育2 h后,酶标仪检测450 nm处的吸光度值。
1.2.6 qPCR检测髓核样细胞中COL2A1、Aggrecan、Sox9、Tie2和Sirt 1mRNA水平 细胞诱导成熟后,用Trizol试剂盒提取细胞中总RNA。测定RNA浓度后,将RNA反转录成cDNA,以cDNA作为模板进行qPCR反应,根据试剂盒要求进行定量分析。反应体系:10×Taq bufffer 2.5μL,dNTP mix 2.5μL,上下游引物各1μL,cDNA模板1μL,RNase-free water补足至25μL。反应条件如下:95℃5 min;94℃15 s,54℃30 s,72℃20 s,共35个循环。以GAPDH为内参,基因引物序列见表1。采用2-ΔΔCt法计算各基因mRNA相对表达量。
1.2.7 Western blot测定COL2A1、Aggrecan、Sox9、Tie2和Sirt1蛋白的表达 细胞培养14 d后,使用RIPA裂解液提取细胞中的总蛋白,并溶解于SDS蛋白上样缓冲液中。每组取40μg上样蛋白,等量蛋白经10%聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶分离后,转至PVDF膜上。用5%牛血清白蛋白(BSA)室温封闭1 h,TSBT清洗后,加入兔抗COL2A1多克隆抗体(稀释比例1∶300),兔抗Aggrecan单克隆抗体(稀释比例1∶300),兔抗Sox9单克隆(稀释比例1∶500),兔抗Tie2单克隆抗体(稀释比例1∶200)和兔抗Sirt1单克隆抗体(稀释比例1∶100)于4℃冰箱中孵育过夜,经TBST漂洗后,与HRP标记的山羊抗兔IgG抗体(稀释比例1∶1 000)室温孵育1 h,以GAPDH为内参。采用增强化学发光法显色,用凝胶成像仪观察条带并拍照,并用Image J软件对蛋白进行定量分析。
1.2.8 WST-8法检测各组骨髓间充质干细胞中NAD+水平 诱导培养14 d后,收集各组细胞,根据NAD+/NADH测定试剂盒的步骤进行操作,制作标准曲线后,计算NAD+的水平。
1.2.9 酶联免疫吸附试验(ELISA)检测骨髓间充质干细胞中ATP水平及髓核样细胞的NAMPT水平 用离心管离心沉淀细胞,弃上清液,然后加入裂解液裂解细胞后,在4℃,12 000×g条件下离心10 min,取上清液,按照ATP试剂盒说明书检测ATP水平。按照ELISA试剂盒说明检测各处理组细胞中NAMPT水平,用酶标仪检测450 nm处吸光度,绘制标准曲线并计算NAMPT水平。

Tab.1 Primers for qPCR表1 qPCR引物序列
1.3 统计学方法 采用SPSS 19.0软件进行数据处理,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验;不同时点多组间比较采用重复测量设计的方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 椎间盘组织和BMSCs中糖胺聚糖含量比较 体内实验结果显示,假手术组、模型组和30、50 mg/kg TSPL治疗组椎间盘组织中糖胺聚糖含量(ng/g)分别为2.66±0.22、1.37±0.05、2.01±0.07和2.42±0.17,差异有统计学意义(F=3 694.896,P<0.05)。其中模型组低于假手术组,30、50 mg/kg TSPL治疗组高于模型组,且50 mg/kg TSPL治疗组高于30 mg/kg TSPL治疗组(P<0.05)。
体外实验结果显示,BMSCs组和不同剂量TSPL组细胞中糖胺聚糖含量随处理时间的延长呈增高趋势(P<0.05)。除处理1 d时各组细胞中糖胺聚糖含量差异无统计学意义外,其余各时点TSPL各组糖胺聚糖含量均高于BMSCs组,10、20、30μmol/L TSPL组糖胺聚糖含量依次升高,40、50μmol/L TSPL组糖胺聚糖含量逐渐降低,见表2。故后续实验选择30μmol/L TSPL处理细胞。
不同处理组细胞中糖胺聚糖含量随处理时间的延长呈增高趋势(P<0.05)。处理1 d时,各组细胞中糖胺聚糖含量差异无统计学意义(P>0.05);其余各时点,与BMSCs组比较,BMSCs-TSPL组、BMSCs-TSPL-SRT2104组糖胺聚糖含量均增高(P<0.05),BMSCs-TSPL-FK866组差异无统计学意义(P>0.05);与BMSCs-TSPL组比较,BMSCs-TSPL-FK866组糖胺聚糖含量降低,BMSCs-TSPL-SRT2104组糖胺聚糖含量增高;与BMSCs-TSPL-FK866组比较,BMSCs-TSPL-SRT2104组糖胺聚糖含量明显增高(P<0.05),见表3。
2.2 不同处理组BMSCs向髓核样细胞分化情况比较 BMSCs组细胞贴壁后逐渐显现出梭形、纺锤形;与BMSCs组比较,TSPL单独或联合SRT2014处理后的BMSCs细胞形态由梭形向多角形转变,核周颗粒明显,细胞表型接近髓核样细胞;与BMSCs-TSPL组比较,BMSCs-TSPL-FK866组BMSCs分化程度减少,而BMSCs-TSPL-SRT2014组促进BMSCs向髓核样细胞分化,见图1。
2.3 不同处理组BMSCs细胞增殖能力比较 不同处理组细胞增殖能力随处理时间的延长呈增强趋势(P<0.05)。处理0 h时,各组细胞增殖能力差异无统计学意义(P>0.05);处理24 h时,BMSCs-TSPL组和BMSCs-TSPL-SRT2104组细胞增殖能力强于BMSCs组;处理48、72 h时,与BMSCs组相比,BMSCs-TSPL组和BMSCs-TSPL-SRT2104组细胞增殖能力增强;与BMSCs-TSPL组相比,BMSCs-TSPLFK866组细胞增殖能力减弱,BMSCs-TSPLSRT2104组细胞增殖能力增强;BMSCs-TSPLSRT2104组细胞增殖能力较BMSCs-TSPL-FK866组增强(P<0.05),见表4。
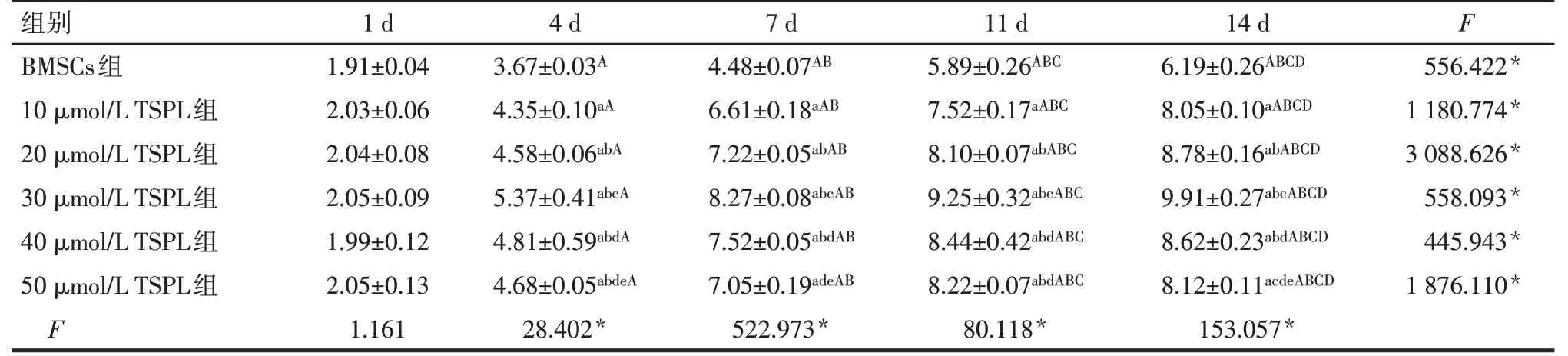
Tab.2 Comparison of glycosaminoglycan contents in cells between the six treatment groups表2 BMSCs组和不同剂量TSPL组细胞各时点的糖胺聚糖含量比较 (n=4,mg/L,x±s)

Tab.3 Comparison of glycosaminoglycan contents between the four different treatment groups of cells表3 不同处理组细胞各时点的糖胺聚糖含量比较 (n=4,mg/L,x±s)
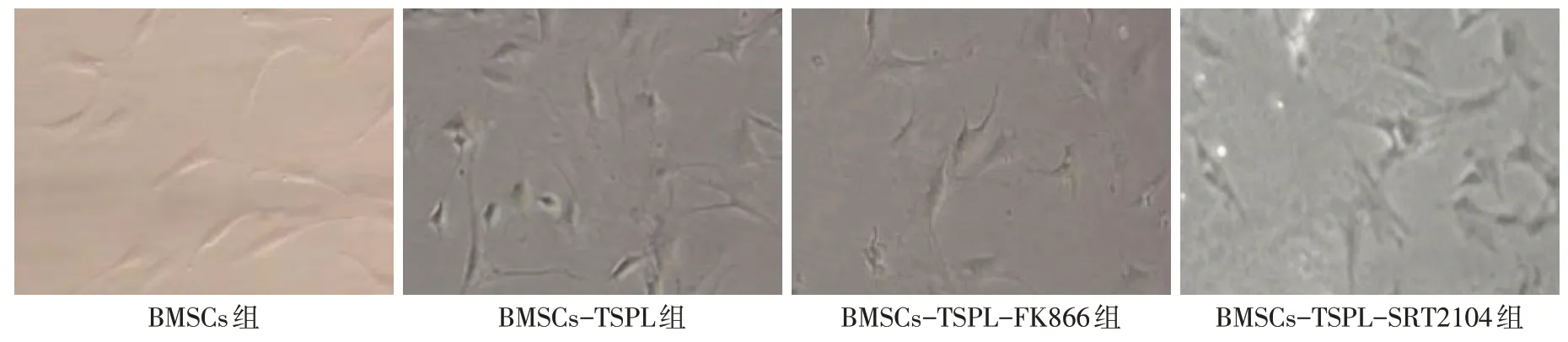
Fig.1 Cytographic view of BMSCs differentiated into nucleus pulposus like cells(×100)图1 BMSCs向髓核样细胞分化的细胞图(×100)
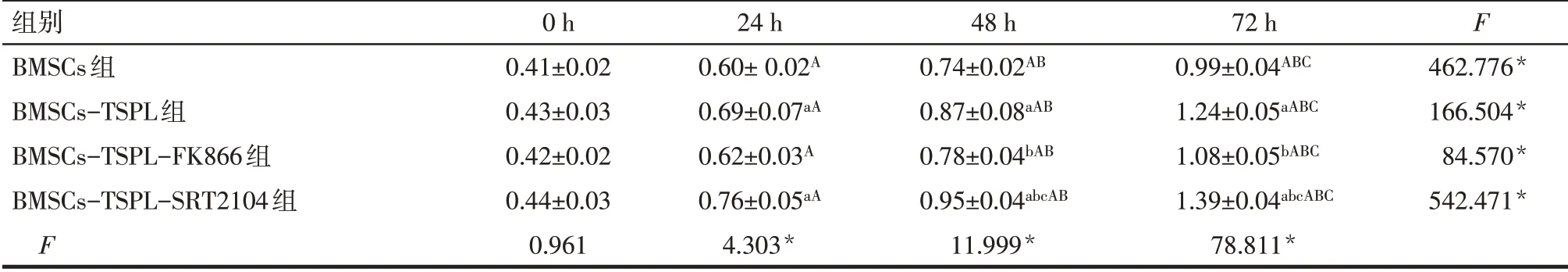
Tab.4 Comparison of cell proliferation between the four different treatment groups表4 不同处理组细胞增殖情况的比较 (n=4,x±s)
2.4 不同处理组BMSCs中COL2A1、Aggrecan、SOX9和Tie2mRNA表达 qPCR结果显示,与BMSCs组相比,BMSCs-TSPL组和BMSCs-TSPL-SRT2104组COL2A1、Aggrecan和Sox9mRNA表达水平升高,Tie2mRNA表达水平降低(P<0.05);与BMSCs-TSPL组相比,BMSCs-TSPL-FK866组COL 2A1、Aggrecan和Sox9mRNA表达水平降低,Tie2mRNA表达水平升高(P<0.05);与BMSCs-TSPL-FK866组比较,BMSCs-TSPL-SRT2104组COL2A1、Aggrecan和Sox9mRNA表达水平升高,Tie2mRNA表达水平降低(P<0.05),见表5。
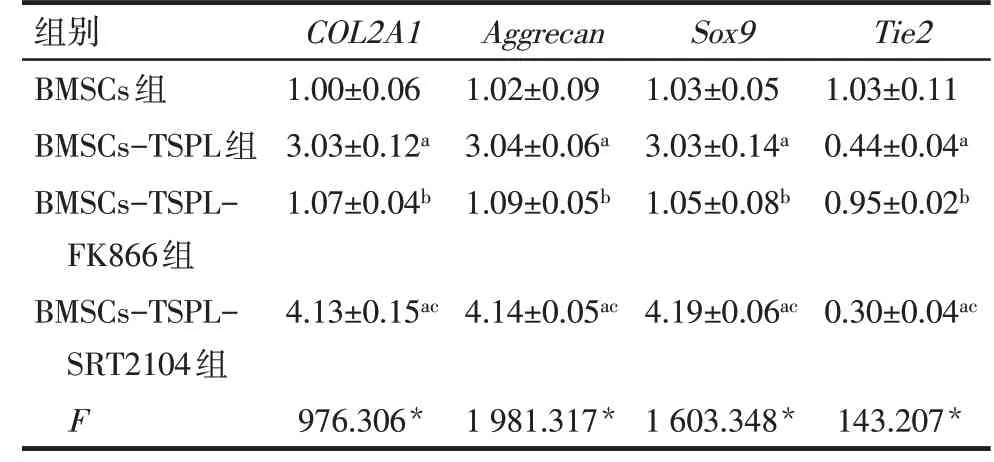
Tab.5 Comparison of mRNA levels of COL2A1,Aggrecan,SOX9 and Tie2 in BMSCs between the four different treatment groups表5 不同处理组COL2A1、Aggrecan、SOX9和Tie2 mRNA表达比较 (n=4,x±s)
2.5 不同处理组BMSCs中COL2A1、Aggrecan、SOX9和Tie2蛋白表达 Western blot结果显示,与BMSCs组相比,BMSCs-TSPL组和BMSCs-TSPL-SRT2104组COL2A1、Aggrecan和Sox9蛋白表达水平升高,Tie2蛋白表达水平降低(P<0.05);与BMSCs-TSPL组相比,BMSCs-TSPL-FK866组COL2A1、Aggrecan和Sox9蛋白表达水平降低,Tie2蛋白表达水平升高(P<0.05);与BMSCs-TSPL-FK866组比较,BMSCs-TSPL-SRT2104组COL2A1、Aggrecan和Sox9蛋白表达水平升高,Tie2蛋白表达水平降低(P<0.05),见图2、表6。
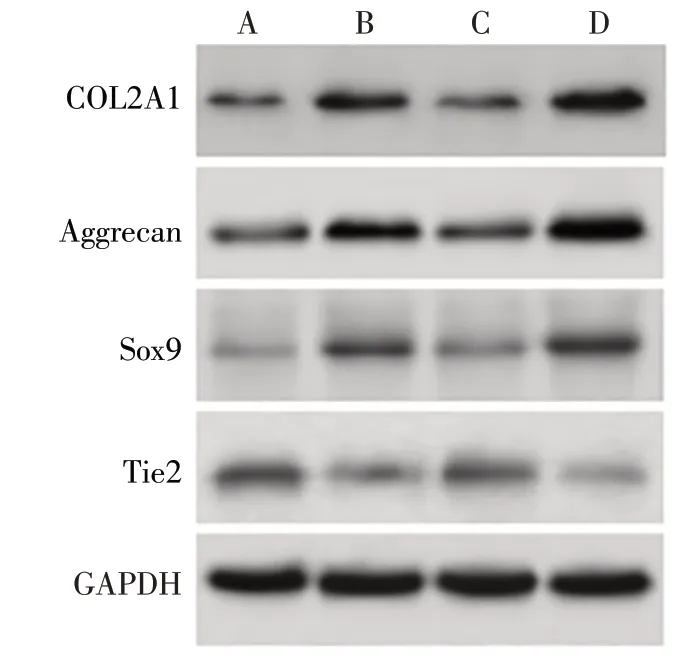
Fig.2 COL2A1,Aggrecan,Sox9 and Tie2 protein levels in TSPL-treated BMSCs图2 Western blot检测各组COL2A1、Aggrecan、SOX9和Tie2蛋白表达
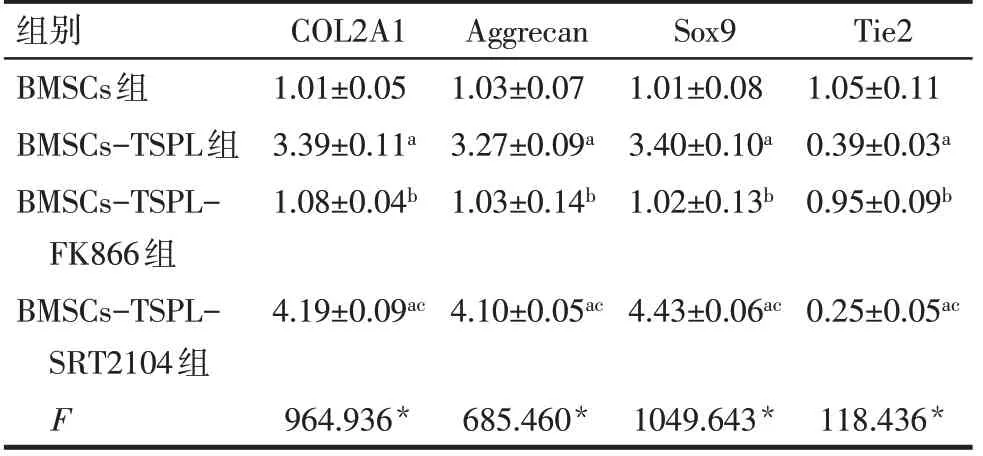
Tab.6 Comparison of protein levels of genes in nucleus pulposus-like cells between the four different treatment groups表6 不同处理组COL2A1、Aggrecan、SOX9和Tie2蛋白表达比较 (n=4,x±s)
2.6 不同处理组BMSCs中NAD+、ATP和NAMPT水平 ELISA结果显示,与BMSCs组相比,BMSCs-TSPL组和BMSCs-TSPL-SRT2104组BMSCs中NAD+、ATP和NAMPT水平升高(P<0.05);与BMSCs-TSPL组相比,BMSCs-TSPL-FK866组BMSCs中NAD+、ATP和NAMPT水平降低(P<0.05);与BMSCs-TSPL-FK866组 比 较,BMSCs-TSPL-SRT2104组BMSCs中NAD+、ATP和NAMPT水平升高(P<0.05),见表7。
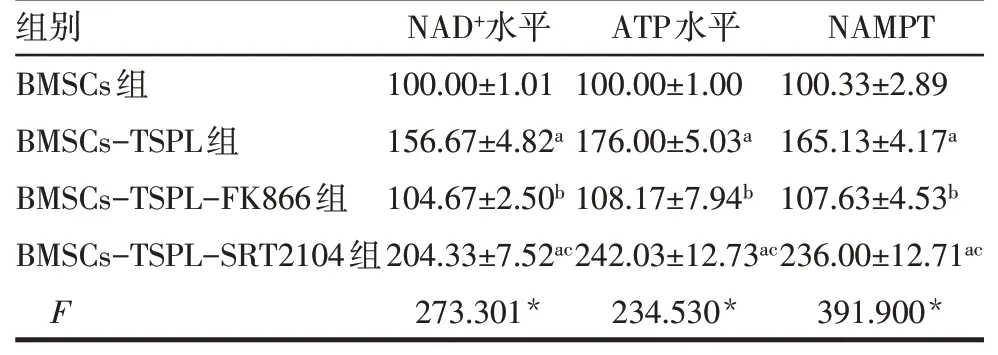
Tab.7 Comparison of the levels of NAD+,ATP and NAMPT in BMSCs between the four different treatment groups表7不同处理组BMSCs中NAD+、ATP和NAMPT相对水平的比较 (n=4,x±s)
2.7 不同处理组BMSCs中Sirt1 mRNA和蛋白的表达 与BMSCs组相比,TSPL单独或联合SRT2104处理显著上调BMSCs中Sirt1 mRNA和蛋白表达水平(P<0.05);与BMSCs-TSPL组相比,BMSCs-TSPLFK866组细胞中Sirt1 mRNA和蛋白表达水平下调(P<0.05),而BMSCs-TSPL-SRT2104组 细 胞 中Sirt1 mRNA和蛋白表达水平上调(P<0.05),见表8、图3。
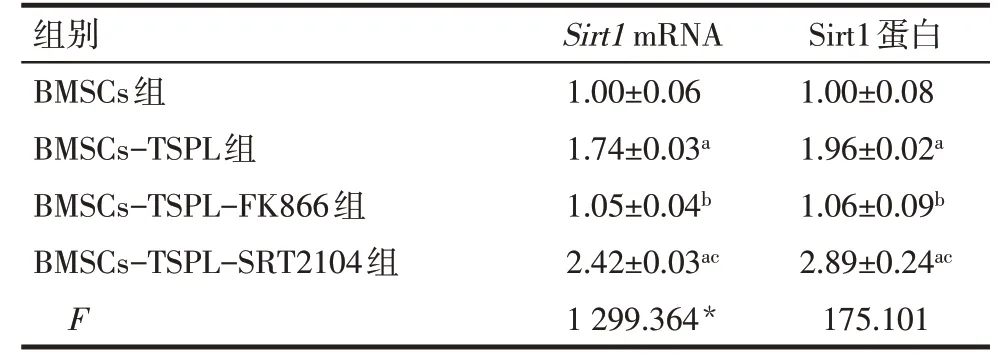
Tab.8 Comparison of Sirt1 mRNA and protein levels in BMSCs between the four different treatment groups表8不同处理组BMSCs中Sirt1 mRNA和蛋白表达水平的比较 (n=4,x±s)
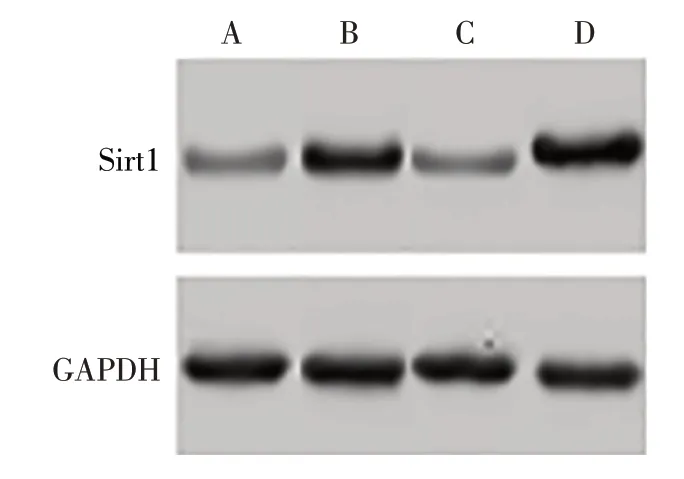
Fig.3 Sirt1 protein level in myeloid cells图3 髓核样细胞相关蛋白的表达
3 讨论
有研究表明,牛膝皂苷、当归、梓醇、黄芪甲苷等中药及提取物均可促进BMSCs分化成髓核样细胞而改善椎间盘退化[5-8]。葛根素通过ERK1/2和P38MAPK途径促进成骨分化,改善去卵巢大鼠骨质疏松[9]。椎间盘退变的主要表现为细胞外基质成分的变化,尤其是糖胺多糖丢失[10]。因此,本研究分别测定大鼠椎间盘组织和BMSCs中糖胺聚糖含量来判断椎间盘退变情况,结果显示,与假手术组相比,模型组大鼠椎间盘组织中糖胺聚糖含量降低;与模型组相比,TSPL治疗组糖胺聚糖含量增加,且50 mg/kg TSPL效果较30 mg/kg显著;体外实验结果显示,不同剂量TSPL组糖胺聚糖含量均高于BMSCs组,其中10、20、30μmol/L TSPL组糖胺聚糖含量依次升高,40、50μmol/L TSPL组糖胺聚糖含量逐渐降低,故后续实验选择30μmol/L TSPL处理细胞。
BMSCs具有多向分化能力,根据所处的微环境不同,可分化成神经细胞、心肌细胞和肝样细胞等[11-12]。椎间盘由外层的纤维环及其包绕的髓核构成,髓核由细胞和细胞外基质组成,基质主要包括水、蛋白多糖、胶原和非胶原蛋白。退变的椎间盘组织中,细胞外基质降解增强,导致髓核细胞内Ⅱ型胶原蛋白转变成Ⅰ型胶原蛋白[13],糖胺聚糖含量降低。因此,研究BMSCs向髓核样细胞分化对椎间盘退变疾病的治疗具有重要意义。据报道,黄芪甲苷Ⅳ可通过调节糖原合成酶激酶(GSK)3β/β-连环蛋白信号通路促进神经生长因子(NGF)诱导的成骨细胞分化[14]。梓醇通过Wnt/β-catenin途径促进骨髓间充质干细胞的成骨分化[15]。本研究结果显示,BMSCs经TSPL处理后,BMSCs中糖胺聚糖含量增加,且促进BMSCs向髓核样细胞分化。COL2A1、Aggrecan、Sox9和Tie2作为髓核样细胞的特有基因,可用来判断BMSCs分化至髓核细胞的程度[16-17]。Liu等[18]研究表明椎间盘退变过程中Aggrecan蛋白表达量降低。本研究结果发现,BMSCs经TSPL处理可上调COL2A1、Aggrecan以及Sox9的mRNA和蛋白表达水平,并且下调Tie2 mRNA和蛋白表达水平。
NAD+是一种典型的辅酶,介导多种氧化还原反应,促进关键代谢途径中的氢转移。Sirt1是一个与细胞分化、衰老、凋亡和能量代谢密切相关的NAD+依赖的组蛋白去乙酰化酶[19]。Sirt1通过连接调节NAD+补救途径的酶反馈回路和昼夜节律转录-翻译反馈回路,调节代谢及昼夜节律[20-22]。在神经退行性疾病治疗过程中,可通过补充NAD+中间产物来恢复NAD+水平,进而改善记忆退化和动作迟钝等症状。在细胞增殖和分化的过程中,NAMPT作为整个反应启动因子,最终产生Sirt1,激活下游信号通路,对细胞进行调控。据报道,在高糖和游离脂肪酸微环境中,miR-449通过抑制Sirt1途径抑制BMSCs的成骨分化[20]。NAMPT/NAD/Sirt1轴信号转导通路是调控BMSCs增殖、分化的重要通路之一[23]。NAMPT抑制剂FK866通过抑制尼克酰胺的合成,降低Sirt1活性,进而减少BMSCs的分化。本研究结果显示,NAMPT抑制剂FK866下调TSPL处理的BMSCs中NAMPT和Sirt1蛋白表达水平,且降低NAD+水平,提示NAMPT/NAD/Sirt1信号通路被阻断;经Sirt1蛋白的激活剂SRT2104处理后,Sirt1蛋白表达量增加,提示NAMPT/NAD/Sirt1信号通路可能在TSPL诱导的BMSCs向髓核样细胞分化中发挥重要作用。
综上所述,TSPL可通过激活NAMPT/NAD/Sirt1信号通路,促进BMSCs向髓核样细胞分化来改善椎间盘退变,这为TSPL治疗椎间盘退变提供了实验基础。

