纤维样肾小球病一例
佟 琰 丁 峰 刘英莉
1 临床资料患者女,72岁,因“发现泡沫尿3年,加重1周”入院。患者于3年前发现泡沫尿,外院查尿常规示尿蛋白(+)、24 h尿蛋白定量1.04 g,未行肾穿刺活组织检查(简称活检),予口服肾炎宁康复片治疗;随访期间,多次查24 h尿蛋白定量高于正常值(0~0.15 g),最高为2.00 g。患者入院1周前出现发热,最高体温达38.9 ℃,伴右上腹痛、恶心,无呕吐。当时于上海交通大学医学院附属第九人民医院查尿常规示尿蛋白(+++)、尿隐血(++)、24 h尿蛋白定量6.47 g,血白蛋白27 g/L。患者既往有高血压病史50余年,收缩压最高达200 mmHg(1 mmHg=0.133 kPa)。患者曾因右侧甲状腺瘤行甲状腺次全切除术,因左下肢静脉曲张行手术治疗(具体不详),有腔隙性脑梗死史,有肝血管瘤病史,曾因室性早搏口服普罗哌酮治疗(现已停药)。患者否认糖尿病、结核、肝炎等病史。入院后24 h动态血压检查示:平均血压163/89 mmHg,收缩压、舒张压昼夜节律消失。24 h动态心电图检查示:窦性心律,房性早搏9次,室性早搏38次,ST段未见缺血型改变。上腹部CT、MRI检查均提示,肝右叶占位,性质待定,血管瘤可能。实验室检查结果如下。血常规示:血红蛋白85 g/L,余指标未见异常。尿常规示:尿蛋白(+++),尿血红蛋白(+),尿红细胞30/μL;3次查24 h尿蛋白定量分别为13.24、7.44、11.26 g。肾功能检查示:血清尿素氮7.2 mmol/L,尿酸411 μmol/L,血清肌酐141 μmol/L。血生物化学检查示:血清白蛋白24 g/L,TC 4.72 mmol/L,TG 1.81 mmol/L,LDL-C 3.57 mmol/L,HbA1c6.3%。免疫学指标检查示:免疫球蛋白IgE 129.00 U/mL,IgA、IgM、IgG均无异常;血、尿游离轻链检查呈阴性;类风湿因子(RF)32.8 U/mL,免疫荧光抗核抗体(IFANA)、抗双链DNA(dsDNA)抗体、可提取核抗原(ENA)、血清补体(C3、C4)、抗中性粒细胞胞质抗体(ANCA)均无异常。甲状腺功能检查示:FT3 1.97 pg/mL(1 pg/mL=1.54 pmol/L),T3 0.43 ng/mL(1 ng/mL=1.54 nmol/L),甲状腺球蛋白抗体(TGAb)325.40 U/mL,甲状腺过氧化物酶抗体(TPOAb)11.40 U/mL,TSH、FT4、T4均无异常。肝炎病毒检查示:抗戊型肝炎(HEV)-IgG呈极弱阳性,乙型肝炎病毒(HBV)、甲型肝炎病毒(HAV)、丙型肝炎病毒(HCV)均呈阴性。肿瘤标志物未见异常,人类免疫缺陷病毒(HIV)、甲苯胺红不热血清反应素试验(TRUST)均呈阴性。
入院后患者行肾穿刺活检。光学显微镜(简称光镜)下全片共见44个肾小球,其中13个肾小球完全玻璃样变,过碘酸希夫(PAS)染色见肾小球多表现为弥漫性细胞增生致毛细血管腔开放不佳,肾小球内炎症细胞浸润不明显,较多肾小球呈典型的分叶样改变(图1A、1B),基底膜六胺银(PASM)染色多见肾小球毛细血管壁明显分层(图1C、1D);12个肾小球有新月体形成,以细胞性新月体为主;少数肾小管上皮细胞呈空泡变性,萎缩较多,部分肾小管中见蛋白管型,间质较明显,有炎症细胞浸润,以单个核细胞为主,Masson染色见较明显的间质纤维化(图1E、1F),小动脉明显透明样变;刚果红染色未见苹果绿(淀粉样变特异性表现,图1G、1H)。免疫荧光染色检查:全片共见7个肾小球,其中4个肾小球有新月体形成,IgA(-)、IgG(+)、IgM(+)、C3(+++)、C1q(+++)、κ轻链(+++)、λ轻链(++),呈弥漫性、球性沉积于毛细血管壁和系膜区。
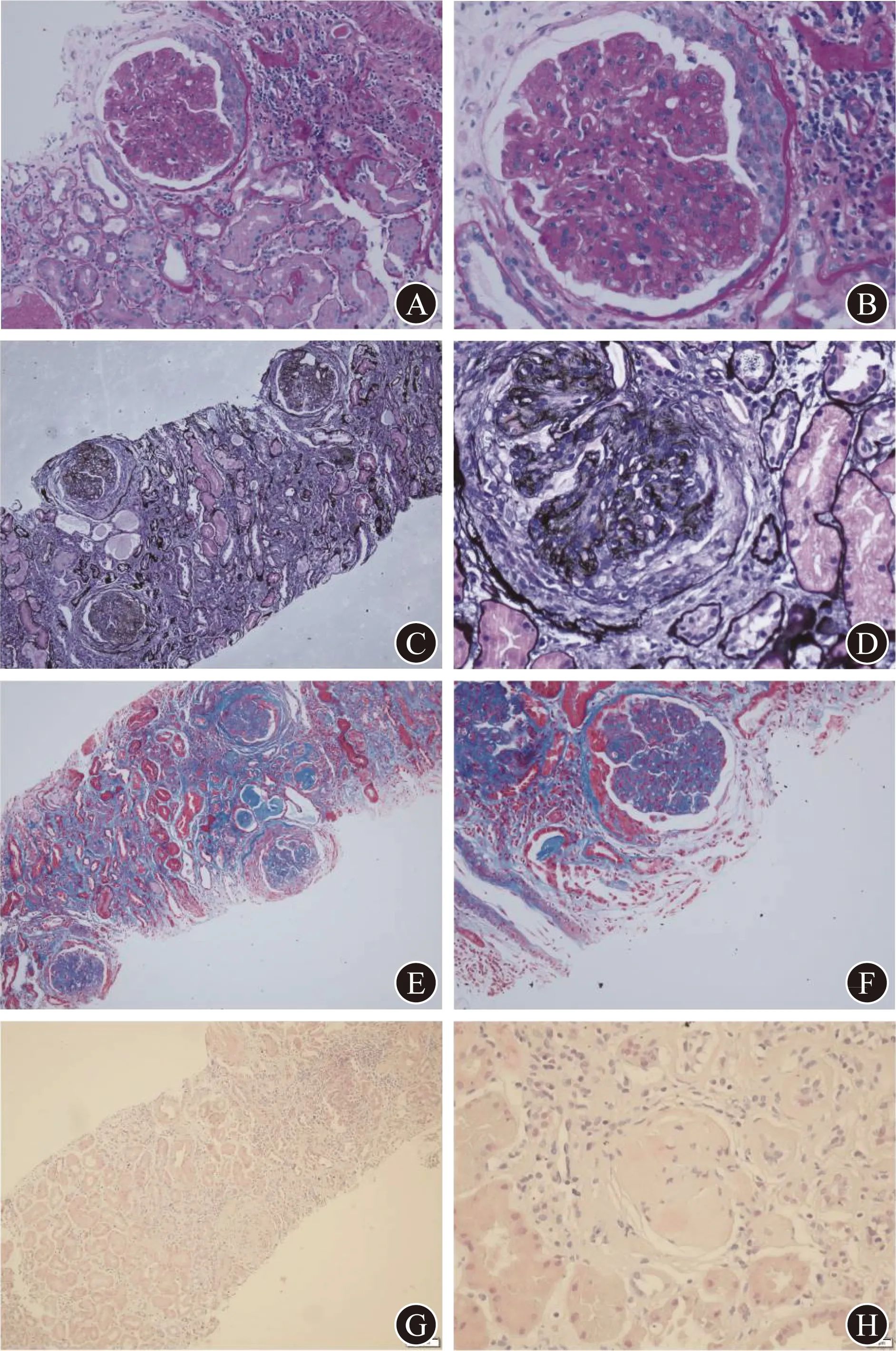
A PAS染色(×200) B PAS染色(×400) C PASM染色(×100) D PASM染色(×400) E Masson染色(×100) F Masson染色(×200) G 刚果红染色(×100) H 刚果红染色(×400)图1 患者肾组织特殊染色光镜检查结果
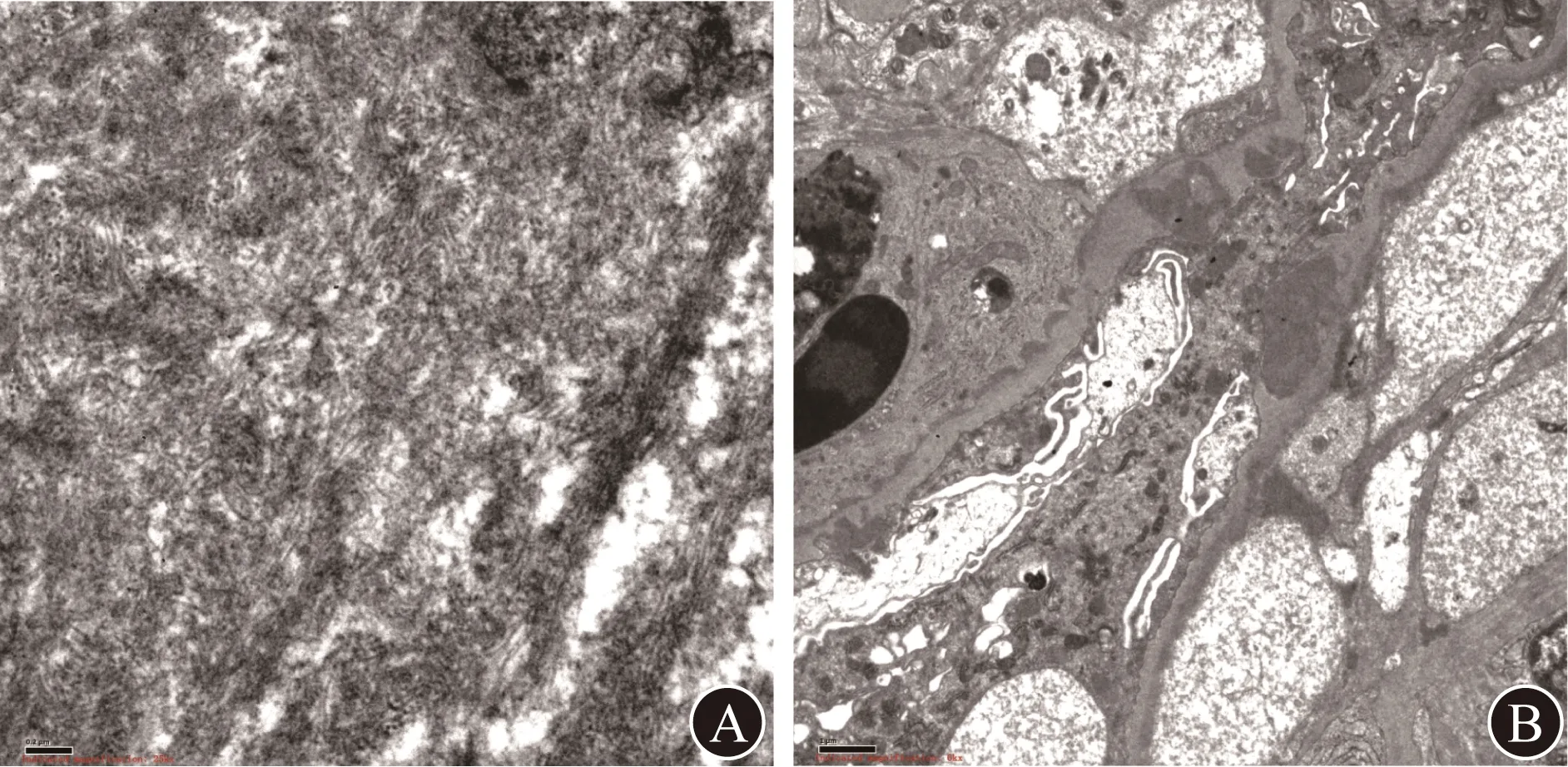
A 电镜(×25 000) B 电镜(×6 000)图2 患者肾组织电镜检查结果
电子显微镜(简称电镜)下见系膜区系膜细胞和基质增生,呈结节状改变,结节区域可见纤维样物质沉积,纤维丝直径约15~25 nm,排列紊乱;上皮下、内皮下、系膜区、基底膜内电子致密物沉积;部分肾小管萎缩;肾间质淋巴细胞、单核细胞浸润伴胶原纤维增生(图2),系膜区有纤维样物质沉积(纤维丝直径约15~25 nm),排列紊乱。结合光镜诊断为Ⅲ型膜增生性肾小球肾炎,不除外合并纤维样肾小球病(fibrillary glomerulonephritis,FGN)。根据上述检查结果,临床诊断为肾病综合征,FGN;病理诊断为膜增生性肾小球肾炎(MPGN)。
此后,依据最新进展,为避免电镜观察的纤维丝直径存在误差的可能性,2021年3月补做免疫组织化学DNAJ同源B家族成员9(DNAJB9)染色,结果显示患者肾小球DNAJB9染色阴性(图3)。
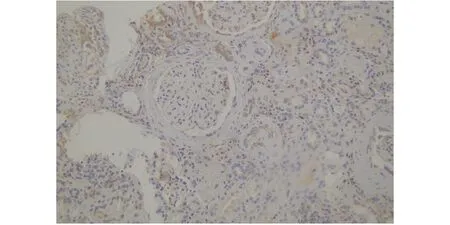
图3 患者肾组织免疫组织化学DNAJB9染色结果(×200)
患者入院后予以奥诺星、美罗培南、莫西沙星抗感染治疗1月余,体温恢复正常,腹痛、恶心症状缓解,肾穿刺活检明确诊断后,排除禁忌证,予以甲泼尼龙40 mg口服,环磷酰胺(CTX) 0.6 g冲击治疗1次,同时给予降压、利尿,抗凝、纠正贫血、调脂治疗,以及补充血白蛋白、甲状腺素等支持治疗。患者经过糖皮质激素联合免疫抑制剂治疗2个月,蛋白尿未见明显改善,且容量负荷持续增加,发生急性左心衰竭,夜间不能平卧,遂予以血液透析治疗,同时激素逐渐减量至停用。患者心力衰竭逐步缓解,但尿量逐渐减少至300 mL/d,血肌酐水平升至650 μmol/L,考虑进展为终末期肾病(ESRD),行维持性血液透析治疗。
2 讨 论FGN是一种较少见的原发性肾小球疾病[1],其特征性的表现为肾小球内见刚果红染色阴性的纤维样物质。
Rosenmann等[2]于1977年首次报道了肾病综合征伴肾小球内刚果红染色阴性的纤维样物质沉积的肾小球疾病。FGN主要发生于成人,男女性患者比例略不同,白种人发病率更高[3]。曾有少数家族性FGN的报道,疑似遗传方式为常染色体显性遗传[4-5],但未得到充分证实。FGN的发病机制尚未被完全阐明,目前被认为是继发于定位在肾小球的免疫复合物沉积并形成纤维亚结构[6]。
FGN的临床表现:几乎所有FGN患者均有蛋白尿,50%以上患者24 h尿蛋白定量>3.5 g,约60%的患者发病时即表现为肾病综合征,约78%的患者见镜下血尿、高血压和肾小球滤过率(GFR)下降[7]。Nasr等[8]的研究结果显示,FGN患者平均血清肌酐为185.64 μmol/L,约1/3的患者血清肌酐水平正常(≤106.08 μmol/L)。FGN通常进展缓慢,临床表现为持续蛋白尿。男性患者、高血压控制不佳、肾病综合征是ESRD发生的危险因素[9]。FGN是一种罕见的原发性肾小球疾病,实验室检查抗核抗体(ANA)、ANCA、RF、抗肾小球基底膜抗体和血清补体(C3、C4)水平正常,血、尿蛋白电泳均为阴性[7,10]。Asakawa等[11]报道了1例髓过氧化物酶-ANCA水平升高的FGN患者。2017年的一项队列研究结果显示,在确诊的FGN患者中,HCV感染者更易进展为ESRD,且预后特别差。此外,FGN也与感染、恶性肿瘤和自身免疫性疾病(Graves病、系统性红斑狼疮、干燥综合征)的发生相关[12-14]。
FGN的病理特点:①光镜下见病变肾小球的主要表现为系膜增生和(或)肾小球基底膜(GBM)增厚[6]。Rosenstock等[15]的研究结果显示,FGN最常见的病理组织学类型是MPGN、系膜增生和肾小球系膜基质增生,31%的患者伴有新月体形成和纤维素样坏死,晚期可出现肾小球硬化、肾小管萎缩和肾间质纤维化,预后不佳。此外,亦见FGN表现为新月体型肾小球肾炎的报道[9,16-17]。国内多数报道为膜性肾病,本例患者表现为MPGN伴大量新月体形成。②电镜下观察超微结构是诊断FGN的主要依据。FGN的主要特征为随机排列的纤维样沉积物[6,18],纤维丝直径约15~25 nm,为肾淀粉样纤维直径的2倍,通常局限于肾小球,呈弥漫性或多灶状分布于扩张的肾小球系膜区和(或)增厚的GBM,也可分布于GBM的上皮细胞侧或内皮细胞侧,偶有沿肾小管基底膜和肾间质分布[6,13]。纤维僵直,呈紊乱无规律排列,伸向各方,一般无分支[19]。③大多数FGN的免疫荧光染色显示多克隆IgG和补体C3的免疫复合物沉积,通常呈颗粒状分布于肾小球系膜区,或可见毛细血管壁呈线性染色[20]。已有研究证实,FGN患者沉积的IgG主要为IgG4亚型[5,13],一些病例同时具有IgG1和IgG4,而IgA、IgM阳性染色少见[7,21]。免疫电镜胶体金双标记和多重标记免疫组织化学定位研究[12,22]证实,IgG和补体C3与纤维样物质共定位,部分患者可见κ、λ轻链蛋白和淀粉样P成分,淀粉样P成分可能是纤维样物质的组成之一,并非刚果红染色阳性的构型(即β折叠);而细胞外基质成分,包括Ⅳ型胶原蛋白、硫酸乙酰肝素蛋白聚糖、纤连蛋白和层黏连蛋白等均呈阴性。④ DNAJB9是一种新的FGN生物学标志物。Nasr等[23]对受试者肾穿刺活检样本进行DNAJB9免疫组织化学染色检测的结果显示,几乎所有FGN患者肾小球DNAJB9染色均较强、均匀,而在淀粉样变患者、健康受试者或非FGN肾小球疾病患者中未见DNAJB9染色阳性,表明其诊断灵敏度为98%,特异度>99%。此外,免疫电镜检查显示,DNAJB9定位于FGN原纤维,而不是淀粉样原纤维或免疫触须样肾小球病(IT)的病变微管[23]。Alexander等[7]利用液相质谱和免疫染色等方法筛选并验证了DNAJB9在FGN肾小球中表达丰富,且其分布与免疫沉积物相似。Andeen等[24]的研究结果显示,DNAJB9可能是一种FGN自身抗原,并提示IgG1和经典的补体效应通路可能是FGN肾小球破坏性损伤的介质。Dasari等[25]进行的蛋白质组学研究发现,DNAJB9在FGN肾小球中表达丰富,约为淀粉样变肾小球的6倍。Nasr等[26]的研究结果显示,FGN患者血清中DNAJB9的丰度较对照组增高4倍,与FGN患者的GFR预测值呈负相关;血清DNAJB9水平预测FGN的能力为中度灵敏(67%)、高度特异(98%)。一系列的研究[27-28]结果证实,DNAJB9可作为FGN诊断的新型生物学标志物。
FGN的诊断:除常规病史询问和临床表现外,主要依据电镜下超微结构明确诊断。在Rosenstock等[15]的研究中,将FGN定义为电镜(×3 000)下见随机排列的直径<30 nm的纤维样沉积物,无空心结构;刚果红染色阴性,免疫荧光染色免疫球蛋白阳性。2015年,Lusco等[20]提出FGN诊断的关键:系膜增生和毛细血管内皮细胞增殖;多克隆IgG和补体C3沉积;系膜中随机排列的纤维样物质,在GBM中多变,纤维丝直径为12~22 nm;刚果红染色阴性。Nasr等[23]研究发现,DNAJB9在FGN肾小球中表达丰富,证实该生物学标志物对FGN的诊断具有价值。
FGN的鉴别诊断:①FGN与IT相鉴别。FGN与IT的临床表现有许多相似之处,电镜下均表现为肾小球内存在类淀粉样纤维物质,但IT的典型超微结构为平行排列、直径>30 nm的中空微管[15,20];免疫荧光染色显示,肾小球沉积物通常为单克隆,且不含IgG4[18]。有研究[29]结果显示,IT患者常合并低补体血症,而FGN患者血清补体多为正常[22]。Sethi等[29]报道,载脂蛋白(Apo)E与免疫球蛋白轻链C区的相对比例决定了FGN、IT、肾淀粉样变性中肾小球沉积物的不同类型,进一步提示FGN、IT为两种不同疾病。②FGN与肾淀粉样变、冷球蛋白血症肾损伤相鉴别。肾淀粉样变典型病例肾穿刺活检病理学检查见刚果红染色阳性,免疫荧光染色IgG、补体C3阴性;电镜下纤维直径为7~15 nm,且淀粉样变不局限于肾小球,还可累及血管壁、GBM、肾间质,甚至多系统、多脏器。冷球蛋白血症电镜下见类似微管状纤维样物质沉积,纤维丝直径为25~80 nm,可见杆状、环形小体和指纹样等结构,较固定地分布于GBM内皮细胞侧。患者血清中常有冷凝集蛋白、RF阳性,临床上多表现为雷诺现象或多发性关节疼痛[30-31]。依据上述临床表现和病理特点,可加以鉴别。
此外,FGN可能与感染、丙型肝炎、恶性肿瘤、自身免疫性疾病的发生有关,故诊断时应排除相关原因引起类似疾病表现的继发性肾小球病。
FGN的治疗:尽管大多数研究认为FGN可能与免疫系统相关,但是免疫抑制的治疗效果却不令人满意。Rosenstock等[15]的研究显示,56例FGN患者中,20例应用免疫抑制治疗(糖皮质激素或CTX或环孢素)后,患者肾功能无明显改善,发展至ESRD的病程未延缓。Nasr等[8]对29例FGN患者给予免疫抑制治疗,未延缓FGN病程进展。使用糖皮质激素、CTX、ACEI、血浆置换或联合治疗的效果均不理想[4,18]。近年来,利妥昔单抗(一种针对CD20的嵌合单克隆抗体)被用于FGN的治疗。在Javaugue等[32]的研究中,13例接受免疫抑制治疗的患者中有6例获得部分缓解,其中5例接受利妥昔单抗治疗。Chaudhary等[33]报道2例接受利妥昔单抗治疗的FGN患者,随访24个月后,患者肾功能均较治疗前改善且维持稳定。一项纳入11例患者的研究[34]发现,为期6个月的利妥昔单抗治疗与患者的肾功能稳定相关,但治疗前后蛋白尿和DNAJB9水平无明显变化。目前尚未明确利妥昔单抗治疗FGN的最佳剂量,对于行利妥昔单抗治疗的患者,其B细胞亚群分布改变可能提示疾病复发,应密切监测[35]。利妥昔单抗可否单独作为一种治疗方法,还是与糖皮质激素、其他免疫抑制剂联合使用时更有效,尚需进一步的研究。对于临床表现为肾病综合征、大量蛋白尿的患者,给予糖皮质激素、雷公藤多甙片、中药等联合治疗,可能有助于减少尿蛋白,保护肾功能,但其远期疗效尚待进一步观察[36]。
FGN的预后:FGN的预后大多不理想,患者的年龄、性别、发病时血清肌酐水平、光镜下病理类型和肾小球硬化程度等均是影响其预后的因素[31,37]。约50%的FGN患者在2~4年内进展为ESRD,从肾穿刺活检病理确诊至进展为ESRD的时间为(24.4±15.2)个月[15,37]。接受肾移植的FGN患者中,约1/3复发,但在移植后的前5年内复发率较低[38]。
本例患者入院时有高热,结合辅助检查排除其他部位感染,考虑感染的原发部位为肝脓肿。患者因感染诱发蛋白尿加重,根据其临床表现和实验室检查结果诊断为FGN,病理类型为MPGN;免疫组织化学DNAJB9染色阴性,考虑DNJB9为新型生物标志物,不同的抗原敏感性不同,并且可能存在抗原修复不充分,从而产生假阴性的结果。Nasr等[39]报道了1例单克隆伽马病进展为DNAJB9阴性的FGN患者,其免疫复合物沉积由γ1重链和可变区完全缺失组成。因此,当肾穿刺活检提示FGN,而DNAJB9染色阴性时,可能需要通过更多的免疫化学和分子研究来明确诊断。
本例患者经抗感染治疗后体温恢复正常,经糖皮质激素和免疫抑制剂治疗2个月后,血清肌酐升至291 μmol/L,24 h尿蛋白定量14.64 g,病情无明显好转。后患者发生严重心力衰竭,予以血液透析治疗,随着透析时间的增加,尿量逐渐减少,血清肌酐水平进行性升高,最终进入ESRD,行维持性血液透析治疗。患者于短时间内进展为ESRD,考虑其可能的原因为血液透析超滤过快导致残余肾功能丧失。
综上所述,FGN是一种罕见的肾小球疾病,其主要临床表现为蛋白尿、血尿、高血压和肾功能异常,电镜下超微结构是明确诊断的重要依据,DNAJB9是新型且特异的生物学标志物。目前,FGN的发病机制尚不明确,缺乏有效的治疗方法,糖皮质激素联合免疫抑制剂治疗的效果欠佳,患者大多进展为ESRD,预后较差。

