住院肿瘤患者急性肾损伤预后相关影响因素
刘水英 梁如练 谢 平 王雅君 赵晋媛 王 锋 汪年松
随着肿瘤诊断及治疗手段的快速发展,肿瘤患者生存率得到显著提高,但肿瘤相关急性肾损伤(acute kidney injury,AKI)的发生率不断增高。由于恶性肿瘤的类型(包括实体瘤、血液系统肿瘤)、严重程度、并发症及治疗方法的不同,肿瘤患者AKI的发生率存在很大差异。肿瘤患者发生AKI后不仅增加了预后不良的可能性,还进一步影响肿瘤治疗的效果。然而,AKI是可以预防的,甚至可以在早期逆转。充分了解AKI发生、发展的危险因素和临床特点,早期发现、及时干预治疗AKI,可以延缓疾病的进展,改善患者的预后[1]。本研究通过病例收集分析,探讨导致肿瘤患者AKI发生、发展及其预后的危险因素,为今后的预防及治疗提供理论依据。
1 对象与方法
1.1 研究对象 回顾性分析2019年1—12月因恶性肿瘤在江苏大学附属上海市第八人民医院住院患者的病例资料。排除标准:年龄<18岁,住院期间血清肌酐检测少于2次,入院时诊断为终末期肾脏病接受血液透析、肾移植治疗,临床资料不完整的患者。
1.2 定义 按照2012年改善全球肾脏病预后组织(KDIGO)诊断标准[2],AKI定义为血清肌酐(sCr)水平48 h内升高≥0.3 mg/dL(1 mg/dL=88.4 μmol/L),或在过去7 d内升高≥基线值的1.5倍。同时,对AKI进行分期,AKI 1期是指血清肌酐超过基线值的1.5~1.9倍,或增加>0.3 mg/dL;AKI 2期为血清肌酐超过基线值的2.0~2.9倍;AKI 3期为血清肌酐超过基线值的3倍或增加≥4 mg/dL或需行肾脏替代治疗。以非AKI患者作为对照组。所有恶性肿瘤患者均通过组织病理学检查证实。低白蛋白血症定义为血清白蛋白水平<30 g/L,高尿酸血症定义为男性血清尿酸水平>420 μmol/L,女性>360 μmol/L。死亡定义为住院期间全因死亡。
1.3 观察指标 收集研究对象的性别、年龄、原发肿瘤、实验室指标,是否合并CKD、糖尿病、高血压、冠心病、对比剂及相关药物使用史,是否存在尿路梗阻、感染、手术及血容量不足(心力衰竭、休克、消化道出血、肝肾综合征)等损伤因素。
2 结 果
2.1 肿瘤患者AKI的发生率 研究期间共纳入1 658例符合标准的住院恶性肿瘤患者,年龄为(61.23±16.14)岁(范围18.00~96.00岁),男女比例为1.05∶1。其中消化系统肿瘤927例(55.9%),妇科肿瘤180例(10.9%),骨肿瘤171例(10.3%),呼吸系统肿瘤163例(9.8%),甲状腺肿瘤81例(4.9%),泌尿系统肿瘤76例(4.6%),其他肿瘤60例(3.6%)。发生AKI的肿瘤患者225例(13.6%);其中AKI 1期患者147例(65.3%),2期42例(18.7%),3期36例(16.0%)。
2.2 两组患者基本临床特征分析 非AKI组中患者年龄为63(51,71)岁,男性775例(54.1%),住院时间6(4,11)d;AKI组患者年龄为71(61,80)岁,男性患者134例(59.6%),住院时间9(6,14) d。与非AKI组肿瘤患者相比,AKI组肿瘤患者年龄更大,血红蛋白、白蛋白、血钠水平更低,总胆红素、血清尿酸、sCr、基线sCr、血钾、球蛋白水平更高,合并肿瘤转移、CKD、糖尿病、高血压、冠心病病史的患者比例更高,并且肿瘤患者发生AKI后住院时间相比未发生AKI患者更长,住院期间死亡率更高,差异均有统计学意义(P值均<0.01)。见表1、2。

表1 两组患者合并症和预后比较 [n(%)]
2.3 两组患者肾损伤相关因素分析 AKI组患者存在肾前性因素,感染,尿路梗阻,使用抗生素、化学治疗(简称化疗)药、NSAID、利尿剂的比例均高于非AKI组,差异均有统计学意义(P值均<0.01)。见表3。
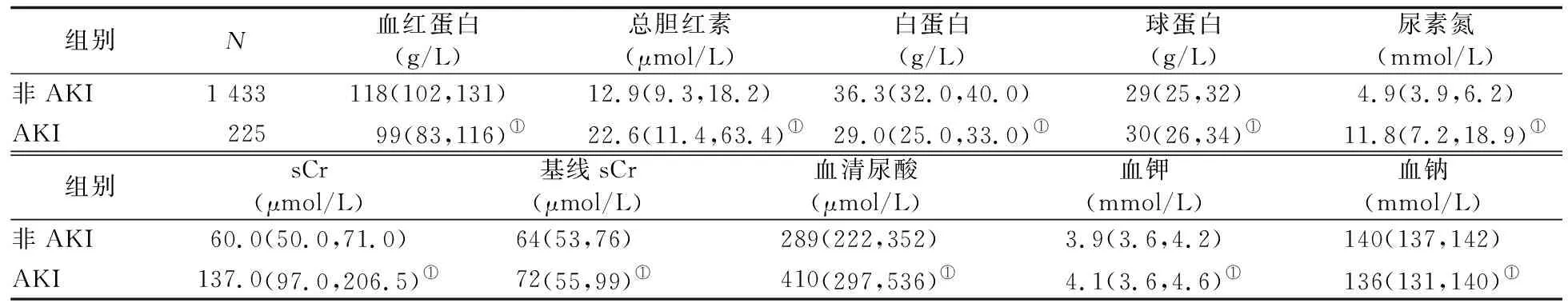
表2 两组患者实验室检查结果比较 [M(P25,P75)]
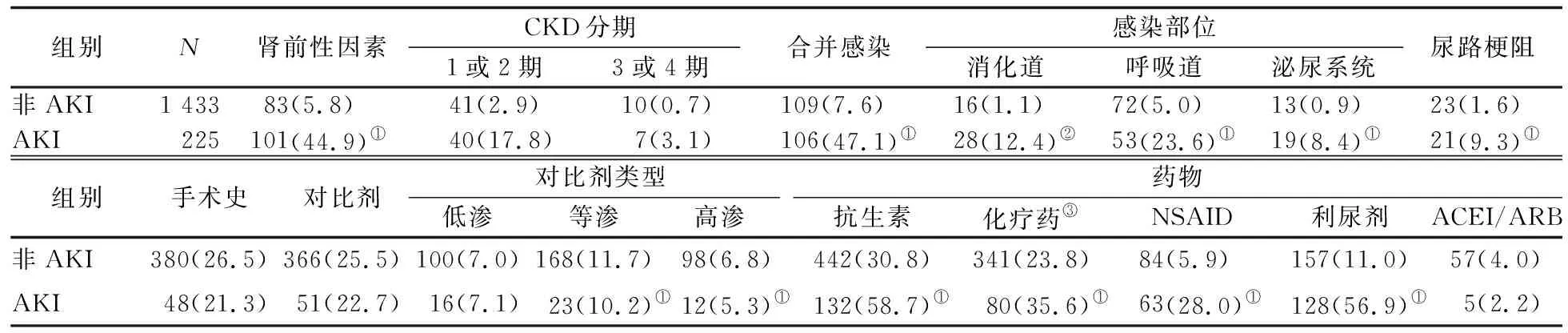
表3 两组患者肾损伤相关因素比较 [n(%)]
2.4 肿瘤患者发生AKI的危险因素 将表1~3中差异有统计学意义的变量加上性别因素纳入logistic回归模型中分析。结果显示,年龄>60岁、肿瘤转移、合并CKD、低白蛋白血症、高尿酸血症、存在肾前性因素、感染、尿路梗阻、使用化疗药、使用NSAID、使用利尿剂为肿瘤患者发生AKI的独立危险因素(P<0.05,0.01)。见表4。
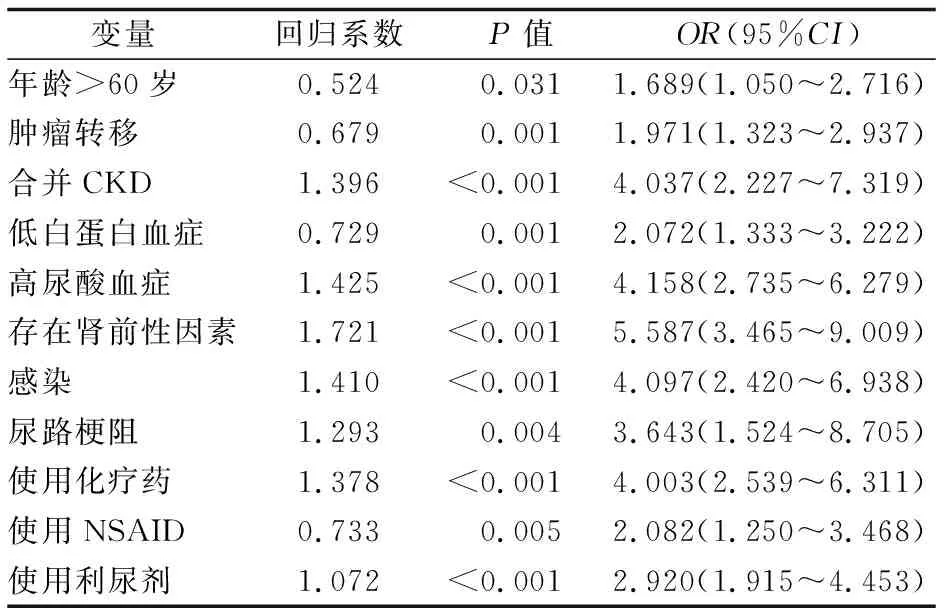
表4 肿瘤患者发生AKI危险因素的logistic回归分析结果
2.5 肿瘤合并AKI患者的预后及其危险因素分析 发生AKI的225例肿瘤患者中,80例(35.6%)死亡,145例(64.4%)存活。 AKI分期影响肿瘤患者预后,AKI 1期、2期、3期患者的死亡率分别为27.9%(41/147)、47.6%(20/42)和52.8%(19/36),3组间的差异有统计学意义(P<0.01)。死亡组年龄>60岁、存在肾前性因素、低白蛋白血症、合并感染患者比例均显著高于存活组(P值均<0.01)。经多因素logistic回归分析发现,年龄>60岁、存在肾前性因素、低白蛋白血症、感染是肿瘤患者发生AKI后死亡的独立危险因素(P<0.05, 0.01),合并这些因素者发生AKI后,死亡风险分别增加289.6%、184.9%、306.9%、128.2%。见表5、6。

表5 发生AKI的存活和死亡肿瘤患者肾损伤相关因素比较 [n(%)]
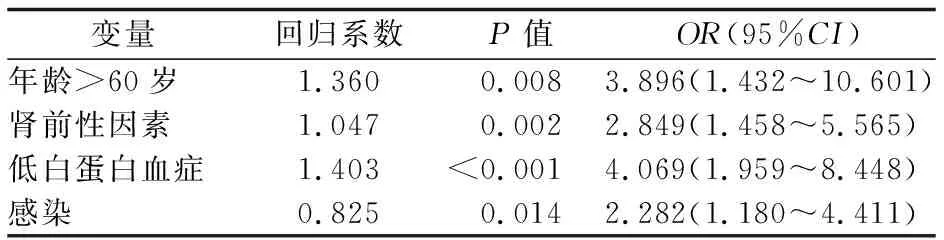
表6 肿瘤合并AKI患者预后的多因素logistic回归分析结果
3 讨 论
肿瘤患者AKI的发生率存在很大差异,丹麦一项队列研究[3]在1999—2006年随访了120万例肿瘤患者,肾癌、多发性骨髓瘤和肝癌患者1年内发生AKI的风险最高,分别为44.0%、33.0%和31.8%。在危重肿瘤患者中,AKI的发生率>50%,高于其他同等严重疾病的非肿瘤患者群体[4]。本研究对肿瘤患者发生AKI及其预后的危险因素进行了分析。多因素logistic回归分析结果显示,年龄>60岁、肿瘤转移、合并CKD、低白蛋白血症、高尿酸血症、存在肾前性因素、感染、尿路梗阻、使用化疗药、使用NSAID、使用利尿剂均为肿瘤患者发生AKI的危险因素。另外,年龄>60岁、存在肾前性因素、低白蛋白血症、感染是肿瘤患者发生AKI后死亡的独立危险因素。但对比剂的使用与AKI的发生并不相关,有研究[5-7]结果表明,对比剂诱导的AKI发病率是可变的,主要取决于对比剂的渗透压和使用量。Werner等[8]的研究发现,对于肾功能受损的高危肿瘤患者,使用低剂量的等渗对比剂是安全的。
肿瘤本身及其治疗引起的进食量不足、呕吐、腹泻是肾前性AKI发生的常见原因。对于存在肾前性AKI风险的恶性肿瘤患者,应充分考虑继续使用利尿剂、NSAID等药物的风险及益处[9]。绝大多数恶性肿瘤患者免疫功能低下,感染导致内皮细胞功能障碍,全身血管阻力下降形成低血压和相对低血容量状态,从而引起肾脏灌注不足[10]。急性全身性感染、败血症可直接损伤肾实质。研究[11]结果显示,ICU患者中有35%~50%的急性肾小管坏死引起的AKI可归因于败血症。50%的AKI与败血症相关,并且超过60%的败血症患者发生AKI[12]。研究[13]结果表明,在重症肿瘤患者中,败血症的发生是AKI最常见的危险因素。本研究结果显示,存在肾前性因素、感染不仅是肿瘤患者发生AKI的独立危险因素,还使AKI患者死亡风险分别增加184.9%、128.2%。早期诊断并合理的抗感染治疗,维持适当的血容量和血流动力学稳定是预防肿瘤患者发生AKI的关键。
肿瘤溶解综合征(tumor lysis syndrome,TLS)是一种肿瘤代谢急症,AKI是其常见并发症。由于细胞快速大量分解、细胞内容物大量释放,可引起高尿酸血症、高钾血症、高磷血症和继发性低钙血症。核酸分解为嘌呤代谢物而引起高尿酸血症,嘌呤代谢物进一步分解为次黄嘌呤,最终转化为黄嘌呤、尿酸沉积,导致小管梗阻和小管间质炎症,引发AKI。高尿酸血症也可通过调节炎症细胞因子释放、肾血管收缩、活性氧生成,以及诱导内皮细胞凋亡促进AKI的发生[14]。充分水化对于有TLS发生风险或已经存在TLS的患者是重要的干预措施,其可维持足够的肾小球滤过率和尿流率,促进钾、尿酸和磷酸盐的排泄。别嘌呤醇、非布司他均可通过抑制黄嘌呤氧化酶使尿酸生成减少,但无法降低已经存在高尿酸血症患者的尿酸水平。重组尿酸氧化酶可催化尿酸形成可溶性尿囊素,并迅速(4 h内)由肾脏排出,使血清尿酸水平急剧下降,可有效预防和治疗TLS相关性高尿酸血症[15]。采用持续肾脏替代疗法并使用较高清除水平[至少30~40 mL/(kg·h)]同样可用于治疗TLS。
化疗药可以通过肾前性、肾性、肾后性因素诱发肿瘤患者的AKI。用于治疗恶性肿瘤的细胞因子IL-2可引发毛细血管渗漏综合征,表现为全身水肿、发热、寒战、低血压,使肾小球滤过率下降从而引起肾灌注不足[16]。肾小球损伤在肿瘤患者中很常见,化疗药引起的血栓性微血管病(thrombotic microangiopathy ,TMA)是肾血管内皮细胞损伤的最严重形式,通常与重症AKI的发生相关[17]。近年来免疫检查点抑制剂应用越来越广泛,由于这类药物能强烈激活免疫系统,导致免疫相关不良事件的发生,与之相关的AKI发生率理论上可高达29%[18-19]。通过停用药物,给予糖皮质激素和肾脏替代疗法,一部分患者的肾功能可得到恢复[18]。环磷酰胺引起的出血性膀胱炎是其治疗的一个常见并发症,出血形成的血凝块造成的尿路梗阻同样也可引发AKI[20]。部分化疗药(如顺铂)对肾脏的影响是累积的,且通常呈剂量依赖性,在每个连续的治疗过程中都会导致肾小球滤过率降低;因此,化疗期间充足的水化作用及合理地调整用药剂量对于降低肾毒性非常重要[21]。此外,在肿瘤化疗前,需评估肾功能和治疗中发生AKI的风险,尽量选择肾毒性小的药物。
综上,AKI在肿瘤患者中并不少见,肾病学家和肿瘤学家都需要了解在此类人群中发生AKI的独特原因和最佳的管理方式。随着肿瘤肾脏病学领域的不断发展,对AKI早期标志物的研究和肾毒性较小的药物的使用,有望改善肿瘤肾脏并发症患者的预后。

