自然杀伤细胞的杀伤功能与系统性红斑狼疮疾病活动的相关性研究
赖瀚铃 刘 爽 黄新芳 蒋更如
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种病因不明的多系统受损的慢性自身免疫性疾病,其临床症状为患者感轻度疲劳和关节痛,或严重威胁生命的器官损害[1]。既往研究认为,T、B淋巴细胞异常是SLE发生、发展的核心机制。后续多项研究[2-3]结果表明,固有免疫细胞在驱动SLE自身免疫应答和组织损伤中发挥重要作用。自然杀伤细胞(natural killer cell,NK细胞)是固有免疫系统中至关重要的细胞毒性淋巴细胞,并在适应性免疫反应中发挥着不可或缺的作用。NK细胞的杀伤功能可在维持机体有效免疫力与防止过度炎症或保持自我耐受性之间达到关键平衡,在免疫系统介导的保护和维持体内稳态中发挥动态作用[4-7]。NK细胞的杀伤功能主要是通过其产生的溶菌颗粒、TNF超家族成员[如TNF相关凋亡诱导配体(TRAIL)与其受体(TRAILR)结合)]诱导靶细胞凋亡,以及其细胞表面的CD16(FcγR ⅢA)与包被抗体的靶细胞结合后介导抗体依赖的细胞调控的细胞毒性(antibody-dependent cell-mediated cytotoxicity,ADCC)途径来实现[8]。本研究旨在探讨SLE患者外周血NK细胞杀伤能力变化与疾病活动的相关性,为SLE的诊疗提供参考。
1 对象与方法
1.1 研究对象与观察指标 本研究回顾性分析上海交通大学医学院附属新华医院肾脏风湿免疫科于2019年1月—2021年1月收治的35例SLE患者的病历资料。纳入患者的临床资料及实验室检查指标完整,符合美国风湿病学会于1997年修订的SLE诊断及分类标准[9],相关患者纳入SLE组。根据SLE疾病活动指数(systemic lupus erythematosus disease activity index, SLEDAI)[10]对患者疾病活动程度进行评分,≥5分为活动性SLE(活动亚组),<5分为非活动性SLE(非活动亚组);并根据患者临床症状及实验室结果,将SLE组分为感染SLE亚组和非感染SLE亚组。选择同期排除自身免疫性疾病、血液系统疾病、慢性基础疾病,以及未接受免疫抑制治疗等个人史和家族史的20名行体格检查的健康者纳入对照组。该研究符合2013年制订的《赫尔辛基宣言》的要求。研究对象均签署知情同意书。收集受试者的临床资料,观察血常规、尿常规、补体C3、补体C4、抗双链-DNA抗体、炎症因子等指标。
1.2 检测方法
1.2.1 人外周血单个核细胞(peripheral blood mononuclear cell,PBMC)分离 清晨空腹时,使用EDTA-K2抗凝管采集SLE组与对照组外周血2 mL。使用淋巴细胞分离液对收集的外周血进行密度梯度离心,分离出人PBMC。
1.2.2 细胞培养 K562细胞系(获赠于上海中国科学院细胞库)是不表达主要组织相容性复合体Ⅰ(major histocompatibility complex,MHC Ⅰ)类分子的高度未分化人慢性髓系白血病细胞系。采用含10%胎牛血清的RPMI(Roswell Park Memorial Institute)1640培养基,以及37 ℃含体积分数为0.05的CO2细胞培养箱培养K562细胞系。
1.2.3 流式细胞术
1.2.3.1 外周血NK细胞比例及其受体检测 使用1×PBS重悬人PBMC,并加入小鼠抗人CD3异硫氰酸荧光素(FITC)抗体(美国赛默飞,货号为11-0037-42)、小鼠抗人CD56藻红蛋白(PE)-Cyanine5.5抗体(美国赛默飞,货号为35-0567-42)、小鼠抗人CD16别藻蓝蛋白(APC)抗体(美国赛默飞,货号为17-0168-42)、小鼠抗人TRAIL PE抗体(美国赛默飞,货号为12-9927-42),避光置于冰上30 min后对人PBMC进行染色,应用流式仪检测并记录数据。
1.2.3.2 CD107a+NK细胞比例检测 基于流式细胞术的CD107a抗体染色法[11],首先从外周血样本中分离纯化人PBMC,使用含10%胎牛血清的RPMI 1640培养基将PBMC浓度调整为5×106/mL,并与浓度为5×104/mL的作为靶细胞的K562细胞系以效与靶标比为10∶1的比例混合培养于U型底96孔板中,并按1∶50的比例加入小鼠抗人CD107a PE-Cyanine7进行共培养,培养条件为37 ℃、CO2体积分数为0.05,培养时间为1 h。随后将含布雷菲德菌素A(BFA)和莫能菌素(GolgiStop)混合物的预混液加入U型底96孔板中,在培养箱中孵育5 h用于检测细胞脱颗粒情况。所有细胞使用1×PBS重悬后,与小鼠抗人CD3 FITC、小鼠抗人CD56 PE-Cyanine5.5、小鼠抗人CD16 APC抗体置于冰上共孵育30 min,以1×PBS洗涤2次后,使用1%多聚甲醛重悬,应用流式仪检测并记录数据。
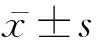
2 结 果
2.1 一般资料比较 SLE组男4例、女31例,平均年龄为39岁(年龄范围13~76岁);将22例活动性SLE患者纳入活动亚组,13例非活动性SLE患者纳入非活动亚组,其中5例患者在治疗过程中收集了2次样本。对照组男1例、女19例,平均年龄为39岁(年龄范围24~62岁)。对照组与SLE组性别构成和年龄分布的差异均无统计学意义(P值均>0.05)。
2.2 SLE活动与非活动患者的一般资料比较 SLE活动亚组患者SLEDAI评分、抗双链DNA抗体水平和24 h尿蛋白定量均显著高于非活动亚组(P值均<0.05)。两组间患者的性别构成、年龄、白细胞计数、血红蛋白水平、血小板计数、ESR、补体C3和C4水平,以及不同临床表现患者的差异均无统计学意义(P值均>0.05)。见表1。

表1 SLE活动亚组与非活动亚组基本资料和临床特征的比较
2.3 SLE患者外周血表达不同类型受体的NK细胞比例 SLE组、活动亚组、非活动亚组患者外周血CD3-CD56+NK细胞比例显著低于对照组,活动亚组CD3-CD56+NK细胞比例显著低于非活动亚组(P值均<0.01)。SLE组、活动亚组、非活动亚组患者外周血CD16+NK细胞比例显著低于对照组(P<0.001),活动亚组CD16+NK细胞比例显著低于非活动亚组(P值均<0.05)。SLE组、活动亚组、非活动亚组患者外周血TRAIL+NK细胞比例显著高于对照组,活动亚组TRAIL+NK细胞比例显著高于非活动亚组(P<0.01,0.05)。PBMC经与K562细胞系共培养后行流式细胞术分析,结果显示:SLE组、非活动亚组CD107a+NK细胞比例显著低于对照组(P<0.01),活动亚组SLE患者CD107a+NK细胞比例与对照组的差异无统计学意义(P=0.446),但显著高于非活动组(P<0.01)。见表2。

表2 SLE患者外周血表达不同类型受体的NK细胞比例 [M(P25,P75), %]
2.4 合并感染的SLE患者外周血表达不同类型受体的NK细胞比例 感染亚组SLE患者外周血CD3-CD56+NK、TRAIL+NK和CD107a+NK细胞比例与非感染亚组的差异无统计学意义(P值均>0.05);感染亚组外周血CD16+NK细胞比例显著低于非感染亚组(P<0.05)。见表3。

表3 合并感染的SLE患者外周血表达不同类型受体的NK细胞比例 [M(P25,P75), %]
2.5 SLE患者外周血表达不同类型受体的NK细胞比例与疾病活动的相关性 Spearman相关性分析显示,SLE患者外周血CD3-CD56+NK细胞比例与SLEDAI评分呈显著负相关(r=-0.598 7,P<0.001),与补体C4水平呈显著正相关(r=0.391 4,P<0.05)。CD16+NK细胞比例与SLEDAI评分(r=-0.403 4)、24 h尿蛋白定量(r=-0.338 1)均呈显著负相关(P值均<0.05),与补体C3(r=0.357 7)、补体C4(r=0.414 7)水平均呈显著正相关(P值均<0.05)。CD107a+NK细胞比例与补体C3(r=-0.485 8)、补体C4(r=-0.354 4)水平呈显著负相关(P值均<0.001),与SLEDAI评分(r=0.764 7)、24 h尿蛋白定量(r=0.680 2)呈显著正相关(P值均<0.001)。TRAIL+NK细胞比例与SLEDAI评分呈显著正相关(r=0.463 7,P<0.01)。
3 讨 论
SLE是一种因免疫系统功能紊乱导致组织和器官损害的自身免疫性疾病。NK细胞作为固有免疫系统主要成员之一,无需激活即可攻击缺少MHC Ⅰ类“自我”标记的细胞,亦能经与受体结合被激活,以分泌促炎性细胞因子、颗粒酶和穿孔素等发挥细胞杀伤功能;同时,NK细胞还能够对CD4+和CD8+T淋巴细胞、髓样细胞和树突状细胞(DC)等免疫细胞发挥细胞毒性作用[8]。在SLE患者中,活化的NK细胞亚群比例较高,抑制性NK细胞亚群比例较低。在疾病条件下,NK细胞可以实现自我更新,分泌细胞因子,促进未成熟的NK细胞从骨髓和(或)淋巴结中释放,并表现为分化程度较低的表型。因此,在靶组织中潜在积累的促炎性NK细胞可能是导致SLE患者疾病进展的风险因素之一[12-14]。
本研究证实,与对照组相比,SLE组患者外周血中的NK细胞比例显著降低,非活动亚组患者的外周血NK细胞比例显著低于活动亚组。这与Hudspeth等[15]和Zwirner等[16]针对SLE患者免疫细胞的研究结果相符。SLE患者NK细胞比例降低,提示NK细胞可能参与了SLE疾病的发生、发展,NK细胞比例降低可能与疾病活动所致的NK细胞分化缺陷,细胞因子分泌诱导细胞凋亡,以及用药情况显著相关[8,16-18]。这提示SLE患者外周血NK细胞比例的变化可显著影响其细胞功能。
ADCC途径是NK细胞发挥细胞杀伤功能的主要机制之一[8]。CD16作为NK细胞ADCC机制中的主要表面受体,在ADCC细胞杀伤功能中起着重要作用。本研究结果显示,SLE组外周血中CD16+NK细胞比例显著低于对照组;活动亚组SLE患者CD16+NK细胞比例显著低于非活动亚组;同时,合并细菌感染组的SLE患者CD16+NK细胞比例亦显著低于未合并感染组。相关结果提示,SLE患者外周血中的NK细胞受到疾病活动及感染所致的内环境紊乱影响,细胞存在成熟障碍或死亡增多,故其杀伤功能受到显著影响。
NK细胞还可通过表达TNF超家族成员(如TRAIL与TRAILR结合)而诱导靶细胞凋亡,TRAIL亦是NK细胞活化的重要标志之一。研究[19-21]结果显示,在SLE患者外周血PBMC中,TRAIL表达水平升高,相继可引起易感细胞凋亡,致使凋亡小体产生增多,进而激活DC和T、B淋巴细胞,导致免疫系统功能紊乱。本研究发现,SLE组患者TRAIL+NK细胞比例显著高于对照组,活动亚组患者TRAIL+NK细胞比例亦显著高于非活动亚组,这与其他相关研究[20,22]结果相符。
NK细胞的另一个杀伤机制是通过释放穿孔素或颗粒酶促进细胞裂解,诱导细胞凋亡。当NK细胞识别靶细胞后,其细胞内可释放包装有穿孔素和颗粒酶的细胞毒性颗粒至靶细胞形成的免疫突触中。在突触中,穿孔素介导将颗粒酶递送至靶细胞胞质内,并最终将其运送至靶胞质溶胶中以杀伤靶细胞。CD107a也称为溶酶体相关膜糖蛋白1(LAMP-1),主要位于溶酶体膜上,其已被证明是淋巴细胞脱颗粒的标志物[23]。随着脱颗粒反应的发生,溶酶体被释放,CD107a被转运至NK细胞表面,易与抗体结合。在本研究中,SLE患者CD107a+NK细胞比例显著低于对照组,提示SLE患者外周血NK细胞胞内可能存在细胞毒颗粒含量减少的现象,致使细胞毒功能和杀伤功能受损,这与Cruz-González等[24]的研究结果相符,且细胞毒颗粒形成于NK细胞成熟的晚期[25]。由此推测,NK细胞细胞毒颗粒变化与SLE患者疾病活动所致的NK细胞分化缺陷相关[8]。活动亚组SLE患者的CD107a+NK细胞比例显著高于非活动亚组,推测其可能与疾病活动时体内炎症反应的增加,以及免疫复合物形成的增多相关,其可导致NK细胞免疫反应和活性增强,从而激活多种凋亡诱导途径(如穿孔素或颗粒酶),进一步介导的NK细胞毒性的改变[26]。
本课题组进一步对SLE患者外周血NK细胞比例、CD16+NK细胞比例、CD107a+NK细胞比例和TRAIL+NK细胞比例与SLEDAI相关性进行分析,发现SLE外周血NK细胞比例、CD16+NK细胞比例和CD107a+NK细胞比例与SLEDAI评分及其相关评分指标存在明显相关性。笔者推测,NK细胞的细胞毒功能变化,主要与ADCC途径及细胞脱颗粒水平显著相关,是影响SLE疾病活动程度的重要机制。这也提示在对疾病活动的评估方面,CD16、CD107a和TRAIL具有一定的参考价值,或可作为临床观察SLE疾病的活动程度的参考指标。
综上,SLE患者外周血NK细胞比例减少,细胞毒功能受损,这与疾病活动程度密切相关。建议在SLE患者治疗过程中,监测相关指标,或可为评估病情活动程度提供更具临床价值的新的参考。但本研究样本量较少,尚存在一定的局限性,有待进一步扩大样本量进行深入研究。

