免疫检查点抑制剂相关肾损伤的临床病理学表现:一项单中心回顾性队列研究
金 是 沈子妍 李 捷 李 芳 朱启帆 章晓燕 丁小强 刘 红
免疫检查点抑制剂(immune checkpoint inhibitor, ICI)是一类新型的免疫治疗药物,其显著改善了多种恶性肿瘤的疗效和预后[1-2]。ICI通过靶向结合T淋巴细胞、其他免疫细胞和肿瘤细胞上表达的抑制性受体,以增强机体对肿瘤的免疫反应[3]。然而,ICI的抗肿瘤活性在一定程度上以改变自身免疫状态为代价,这种现象被称为免疫相关不良事件(immune-related adverse event, irAE)[4]。在接受ICI治疗的患者中,irAE的发生率约为60%~85%;皮肤、胃肠道和肝脏是最常受累的器官。近年来,随着ICI应用的普及,临床上有关肾脏受累病例的报道逐渐增多。ICI相关肾脏病变的类型多样,以免疫检查点抑制剂相关急性肾损伤(ICI-AKI)最为常见,发生率为1.4%~4.9%[5]。此外,ICI还可引起各种类型的肾小球疾病,但多为个案报道[6-11]。目前,尚无针对肾脏irAE规范的诊断和治疗方案。本文回顾了本中心ICI相关肾损伤患者的肾脏病理学活组织检查(简称活检)资料,探讨其临床表现与病理学特征,从而使临床医师更全面、深入地了解ICI相关肾损伤的特点,以制订相应的诊疗方案。
1 对象与方法
1.1 研究对象 回顾性分析2020年1月—2021年4月在复旦大学附属中山医院住院并行肾脏病理学活检的8例患者资料,其中男7例、女1例。纳入标准:有恶性肿瘤病史,曾使用ICI治疗。本研究经医院伦理委员会审核批准(审批号:B2021-346R),所有患者均签署知情同意书。
1.2 观察指标 ①病史:患者临床病史资料、恶性肿瘤诊疗史、使用ICI的名称、用药时间和剂量。②尿液检查:尿常规、24 h尿蛋白定量、尿微量白蛋白/尿肌酐之比值(ACR)。③血液检查:血常规、肝功能、免疫球蛋白、自身抗体等。④肾功能:根据EPI公式计算估算的肾小球滤过率(eGFR)。肾病范围蛋白尿定义为24 h尿蛋白定量>3.5 g,非肾病范围蛋白尿定义为24 h尿蛋白定量为>0.5~3.5 g。急性肾损伤(AKI)的定义和分期参考改善全球肾脏病预后组织(KDIGO)标准[12],即7 d内血清肌酐(sCr)增加50%或48 h内增加26.5 μmol/L或少尿。sCr升高至患者自身基线值的1.5~1.9倍为1期AKI,升高至2.0~2.9倍为2期AKI,升高至3.0倍或升高至353.6 μmol/L或开始行肾脏替代治疗为3期AKI。CKD定义为eGFR<60 mL/(min·1.73 m2),且该值持续至少3个月。
1.3 肾脏病理学活检 纳入患者在超声引导下行经皮肾脏穿刺活检。穿刺得到的肾组织标本分别行免疫荧光染色检查[指标包括免疫球蛋白(IgG、IgA、IgM、IgG1、IgG2、IgG3、IgG4),补体(C3、C4、C1q),血清游离轻链(κ、λ链),磷脂酶A2受体(PLA2R),抗1型血小板反应蛋白7A域(THSD7A)]、光学显微镜(简称光镜)检查[项目为H-E染色、过碘酸希夫(PAS)染色、Masson染色、过碘酸六胺银(PASM)染色],以及透射电子显微镜(简称电镜)检查。
1.4 随访 确诊AKI的患者需每月进行随访。根据美国退伍军人管理局和美国健康研究院急性肾衰竭研究网络(acute renal failure trial network, ATN)的标准对患者肾脏预后进行判断:完全恢复指患者出院时sCr≤基础值以上44 μmol/L;部分恢复指出院时sCr>基础值以上44 μmol/L,但低于AKI期间的最高sCr值,且出院时脱离肾脏替代治疗;未恢复指出院时sCr未下降或仍需肾脏替代治疗。
1.5 统计学处理 应用SPSS 24.0统计学软件。计数资料以平均数、中位数及其范围表示。
2 结 果
2.1 一般情况 纳入患者行肾脏病理学活检时的平均年龄为59.6岁(范围45.0~73.0岁)。8例患者中,原发肿瘤为肺癌和肝癌的各2例,胃癌、宫颈癌、胸膜滑膜肉瘤和结肠癌各1例;3例患者(3/8)使用纳武利尤单抗(nivolumab)治疗,3例患者(3/8)使用卡瑞利珠单抗(camrelizumab),1例患者(1/8)使用信迪利单抗(sintilimab),1例患者(1/8)使用帕博利珠单抗(pembrolizumab)。1例患者肿瘤治疗前有CKD病史,4例(4/8)患者有高血压病史,2例(2/8)患者有糖尿病病史。见表1。
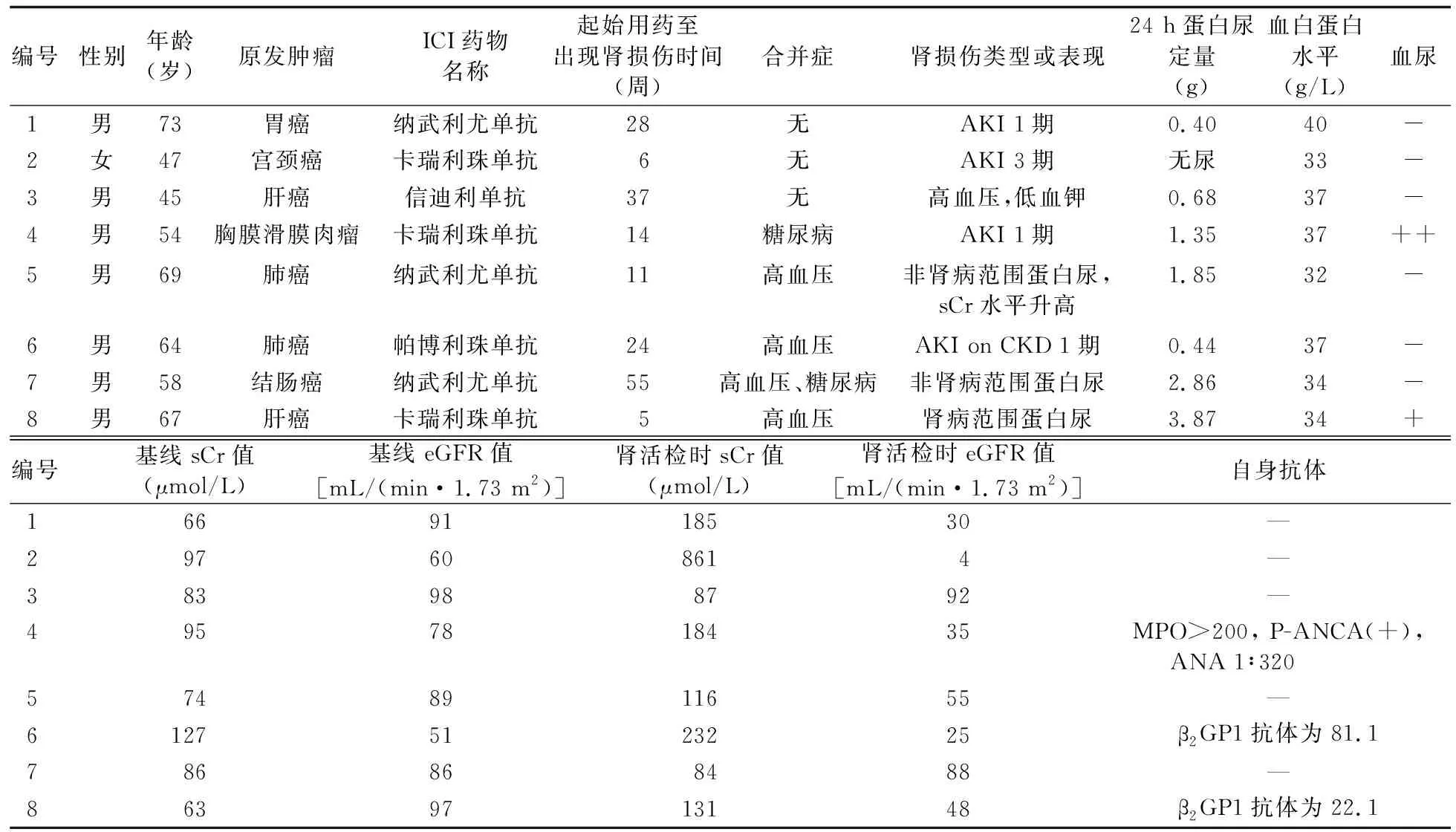
表1 ICI相关肾损伤患者的临床特征和实验室检查结果
2.2 临床表现 表1总结了8例患者的临床特征和实验室检查结果。4例患者在肿瘤治疗期间出现AKI,其中1例为AKI on CKD;1例患者AKI分期为3期,余3例患者均为AKI 1期。其他4例患者中,2例为非肾病范围蛋白尿,1例为肾病范围蛋白尿,1例表现为新发高血压合并低钾血症。8例患者起病距ICI起始治疗的平均时间为22.5周(范围5.0~55.0周)。8例患者的24 h尿蛋白定量中位值为1.35 g(范围0.40~3.87 g),基线sCr中位值为84.5 μmol/L(范围63.0~127.0 μmol/L),基线eGFR中位值为87.5 mL/(min·1.73 m2)[范围51.0~98.0 mL/(min·1.73 m2)],肾活检时sCr中位值为157.5 μmol/L(范围84.0~861.0 μmol/L),肾活检时eGFR中位值为41.5 mL/(min·1.73 m2)[范围4.0~92.0 mL/(min·1.73 m2)]。2例存在镜下血尿。8例患者中,3例患者伴有自身免疫指标的异常,2例β2GP1抗体呈阳性,1例P-ANCA、MPO和ANA呈阳性。
2.3 肾脏病理学表现 患者详细的病理学诊断结果见表2。8例患者中,6例存在急性肾小管间质性肾炎(ATIN),其中2例为单纯ATIN,表现为肾间质水肿、炎症细胞浸润,偶见少量嗜酸性粒细胞,伴急性肾小管损伤,无明显肾小球病变(图1A~C)。其余4例患者为ATIN合并肾小球病变,2例为局灶节段性肾小球硬化(FSGS),1例为血栓性微血管病(TMA),1例为高血压肾病。其中1例患者使用卡瑞利珠单抗后,出现血P-ANCA阳性,MPO高滴度阳性,ANA滴度为1∶320(+),但患者无上呼吸道、肺、皮肤损害等系统性血管炎的临床表现;光镜下肾活检组织全片的40个肾小球均未见新月体形成或坏死性病变,而以足细胞增生、肾小球球门部与球囊壁粘连和节段性硬化为主要病理学表现,合并ATIN和急性肾小管坏死;电镜下见肾小球节段性硬化,上皮足突部分融合伴部分微绒毛形成;因此,考虑该患者为ICI相关FSGS伴ATIN(图1D~F)。
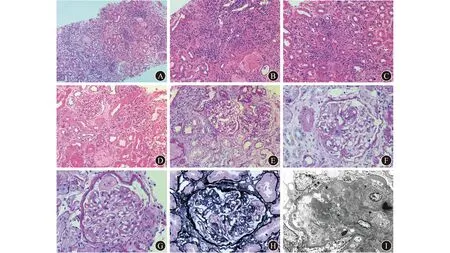
A~C ICI相关ATIN 肾小球形态正常,肾间质水肿,大量炎症细胞浸润并聚集成团,以单核细胞浸润为主(A为H-E染色,×100; B和C为H-E染色,×200) D~F ICI相关FSGS伴急性间质炎症 肾小球节段性硬化,毛细血管袢和球囊壁有黏连,细动脉呈玻璃样变;肾脏间质水肿,炎症细胞浸润,可见少量嗜酸性粒细胞(D为H-E染色,×200; E和F为PAS染色,×400)G~I ICI相关TMA 内皮细胞肿胀、脱落,毛细血管袢扩张,内皮下嗜复红蛋白沉积,毛细血管袢壁增厚、疏松、透亮,双轨形成(G为PAS染色,×400; H为PASM染色,×400;I为透射电镜检查)图1 ICI相关肾损伤患者的肾脏病理学表现

表2 ICI相关肾损伤患者的肾脏病理学表现
8例中另有2例患者以肾小球病变为主,免疫荧光染色提示多种免疫球蛋白和补体成分沉积于肾小球,系膜区及内皮下有较多免疫复合物沉积,系膜、毛细血管内均有不同程度增生,内皮细胞肿胀、脱落,基底膜透亮,形成双轨等典型TMA样表现,肾脏小管间质病变不明显。结合患者无其他自身免疫性疾病的临床表现,自身抗体呈阴性,补体处于正常范围,临床上排除了系统性红斑狼疮等自身免疫性疾病,基于患者病史考虑诊断为ICI相关TMA伴免疫复合物介导的肾小球疾病(图1G~I)。
2.4 治疗和预后 8例患者在肾活检后均中止ICI治疗,其中5例患者接受糖皮质激素治疗。以AKI起病的4例患者均接受甲泼尼龙静脉冲击治疗和续贯口服半量的糖皮质激素[泼尼松0.5 mg/(kg·d)]治疗。随访期内有2例患者肾功能恢复至正常水平,2例患者肾功能部分恢复。患者用药与肾脏恢复情况见表3。
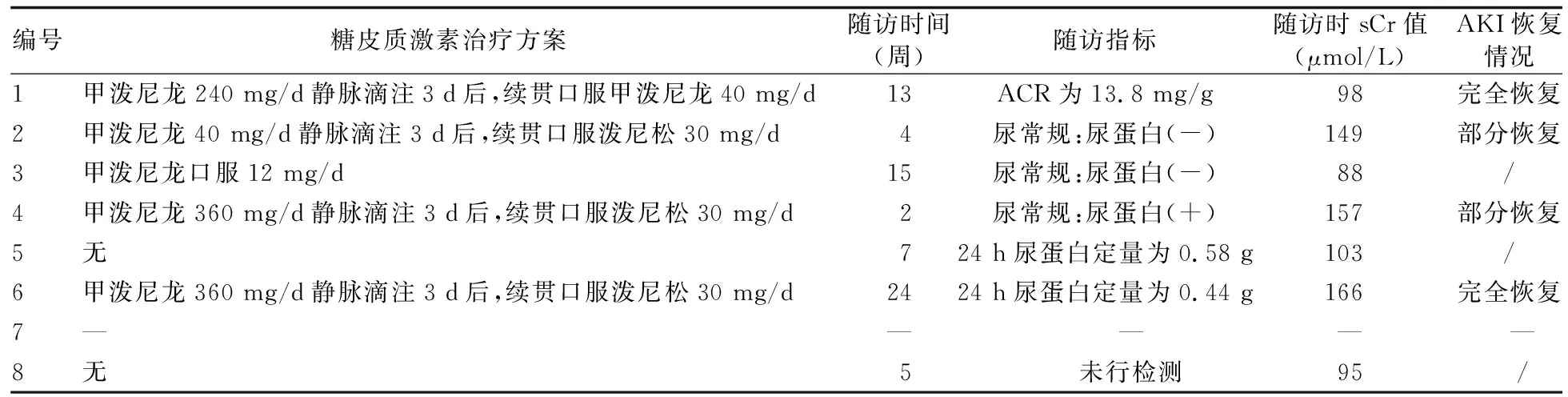
表3 ICI相关肾损伤患者的治疗与随访情况
3 讨 论
在既往病例报告和系列研究中,ICI相关肾损伤最常见的临床表现为AKI,最常见的组织病理学类型为ATIN[13]。近年来,有零星的研究报道了ICI引起的几种不同病理学类型的肾小球疾病,目前国内相关报道罕见。
ATIN是最常见的ICI相关肾损伤病理学表现,其机制可能是诱导潜伏状态药物的特异性效应T淋巴细胞的再活化;另一种可能的机制是在阻断细胞毒性T淋巴细胞相关抗原(cytotoxic T-lymphocyte antigen 4, CTLA-4)或程序性细胞死亡蛋白1(programmed death protein 1,PD-1)途径后,机体丧失了自我耐受性和抗原识别能力,而对肾脏自身抗原产生自身免疫反应。ICI相关ATIN的病理学表现与常见的药物过敏性急性间质性肾炎基本相似。有研究[14]显示,ICI相关AKI均可见肾小管表达程序性死亡蛋白配体-1(programmed death protein-ligand 1, PD-L1),但肾组织表达PD-L1能否作为ICI相关AKI的易感因素或诊断指标还有待进一步研究证实。在一项纳入13例ICI相关AKI患者的肾活检研究中[5],有12例病理学表现为ATIN,其特征为间质弥漫性T淋巴细胞浸润,其中3例伴有肉芽肿形成,而浆细胞和嗜酸性粒细胞浸润少见。在本研究中,6例的患者肾组织病理学表现为ATIN,2例为单纯的急性间质性肾炎,间质弥漫炎症细胞浸润,嗜酸性粒细胞浸润少见,与文献报道类似,另有4例同时伴有肾小球病变。患者ICI起始治疗至肾损伤起病的间隔时间与肾间质炎症的急慢性程度无直接相关性。文献[15]结果显示,ICI相关急性间质性肾炎通常发生在ICI启动后的12~14周;但也有研究[16]报道,AKI可以发展得更早或更晚(甚至在中断ICI治疗后的数月至1年以上)。因此,对于有ICI治疗史的患者,在发生AKI时建议尽早行肾穿刺活检以明确肾间质炎症的病变情况和程度,以避免不必要的糖皮质激素暴露。
免疫治疗相关的肾小球病变相对少见。一项研究[17]系统性回顾了27篇文献,这些文献共纳入45例经活检证实为ICI相关肾小球病变的患者资料,其中最常见的类型为寡免疫性肾小球肾炎伴血管炎(27%),其次为足细胞病变(包括微小病变和FSGS,24%)和C3肾小球病(11%),伴有ATIN的占41%。Mamlouk等[18]报道了16例使用ICI后行肾活检的患者,仅5例表现为急性间质性肾炎,其余病例均表现出各种类型的肾小球病变,包括寡免疫性肾小球肾炎、FSGS、IgA肾病、膜性肾病、C3肾小球病和AA型淀粉样变性。但目前尚不清楚这些肾小球疾病患者是否在ICI治疗前已有肾脏疾病的临床或实验室证据,或者这些肾小球病变是否与治疗有关。在本研究中,8例患者中有6例存在肾小球病变,包括3例TMA,2例FSGS,1例高血压肾病。其中1例患者临床表现为CKD基础上伴发AKI,经肾脏病理学活检证实为ATIN合并高血压肾病,提示有肾小球肾炎基础疾病的患者可能更易产生ICI诱发的肾小管间质损伤。1例患者临床表现为AKI合并MPO高滴度和P-ANCA阳性,经肾脏病理学活检证实为FSGS伴ATIN,而无抗中性粒细胞胞质抗体(ANCA)相关性血管炎的病理学表现。因此对于使用ICI后出现肾损伤且合并血清ANCA阳性时,不能简单地诊断为ANCA相关性血管炎而启动免疫抑制治疗,应及时进行肾活检以明确肾脏病理学表现。相关研究显示,ICI暴露至诊断为肾小球疾病的中位时间为3个月,肾小球疾病可在ICI治疗后的7个月,甚至在停药数月后才发生。与AKI不同,ICI相关肾损伤以肾小球病变为主时,病变有时比较隐匿,表现为不同程度的蛋白尿或镜下血尿,易被忽略。在本研究中,存在肾小球疾病的6例患者表现为不同程度的蛋白尿(0.44~3.87 g/24 h),伴或不伴血尿。因此,在开始ICI治疗时及ICI治疗过程中,建议密切随访患者,进行尿液追踪分析,尽早发现可能存在的ICI相关肾损伤。随着ICI应用的普及,ICI相关肾小球病变尤其是TMA病变的报道日益增多,值得临床高度重视。
本研究存在一定的局限性。首先本研究为单中心、回顾性研究,缺乏对患者ICI治疗前的基线尿液分析数据,因此无法完全排除ICI治疗前,患者即存在的潜在肾脏病变。此外,使用ICI的患者往往合并其他抗肿瘤药物治疗史,并不能完全排除其他药物引起的肾损伤。因此,需要肾内科医师与肿瘤科医师进一步沟通与合作,进行更大样本量的前瞻性研究,评估患者基线、启动ICI、药物毒性发生和消除时的尿蛋白和肾功能情况,以进一步了解肿瘤患者肾脏irAE发生率,以及对ICI治疗的反应。

