黄水加碳酸钙粉末培养过程中理化性质和菌群组成的变化规律
王艳丽,张会敏,李安军*,孟雅静,刘国英,王录,丁峰,周庆伍,梁金辉
(1.安徽古井贡酒股份有限公司,安徽亳州 236820)(2.安徽省固态发酵工程技术研究中心,安徽亳州 236820)
浓香型白酒的生产是在窖池中进行的固态发酵,酒醅是浓香型白酒发酵的主体,发酵过程中微生物代谢形成的水、醇、酸、酯、糖等各种成分互溶形成液态黄水[1,2]。黄水作为浓香型白酒发酵过程中唯一的液态相,其中充满了各种营养物质,其为浓香型白酒发酵过程中包括酒醅菌群和黄水菌群之外的窖泥菌群生长提供营养物质。窖泥被公认是在浓香型白酒发酵过程中的厌氧菌群释放源[3-5],另一方面,由窖泥菌群产生的代谢物质反过来又丰富了酒醅中的风味物质[4]。实际上,一些窖泥源的菌属确实被发现在发酵过程中迁移到底层酒醅中,也就是黄水所在的位置[4]。随着发酵的进行,窖泥与黄水共有的菌属丰度呈现递增趋势[6],比如黄水中的Caproiciproducens,Sedimentibacter和古菌被认为随着窖龄增大而增加[1,2,7];而实际上,以上3 种菌属在窖泥中的丰度也随着窖龄增大而增加[8]。可知,黄水菌群与窖泥菌群是相互影响,相互促进的。
由窖泥“退化”所引起的酿酒质量下降是酿酒界所关心的问题。与正常窖泥相比,“退化”窖泥的pH 值偏低,菌群组成以乳酸杆菌为主[5],而且经常出现白色团块析出[5],甚至钙化板结的现象[9]。王艳丽等[10]也证实“退化”窖泥中钙元素含量显著较高。有研究证实窖泥的白色团块主要为乳酸钙[11]。张会敏等[12]通过分析分层池底窖泥中的钙元素证实窖泥中白色团块析出与窖泥中乳酸与碳酸钙之间的反应有密切关系。仲几晓等[13]通过乳酸强化实验证实乳酸的额外加入导致窖泥中灰白色团块析出,进一步证实其中乳酸与碳酸钙的反应对窖泥“退化”的影响。浓香型白酒发酵过程中,乳酸含量高达60.00~80.00 g/L 的黄水对窖泥具有重要影响,其影响分别表现在两者菌群和理化指标的相互影响上[14]。因此,有必要深入分析“退化”窖池中,黄水菌群和黄水理化性质的变化规律,为深入分析“退化”窖泥的变化提供理论依据。
基于此,本研究选择新、老窖池黄水为研究对象,分别向其加入适量和过量碳酸钙粉末,模拟新老窖池黄水中发生的碳酸钙与乳酸之间的反应,研究静置培养过程中黄水理化性质和菌群组成的变化。为分析窖泥“退化”过程中黄水菌群变化和理化性质变化对窖泥的影响提供理论依据。
1 材料与方法
1.1 材料与试剂
黄水样本采自安徽知名某浓香型白酒企业;Omega D5625 土壤DNA 提取试剂盒Omega bio-tek 公司。
1.2 仪器与设备
Agilent 6890 气相色谱仪(配CP-WAX 57 CB 色谱柱50 m×0.25 mm×0.2 μm),美国Agilent 公司;Acquity UPLC 液相色谱(配PDA 二极管阵列检测器和 Waters HSS T3 色谱柱100 mm×2.1 mm×1.8 μm),美国 Waters 公司;ICS5000+离子色谱仪(配ICS-5000+-DC 电导检测器),ThermoFisher 公司;紫外可见分光光度计(TU-1810S),北京普析通用分析仪器有限公司;高速冷冻离心机,德国赛多利斯公司;PCR 仪,美国Thermo 公司;MiSeq-PE-250 高通量测序仪,美国Illumina 公司。
1.3 方法
1.3.1 样本采集与试验方法
选取连续正常使用、发酵工艺相同的新窖池(窖龄6 年)和老窖池(窖龄大于50 年)各3 个,于发酵结束时分别抽取新鲜黄水。取新鲜新窖池、老窖池黄水分别加入适量(质量体积比,1.50 g/100 mL,即加入的碳酸钙粉末完全溶于黄水)和过量(质量体积比,3.00 g/100 mL,即加入的碳酸钙粉末部分溶于黄水,有沉淀)的碳酸钙粉末,然后进行封闭静置培养,并于培养3 天(3 d)、1 周(1 W)、2 周(2 W)、3 周(3 W)、4 周(4 W)、6 周(6 W)和2 个月(2 M),检测黄水发酵液理化性质,每样本三个重复,共84 个样本。于培养1 W~2 M 时,检测黄水发酵液菌群多样性,每样本三个重复,共72 个样本。
黄水培养过程中样本的标记以黄水窖龄和碳酸钙粉末量组合标记,其中用YHS 和OHS 分别表示新窖池黄水和老窖池黄水,用_MO 和_EX 分别表示加入适量和过量碳酸钙粉末。如需标记发酵时间,则在黄水发酵液的编号后面标记具体培养时间如:_3 d、_1 W或_2 M 等。编号YHS_MO_1 W 为新窖池黄水加适量碳酸钙粉末后培养1 周的发酵液。
1.3.2 理化性质分析
pH 值检测使用pH 计(FE20)直接测量。铵态氮检测采用紫外分光光度计法[15]。淀粉和还原糖测定采用反滴定法[14]。乳酸和Ca2+浓度测定,将黄水样本与去离子水按1:9 体积比混匀,过0.22 μm 滤膜得待测滤液,然后用液相色谱检测乳酸含量[14],用离子色谱检测Ca2+浓度[8];己酸、丁酸和乙酸测定,将黄水样本与15%甲醇溶液按照1:9 体积比混匀,过0.22 μm滤膜得待测滤液,然后用气相色谱检测[16]。
1.3.3 DNA 提取与Illumina 高通量测序使用Omega 土壤DNA 试剂盒(D5625)提取黄水菌群的DNA。由上海派森诺生物科技股份有限公司进行Illumina MiSeq 高通量测序16S V4 可变区,扩增引物、扩增体系与扩增程序参考[14]。PCR 扩增产物经纯化后,Quant-iT PicoGreen dsDNA Assay Kit 荧光定量,构建克隆文库(TruSeq Nano DNA LT Library Prep Kit,Illumina),经Agilent 2100 Bioanlyzer 检验DNA文库合格后,Illumina MiSeq 双向测序(MiSeq Reagent Kit V3)。
1.3.4 数据处理与统计学分析
运用QIIME(v1.8.0)识别疑问序列。要求序列长度≥160 bp,且不允许存在模糊碱基N,并剔除:(1)5’端引物错配碱基数>1 的序列;(2)含有连续相同碱基数>8 的序列。然后,通过QIIME 软件(v1.8.0)调用USEARCH(v5.2.236)检查并剔除嵌合体序列,利用FLASH(v1.2.7)软件,对通过质量初筛的双端序列根据重叠碱基进行配对连接。调用UCLUST,对获得的优质序列按97%的序列相似度进行OTU 划分,并选取OTU 中丰度最高的序列作为代表序列。采用Silva 数据库(Release132)注释各代表序列,作为代表OTU 的注释结果。去除丰度值低于全体样本测序总量0.001%的OTU,并根据OTU 丰度矩阵,使用QIIME(v1.8.0)软件计算Shannon、Chao1 等菌群多样性参数。差异显著性分析通过SPSS(25.0)方差分析(ANOVA)实现。
2 结果与讨论
2.1 理化性质
黄水中本身富含丰富的淀粉、还原糖、铵态氮、有机酸及各种离子等。而在加入适量或过量碳酸钙粉末后进行静置培养过程中,伴随着其中微生物的生长代谢,理化性质也发生变化。
2.1.1 pH 值
pH 值变化规律如图1 所示。pH 值呈现增加(3 d~4 W,4.27~4.58→4.94~5.29)后降低(4 W~2 M,4.94~5.29 →4.01~4.59)趋势。培养3 d~3 W,pH 值无显著变化(p˃0.05);培养4 W 时,pH 值呈现最高值(4.94、5.00、5.13 和5.29),推测可能到第4 W 时碳酸钙与乳酸等有机酸的反应达到最高点,酸性降到最低值;培养6 W~2 M,加入适量碳酸钙粉末的两组样本pH值显著降低,2 M 时呈现最低值(4.02、4.03),而加入过量碳酸钙粉末两组样本的pH 值恢复至前3 W 水平(4.43、4.59),推测可能与碳酸钙粉末反应殆尽,黄水菌群代谢生成更多乳酸有关。加适量与过量碳酸钙黄水相比,后者pH 值相对更高,3 d~4 W 时(4.27~4.39→4.94~5.00 vs 4.51~4.58→5.12~5.29)无显著差异,6 W~2 M(4.16~4.23→4.01~4.03 vs 4.56~4.57→4.43~4.59)呈显著差异(p<0.05)。此外,新、老窖池黄水相比,pH 值无显著差异(p˃0.05)。表明加适量或加过量碳酸钙对新老窖池黄水pH 值在短时间(3 d~4 W)内有调节作用,但经过长时间培养后,调节能力减弱,pH 值仍会降低,甚至低于培养第3 d 的黄水pH 值(YHS_MO 和OHS_MO)。这与胡晓龙[17]研究发现与正常窖泥相比,退化后窖泥pH 值(6.18 vs 4.57)显著降低,结论一致。而且黄水加碳酸钙经过2 个月培养其pH 值(4.01~4.59)与已知退化窖泥的pH 值(4.10~5.60)基本一致[18]。

图1 4 组黄水样本在2 个月培养过程中pH 值变化 Fig.1 The pH values change of 4 groups of HS samples during two-month culturing (means ± standard deviation,n=3)
2.1.2 淀粉与还原糖
淀粉(图2a)与还原糖(图2b)变化规律如图2所示。淀粉(1.23~1.57 g/100 mL→0.64~0.84 g/100 mL)与还原糖(0.38~0.58%→0.16~0.21%)均呈波动减少趋势。推测与黄水菌群代谢淀粉和还原糖有关。已知曲霉属、毛霉和根霉等丝状真菌具有分解淀粉生成还原糖的功能[19],而黄水中富含一定量的曲霉属[1]。此外黄水中的其他细菌如Lactobacillus、Clostridium和Acinetobacter等以及真菌如Pichia等[20],具有把还原糖转化为如乳酸[19]、乙酸和酒精等[21]的功能。加适量与加过量碳酸钙黄水相比,淀粉和还原糖在各时间段的含量基本一致。新、老窖池黄水相比,淀粉与还原糖平均含量均基本相当,推测与培养过程中新老窖池黄水中优势菌属的相对丰度基本相当有关。而培养第3 d 老窖池黄水中淀粉(1.23~1.25 g/100 mL vs 1.46~1.57 g/100 mL)和还原糖(0.38~0.39% vs 0.53~0.58%)显著更低(p<0.05)。可能与老窖池黄水中固有好氧细菌和真菌(霉菌属和酵母菌属)相对丰度更高[1],且在培养初期,黄水中含一定量的氧,利于好氧细菌和真菌的生长,因此会呈现暂时的淀粉和还原糖消耗更多,含量偏低。张会敏等[14]直接对黄水进行静置培养5 个月后,其中的淀粉(1.6~1.7%→ 0.88~1.02%)和还原糖(0.59~0.60%→0.27~0.34%)降低,与本结论一致。表明加碳酸钙对黄水培养过程中优势菌属的基本代谢无明显影响。且与黄水直接培养相比,黄水加碳酸钙经2 个月培养淀粉和还原糖消耗更多。说明黄水加碳酸钙培养可能在一定时间内使菌群生长更旺盛。

图2 4 组黄水样本在2 个月培养过程中淀粉与还原糖含量变化 Fig.2 The starch and reducing sugar change of 4 groups of HS samples during two-month culturing
2.1.3 钙离子
Ca2+浓度的变化规律如图3 所示。新老窖池黄水Ca2+浓度均有增加(4.83~6.32 g/L→5.54~8.89 g/L),推测与黄水中有机酸尤其是乳酸与碳酸钙反应生成易溶于水的乳酸钙,已知乳酸钙的溶解度超过20 g/L[22]。但加适量碳酸钙的两组黄水中Ca2+浓度呈现增加(3 d~1 W,4.83~5.06 g/L→5.31~5.86 g/L),然后基本稳定(2 W~2 M,5.75~5.94 g/L→5.53~5.89 g/L)的趋势;而加过量碳酸钙的两组黄水中Ca2+浓度呈稳定增加(3 d~2 M,5.20~6.33 g/L→8.73~8.89 g/L)趋势。推测加适量碳酸钙的黄水在培养3 W时碳酸钙可能基本被有机酸反应完全,而加过量碳酸钙的黄水中碳酸钙与乳酸反应仍在继续进行有关。新老窖池黄水相比,Ca2+浓度基本相当。表明碳酸钙对新老窖池黄水中Ca2+浓度增加有促进作用,且加入的碳酸钙含量越高,Ca2+浓度增加越显著。王艳丽等[10]研究发现与正常窖泥相比,退化窖泥的钙含量(0.82% vs 1.37%)显著增加,与本研究结论一致。间接表明退化窖泥钙离子增加与黄水和钙盐的酸解反应有关。

图3 4 组黄水样本在2 个月培养过程中Ca2+浓度的变化 Fig.3 The Ca2+ change of 4 groups of HS samples during two-month culturing
2.1.4 铵态氮
铵态氮变化规律如图4 所示。铵态氮呈波动增加趋势(1.28~1.69 g/L→1.53~2.18 g/L),其中新老窖池黄水(1.20~1.35 g/L→1.53~1.57 g/L vs 1.61~1.69 g/L→2.13~2.18 g/L)相比,后者铵态氮含量显著更高(p<0.05)。推测与黄水加碳酸钙培养后pH 值升高至4.02~5.29,更接近产铵态氮菌属的最适pH值范围[23,24],促进了产铵态氮菌属的生长,从而使铵态氮含量升高。而老窖池黄水菌群组成[2]更丰富,可能更利于铵态氮的生成。加适量与加过量碳酸钙黄水相比,铵态氮含量无显著差异(p˃0.05)。胡晓龙[17]研究发现与正常窖泥(269.2 mg/kg)相比,退化后窖泥铵态氮含量(249.88 mg/kg)显著降低,与本研究结论相反。可能与两者菌群代谢有关,具体结合菌群组成进一步分析。
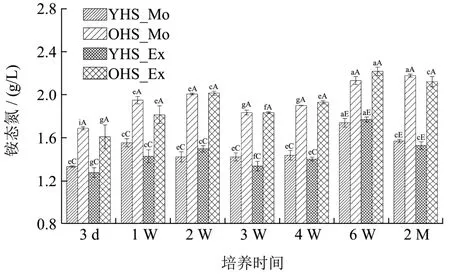
图4 4 组黄水样本在2 个月培养过程中铵态氮含量变化 Fig.4 The ammonium nitrogen change of 4 groups of HS samples during two-month culturing
2.1.5 乳酸、丁酸、己酸和乙酸
乳酸(图5a)、丁酸(图5b)、己酸(图5c)和乙酸(图5d)变化规律如图5 所示。乳酸呈现降低(3 d~1 W,62.21~64.57 g/L→54.67~57.74 g/L),再增加(1 W~2 W,54.67~57.74 g/L→64.78~69.86 g/L),再趋于稳定(2 W~6 W,64.78~69.86 g/L→66.71~68.10 g/L),然后再增加的趋势(6 W~2 M,66.71~68.10 g/L→67.93~75.30 g/L)。己酸和丁酸均呈现基本稳定(3 d~4 W)、再增加(4 W~6 W),然后再降低(6 W~2 M)的变化趋势。其中培养2 M 时,己酸恢复到第3 d水平,丁酸则更低甚至低于第3 d 水平。乙酸(4.74~5.45 g/L→5.74~9.61 g/L)呈持续增加趋势。而加适量与加过量碳酸钙黄水相比,其中乳酸、丁酸、己酸和乙酸差异基本不明显,但培养6 W 的样本OHS_Ex 除外。此外,新老窖池黄水相比,乳酸、丁酸和己酸差异基本不显著,而乙酸在老窖池黄水中显著更高(p<0.05)。表明加适量和加过量碳酸钙对新老窖池黄水的乳酸、丁酸、己酸和乙酸含量虽有波动影响,但最终于培养2 个月乳酸、乙酸增加,丁酸降低,己酸恢复至第3 d 水平。推测与培养前期碳酸钙与黄水中有机酸发生中和反应[25],导致有机酸减少,而随培养过程中黄水菌群代谢的影响,有机酸出现升降变化[26]。说明碳酸钙不利于新老窖池黄水中己酸和丁酸的生成,反而利于乳酸和乙酸的产生。余有贵等[27]研究发现退化窖池与常规窖池所产新酒相比,己酸乙酯和丁酸乙酯极显著降低,乳酸乙酯和乙酸乙酯极显著增加,说明退化窖池不利于己酸和丁酸积累,而利于乳酸和乙酸积累,与本研究结论一致。

图5 4 组黄水样本在2 个月培养过程中有机酸含量变化 Fig.5 The organic acids change of 4 groups of HS samples during two-month culturing
综上,黄水加碳酸钙经过2 个月培养,最终理化性质pH 值、淀粉、还原糖、己酸和丁酸降低,铵态氮、钙离子、乳酸和乙酸增加。与已知窖泥退化过程中理化性质变化规律基本一致,表明窖泥的“退化”与其中钙盐和黄水的作用有关。
2.2 原核微生物菌群的α-多样性
原核菌群的多样性变化规律如表1~表3 所示:四组黄水中原核菌群的OTUs(125~169→83~90)、Chao1(133.08~174.44→88.08~95.52 )和 Shannon(1.43~2.24→0.57~0.83)变化趋势基本一致,整体上呈减少趋势。而且无论是加适量与过量碳酸钙黄水相比,还是新老窖池黄水相比,OTUs 和Chao1 指数均无显著差异(p˃0.05),而Shannon 指数呈现无规律差异变化。推测加入碳酸钙后,黄水中形成过高的Ca2+浓度,不利于细菌的生长[28],致使黄水原核菌群多样性降低。其中,培养4 W 的黄水中OTUs 和Chao1 指数较前一周略高,可能与第4 W 时黄水的pH 值(4.94~5.29)出现短暂升高(图1),对菌群生长有暂时的促进作用。表明碳酸钙的加入对新老窖池黄水菌群的生长产生了不利影响,致使菌群丰富度和多样性均降低了。这与Hu[5]研究与正常窖泥相比,退化窖泥的OTUs、Chao1 和Shannon 指数显著降低,结论一致。说明退化窖泥的菌群多样性降低与退化过程中黄水的影响有关。
表1 4 组黄水样本在2 个月培养过程中原核微生物群落OTUs Table 1 The prokaryotic community OTUs of 4 groups of HS samples during two-month culturing (¯,n=3,except sample OHS_Ex_1W,n=1)

表1 4 组黄水样本在2 个月培养过程中原核微生物群落OTUs Table 1 The prokaryotic community OTUs of 4 groups of HS samples during two-month culturing (¯,n=3,except sample OHS_Ex_1W,n=1)
注:同行无连续肩标小写字母表示差异显著(p<0.05);同列无连续肩标大写字母表示差异显著(p<0.05)。样本OHS_Ex 在培养1 W 时只有一组样本检测到原核微生物菌群,无法与其他三组参数进行显著性差异分析。表2 和表3 同。
表2 4 组黄水样本在2 个月培养过程中原核微生物群落Chao1 指数 Table 2 The prokaryotic community Chao1 index of 4 groups of HS samples during two-month culturing (¯,n=3,except sample OHS_Ex_1W,n=1)
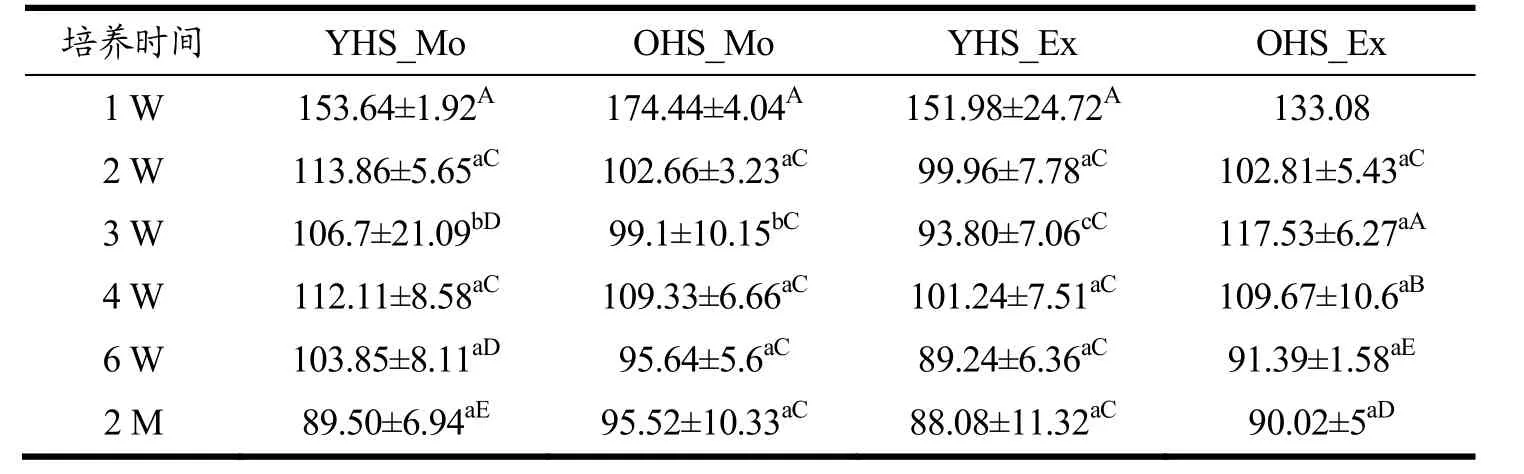
表2 4 组黄水样本在2 个月培养过程中原核微生物群落Chao1 指数 Table 2 The prokaryotic community Chao1 index of 4 groups of HS samples during two-month culturing (¯,n=3,except sample OHS_Ex_1W,n=1)
表3 4 组黄水样本在2 个月培养过程中原核微生物群落Shannon 指数 Table 3 The prokaryotic community Shannon index of 4 groups of HS samples during two-month culturing (¯,n=3,except sample OHS_Ex_1W,n=1)
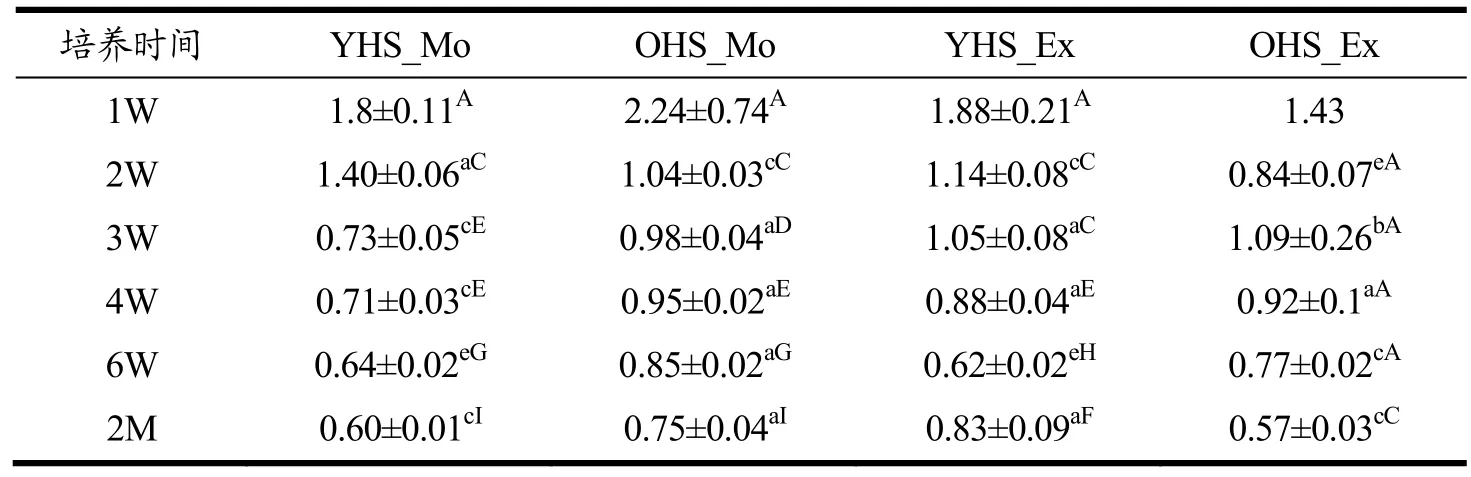
表3 4 组黄水样本在2 个月培养过程中原核微生物群落Shannon 指数 Table 3 The prokaryotic community Shannon index of 4 groups of HS samples during two-month culturing (¯,n=3,except sample OHS_Ex_1W,n=1)
2.3 原核微生物菌群的β-多样性
对OTU 注释,共得到12 个门,其中11 个细菌门,1 个古菌门。将相对丰度超过0.1%的门定义为优势菌门,共得到10 个优势菌门,如图6 所示。黄水加碳酸钙培养过程中厚壁菌门(Firmicutes)为绝对优势菌门,相对丰度占94.77%~100%,甚至3 W~2 M,Firmicutes 为唯一优势菌门(99.86%~100%)。而且无论是加适量与加过量碳酸钙黄水相比,还是新、老窖池黄水相比,其中优势菌门组成均一致,以Firmicutes为绝对优势,其中培养1 W 时的优势菌门组成除外。推测与Firmicutes在极端条件下环境适应性较强有关,比如其中的Bacillus、Clostridium和Lactobacillus等[29],在极端条件下均具有较强耐性。此外,除Firmicutes之外的非优势菌门以及未知菌/未可培养菌,只有在第1 W 呈现较大优势,与张会敏等[14]研究新老窖池黄水经过5 个月培养,优势菌门数目增加,非优势菌门转化为优势菌门,Firmicutes 相对丰度降低,结论相反。表明加碳酸钙不利于黄水中除Firmicutes 之外的其他菌门的生长。
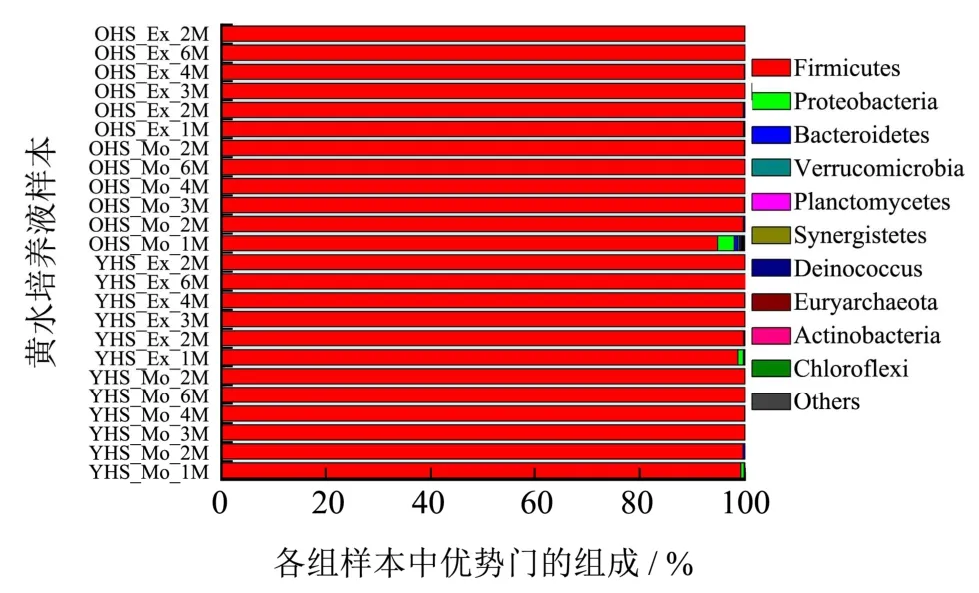
图6 4 组黄水样本在2 个月培养过程中10 个优势菌门的相对丰度 Fig.6 Relative abundance of the 12 dominant phyla in 4 groups of HS samples during two-month culturing
对OUT 注释,共得到9 个属。将相对丰度超过0.1%的属定义为优势菌属,共得到4 个优势菌属,如图7 所示。其中Lactobacillus为绝对优势菌属,相对丰度占94.48%~99.99%。培养第1 W,样本YHS_Mo、YHS_Ex 和OHS_Mo 中优势菌属除Lactobacillus(99.04%、98.51%和94.48%)外,还有苍白杆菌属(Ochrobactrum,0.11%、0.23%和0.24%)、Pelomonas(0.1%、0.14%和0.26%)和不动杆菌属(Acinetobacter,0.14%、0.19%和0.16%);样本OHS_Ex 中Lactobacillus(99.73%)为唯一优势菌属。培养2 W~2 M,Lactobacillus始终为唯一优势菌属(99.65%~99.99%)。而且无论是加适量与过量碳酸钙黄水相比,还是新、老窖池黄水相比,其中优势菌属组成均一致,以Lactobacillus为绝对优势。这与张会敏等[14]直接对新老窖池黄水进行静置培养5 个月,Lactobacillus相对丰度降低,而菌属Acinetobacter、Thermoflavimicrobium、Bacillus、Ochrobactrum、Stenotrophomonas、Caproiciproducens、Aminobacterium、Methanoculleus、Syntrophomonas和Ruminiclostridium等相对丰度增加,结论相反。进一步表明黄水加碳酸钙培养,不利于其中包括未知菌属在内的菌属的生长繁殖。

图7 4 组黄水样本在2 个月培养过程中4 个优势属的相对丰度 Fig.7 Relative abundance of the 4 genera in 4 groups of HS during two-month culturing
黄水在培养过程中,菌群组成与理化性质相互适应,相互影响。推测黄水加碳酸钙经培养菌群组成变化可能与理化性质变化有关。(1)pH 值升高至4.02~5.29(图1),与已知Lactobacillus的最适pH 值范围4.0~5.3[30,31]基本一致。(2)乳酸减少(图5a),降低了对Lactobacillus的反馈抑制作用[32]。(3)Ca2+浓度增加(图3),袁亮[28]研究证实Ca2+浓度超过150 mmol/L(即6 g/L)时,细菌几乎不生长;但闫颖娟等[33]证实在培养基中添加适量碳酸钙可以促进Lactobacillus的生长;甚至黄翔等[34]发现复合乳酸菌利用以碳酸钙为主要原料的蛋壳制备乳酸钙,产量高达40 g/L 以上,说明该条件下Ca2+浓度(约7.34 g/L)不影响Lactobacillus的生长。此外,Lactobacillus本身在黄水中的相对丰度较大(˃95%)[14],占据绝对优势,而且Lactobacillus生长代谢可产生抑菌素能抑制Clostridium、Bacillus等多种菌属的生长繁殖[35]。因此,黄水中添加碳酸钙培养,不利于除Lactobacillus外其他菌属的生长。这与胡晓龙等[5,17]研究发现“退化”窖泥相比正常窖泥,菌群组成相对更单一,Lactobacillus相对丰度显著增加,成为绝对优势菌属(91.46%),结论基本一致。进一步说明退化窖泥菌群组成的变化与退化过程中黄水影响有关。
值得讨论的一点是,新老窖池黄水加碳酸钙经培养铵态氮含量增加(图2),结合图7 分析可知,代谢产铵态氮的相关菌属不仅没有增加,反而未被检出,而且随培养时间延长,Lactobacillus很快成为唯一优势菌属,说明本研究黄水中铵态氮含量增加与Lactobacillus的生长代谢有关,有研究证实[36]铵态氮生成的主要途径是氨基酸代谢,而Lactobacillus可以合成氨基酸代谢的关键酶-谷氨酰胺合成酶(GS),因此黄水加碳酸钙培养后,随Lactobacillus的生长代谢,铵态氮含量增加,并且乙酸含量增加(图5),对Lactobacillus胞内铵浓度有促进作用。同时Lactobacillus通过氨基酸代谢实现铵离子和氨基酸的相互转化调节细胞内环境,增强Lactobacillus耐酸性[37],说明铵态氮增加反过来也助于Lactobacillus生长。而退化窖泥中铵态氮含量则是降低的,推测与窖泥退化后出现板结,阻碍了窖泥营养源-黄水无法渗入,导致其中氮源供应减少,而铵作为微生物利用氮源的关键中间体,转化减弱。因此,黄水加碳酸钙经培养铵态氮含量增加,而窖泥退化后铵态氮含量降低。
3 结论
以新老窖池黄水为研究对象,分析了其在分别加入适量和过量碳酸钙粉末培养过程中理化性质与菌群组成的变化规律,结果表明:
(1)黄水加碳酸钙经过2 个月培养,pH 值(4.20~4.60→5.00~5.30→4.00~4.50)、丁酸和己酸先增后降,淀粉和还原糖持续降低,Ca2+浓度(4.82~6.32 g/L→5.53~8.89 g/L)、铵态氮(1.28~1.69 g/L→1.53~ 2.18 g/L)和乙酸(4.74~5.44 g/L→5.74~9.61 g/L)呈增加趋势,乳酸先降后增(62.21~64.57 g/L→54.67~ 57.74 g/L→67.89~75.30 g/L)。且加适量与加过量碳酸钙黄水相比,后者pH 值和Ca2+浓度相对更高。而新、老窖池黄水相比,铵态氮和乙酸在老窖池黄水中显著更高。
(2)黄水加碳酸钙培养使菌群组成趋于单一。其中菌群多样性参数OTUs、Chao1 指数和Shannon 指数显著降低。并于培养3 W 时Firmicutes(94.77%→ 100.00%)成为唯一优势菌门,于培养2 W 时Lactobacillus(94.48%→99.99%)成为唯一优势菌属,而其它优势菌属及未知菌属趋于消亡(5.52%降至接近于0)。而且不管是加适量或加过量碳酸钙黄水,还是新老黄水,黄水菌群的多样性参数、优势菌门及优势菌属均无显著差异。
综上,黄水加入碳酸钙培养其理化性质更加有利于Lactobacillus占优势,而抑制了其它菌属的生长。与已知退化窖泥的理化性质和菌群组成变化一致,表明退化窖泥的理化性质和菌群组成与退化过程中黄水的影响有关。本研究为窖泥退化过程中Lactobacillus占优势现象提供了部分理论依据。

