红甜菜酒发酵工艺优化及初生代谢物和挥发性代谢物分析
包永镇,代翠红,程大友,崔 杰
(哈尔滨工业大学 化工与化学学院,哈尔滨 150001)
0 前言
食用红甜菜(BetavulgarisL.var.cruentaAlef.)属藜科,甜菜属,二年生草本植物,又名红菜头,是栽培甜菜的一个变种[1]。食用红甜菜主根发达,根肉多为鲜红或紫红色,其叶柄发达,呈鲜红色。食用甜菜根具有很高的营养和药用价值,在世界各地都是受人们喜爱的蔬菜之一[2]。食用红甜菜根为促进健康、预防和治疗疾病提供了宝贵的活性成分。食用甜菜根肉中含有大量的生物活性物质,可作为功能性食品来源,用于治疗糖尿病、癌症、心血管疾病等多种疾病以及各种氧化应激引起的慢性疾病[3]。虽然红甜菜是不可多得的宝贵食用与药用资源,但由于其较重的土腥味,在国内并不具有很好的食品市场,国内关于红甜菜加工食品的专利与文献较多,但实际应用与产业化生产并不多见。因此,对于红甜菜产品的开发与推广仍需继续努力,开发出符合国人口味的甜菜产品对于甜菜产业来说是至关重要的。目前我国栽培的食用红甜菜的种植面积较小,而作为食物资源出现在市场及餐桌上更是少见。因此,食用红甜菜的浅加工及深加工食品在国内具有很大的的市场潜力。本研究利用食用红甜菜为原料生产红甜菜果酒。以期进一步开发食用红甜菜。
1 材料与方法
1.1 本实验所用食用红甜菜为工大食甜1号。
1.2 实验仪器
(略)
1.3 实验试剂与耗材
(略)
1.4 实验方法
1.4.1 食用红甜菜酒的发酵工艺流程
红甜菜根→清洗→破碎→榨汁→糖度调整→菌种活化→酒精发酵→澄清、过滤→调配→杀菌→灌装→冷却→成品
1.4.2 实验材料的预处理
将食用红甜菜根用清水清洗干净,然后进行去皮、切块处理,将红甜菜根切成边长不超过1 cm的方形小块以方便用榨汁机将其充分打碎。
1.4.3 料液比对甜菜汁感官的影响
取4份红甜菜样品,分别以2∶1、1∶1、1∶2、1∶3的料液比加蒸馏水,用水果榨汁机进行打浆处理,经滤网滤纸过滤得到4份相应比例的甜菜汁,通过感官评定来确定最佳料液比。
1.4.4 菌种活化
酿酒酵母提前在含糖量5%的蒸馏水(10倍酵母量)配制的糖水活化0.5 h,活化温度为35℃。
1.4.5 食用红甜菜酒发酵的单因素试验
(1)初始糖度对红甜菜酒发酵的影响
将食用红甜菜浆初始糖度通过添加白砂糖将其调整为调整为22%、24%、26%、28%、30%,酿酒酵母添加量为0.1%,用柠檬酸调整pH为4.5[4],充分搅拌均匀,在27℃的条件下进行发酵。由预试验显示,发酵5天后,发酵液几乎不再产生气泡,因此选取5天作为初始糖度单因素试验的发酵时间,每个条件做三组平行试验。发酵结束后测定其可溶性固形物含量和酒精度作为发酵结果的评定指标。
(2)酿酒酵母添加量对红甜菜酒发酵的影响
以1.4.5(1)中所述的发酵pH、发酵温度、发酵时间以及试验确定的最佳初始糖度为条件,在食用红甜菜浆中分别添加酿酒酵母量为0.04%、0.06%、0.08%、0.1%、0.12%,混合均匀,进行发酵,每个条件做三组平行试验。发酵结束后测定其可溶性固形物含量和酒精度作为发酵结果的评定指标。
(3)发酵时间对红甜菜酒发酵的影响
以1.4.5(1)中所述的发酵pH、发酵温度、试验确定的最佳初始糖度以及1.4.5(2)试验中所确定的最佳酿酒酵母接种量为基础,将食用红甜菜浆分别发酵 3天、4天、5天、6天、7天,每个条件做三组平行试验。发酵结束后测定其可溶性固形物含量和酒精度作为发酵结果的评定指标。
(4)发酵温度对红甜菜酒发酵的影响
以前述的发酵pH、试验确定的最佳初始糖度、试验中所确定的最佳酿酒酵母接种量、试验中所确定的发酵时间为基础,将食用红甜菜浆分别置于23℃、25℃、27℃、29℃、31℃的条件下发酵,每个条件做三组平行试验。发酵结束后测定其可溶性固形物含量和酒精度作为发酵结果的评定指标。
1.4.6 食用红甜菜酒发酵的响应面试验
根据单因素试验结果,选择初始糖度(A)、酵母接种量(B)、发酵时间(C)、发酵温度温度(D)作为考察因素,选取三水平,根据Box-Behnken试验原理,设计响应面分析试验。
1.4.7 食用红甜菜酒的理化指标测定
(1)食用红甜菜酒酒精度的测定
根据《GB/T15038-2006葡萄酒、果酒通用分析方法》中的酒精度测定方法第三法酒精计法进行测定。
(2)食用红甜菜酒可溶性固形物的测定
食用红甜菜酒可溶性固形物的测定使用手持折光仪进行测定。
(3)食用红甜菜酒总糖的测定
采用苯酚-硫酸法测定样品溶液中的总糖含量[5]。
(4)食用红甜菜酒总酸的测定
根据《GB/T15038-2006葡萄酒、果酒通用分析方法》中的总酸测定方法第二法指示剂法进行测定。
(5)食用红甜菜酒大肠杆菌计数的测定
按照国家标准 GB 4789.3—2016的方法检测。
1.5 食用红甜菜酒体外抗氧化能力测定
1.5.1 DPPH自由基清除率测定
(1)试剂配制:
DPPH溶液:准确称取DPPH(二苯代苦味酰自由基)4.00 mg,用无水乙醇溶解,并定容至100 mL棕色容量瓶中,得到浓度为0.1 mmol/L的DPPH溶液,避光4℃保存;
(2)实验步骤:
分别吸取样品0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL、1 mL于10 mL棕色玻璃瓶中,用蒸馏水补足至2 mL,再加入2 mL DPPH溶液,混合均勾,于暗处反应30 min后,在517 nm下测其吸光度为A1;另取上述不同体积的样品用蒸馏水补至2 mL,加入无水乙醇2 mL,在暗处反应30 min后测其吸光度为A2;再取2 mL DPPH溶液和蒸馏水混合作为反应的参比,测其吸光度为A0;空白对照为2 mL无水乙醇和2 mL水的混合液。DPPH自由基清除率按照下式计算:
式中:A1——甜菜酒样品溶液的吸光度(样液+DPPH);A2——用无水乙醇代替DPPH测得的吸光值(样液+乙醇);A0——为空白组的吸光度(蒸馏水+DPPH)。
1.5.2 羟自由基清除能力测定
在比色管中先依次加入10 mL蒸馏水,然后分别加入2 mL含红甜菜酒样品0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL、1 mL的溶液,接着加入9 mmol/L FeSO4、9 mmol/L乙醇-水杨酸溶液各1 mL,最后加入8.8 mmol/L的H2O21 mL启动反应,37℃水浴加热30 min后取出,在510 nm处测其吸光度为A1;用蒸馏水代替加入的水杨酸水浴30 min后测得吸光度为A2;用蒸馏水代替样品作为参比,测得吸光度为A0;蒸馏水作为空白对照。按下式计算羟自由基清除率:
式中:A1——甜菜酒样品溶液的吸光度;A2——用蒸馏水代替水杨酸测得的吸光值;A0——用蒸馏水代替样液测得的吸光值。
1.5.3 超氧阴离子清除能力测定
(1)试剂配制:
Tris-HCl缓冲溶液(pH8.2)配制:50 mL 0.1 mol/L Tris溶液+22.9 mL 0.1 mol/L盐酸溶液,加蒸馏水稀释至100 mL。
(2)实验步骤:
取2.5 mL 50 mmol/L Tris-HCl缓冲溶液,25℃水浴20 min,分别吸取样品0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL、0.7 mL、0.8 mL、0.9 mL、1 mL于10 mL棕色玻璃瓶中以蒸馏水补足2 mL,再加入0.6 mL 25 mmol/L邻苯三酚溶液,混合均匀25℃水浴20 min,加0.5 mL浓盐酸终止反应,在325 nm波长下测定吸光值。超氧阴离子清除能力按下式计算:
式中:A1——甜菜酒样品溶液的吸光度(样液+邻苯三酚);A2——用蒸馏水代替邻苯三酚测得的吸光值(样液+蒸馏水);A0——为空白组的吸光度(蒸馏水+邻苯三酚)。
1.5.4 总还原力测定
参考杨玉霞的总还原力测定方法对食用红甜菜酒的总还原力进行测定,并与食用红甜菜汁与市售葡萄酒进行比较分析[6]。
2 结果与分析
3.1 料液比对食用红甜菜汁感官的影响
根据1.4.3中描述的实验方法,分别以2∶1、1∶1、1∶2、1∶3的料液比加蒸馏水,加水量对食用红甜菜汁的感官影响结果如表1所示。

表1 加水量对红甜菜汁的感官影响Tab.1 The sensory effect of adding water on red beet juice
由于料液比为2∶1时,加水量较少,食用红甜菜破碎不充分,因此选用食用红甜菜汁最佳料液比为1∶1。
从图1中可以看出,随着初始糖度的增加,食用红甜菜发酵液的酒精度呈先增大后减小的趋势,当初始糖度达到28%时,酒精度达到了最大值11.3%vol,但当初始糖度超过28%时,由于发酵液糖度过高使渗透压过大,会抑制甚至破坏酵母细胞的代谢活动,从而影响酵母菌的生命活动,抑制了酵母菌对糖类物质的利用,糖分的消耗以及酒精生成量也随之减少,最终导致发酵液中剩余的可溶性固形物含量较高;当糖类含量过低时,可用于酵母菌发酵的底物不足,导致酒精度较低[7]。综上所述,发酵的初始糖度选择28%最有利于发酵。
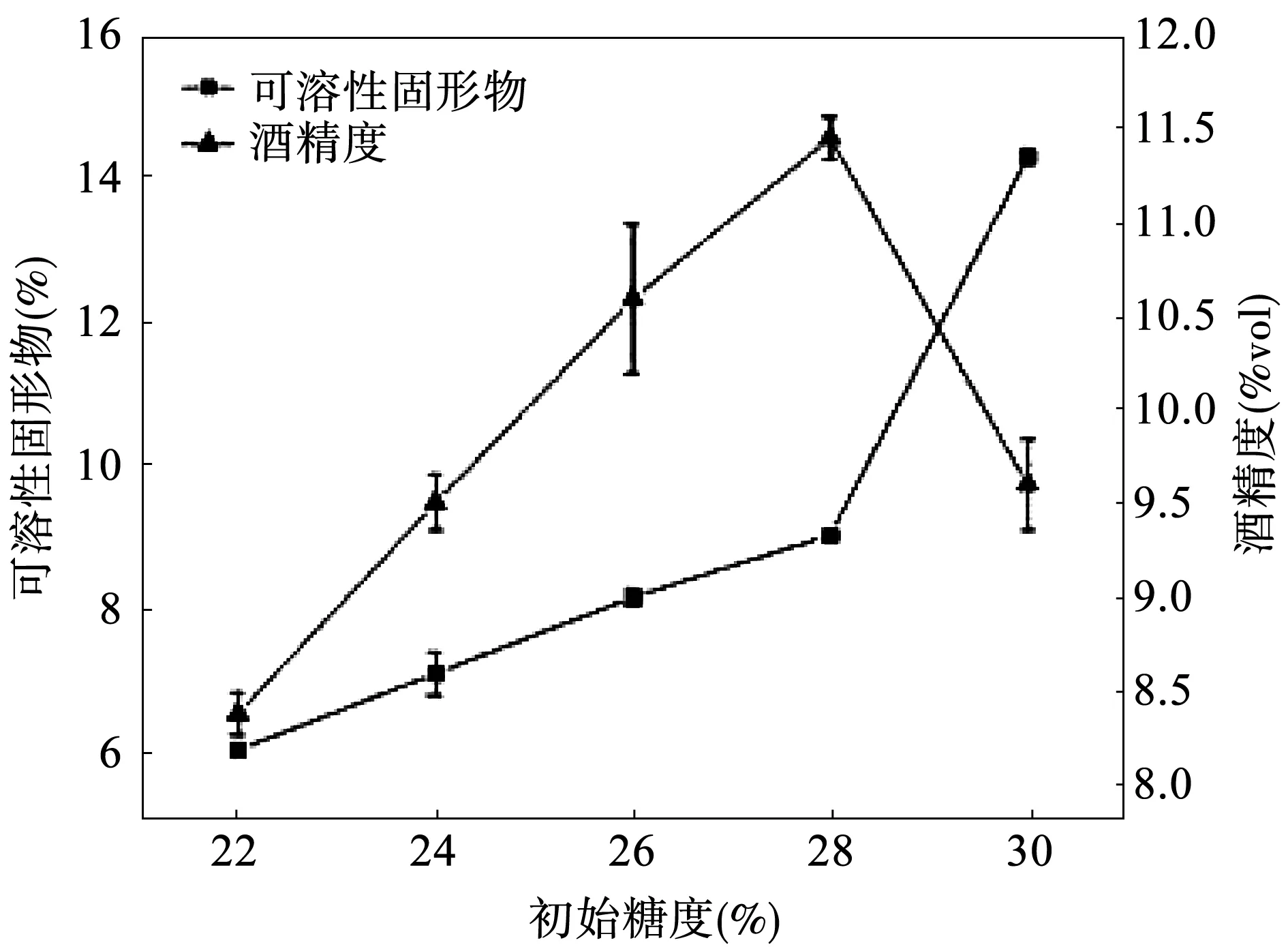
图1 初始糖度对食用红甜菜酒发酵的影响Fig.1 Effect of initial sugar content on fermentation results of red beet wine
3.2.2 酵母添加量对红甜菜酒发酵的影响
根据1.4.5(2)中描述的方法,研究不同酵母添加量对食用红甜菜酒发酵结果的影响,实验结果如图2所示。
酵母添加量的不同对红甜菜酒酒发酵的影响结果见图2所示。酵母添加量对红甜菜发酵具有一定的影响,酵母添加量不断增加时,酒精度的变化趋势为先升高而后略降低,而后趋于平衡;可溶性固形物含量逐渐降低最后趋于平衡。当酵母接种量为0.08%时,发酵液酒精度达到最大值为11.3 %vol,且可溶性固形物接近最低,说明酵母利用糖分产生酒精的能力最强;继续增加酵母添加量,虽残糖含量略微降低,但是发酵液酒精度未见提高。由于酵母添加量过多,需要用于微生物自身生长繁殖的营养物质也会增多,即用于酒精发酵的营养物质则变少,另一方面,菌体在代谢过程中产生大量的代谢产物,会抑制酒精的转化[8-11]。因此,酵母接种量选择0.08%为宜。
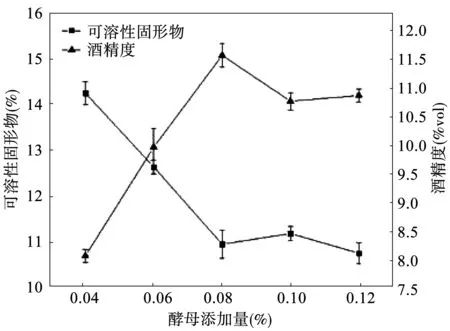
图2 酵母添加量对食用红甜菜酒发酵的影响Fig.2 Effect of yeast addition on fermentation results of red beet wine
3.2.3 发酵时间对红甜菜酒发酵的影响
研究不同发酵时间对食用红甜菜酒发酵结果的影响,实验结果如图3所示。随着发酵时间越长,红甜菜酒发酵越充分,酵母不断利用糖类物质产生酒精,可溶性固形物含量逐渐降低,红甜菜发酵酒精度呈先上升再趋于平缓,发酵5 d时,酒精度达到极值11.2%vol,而后趋于平缓;发酵7 d时,酒精度虽略有提升,但升高的数值并不大,可溶性固形物含量也趋于平缓,说明在5 d左右已经几乎达到发酵终点。
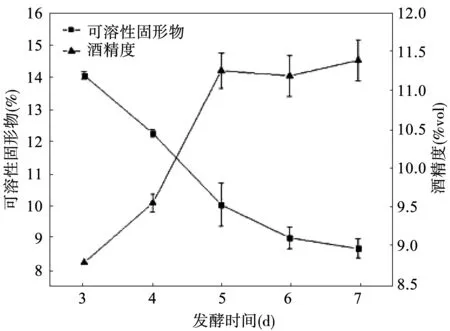
图3 发酵时间对食用红甜菜酒发酵的影响Fig.3 Effect of fermentation time on fermentation results of red beet wine
3.2.4 发酵温度对红甜菜酒发酵的影响
温度能影响酵母的活性和代谢作用,温度过高或过低都会对红甜菜酒发酵有不利的影响。由图4可以看出,随着温度的逐渐升高,酒精度先升高后降低再逐渐趋于平缓,发酵温度为27℃时,酒精度达到最高值11.2%vol,此时可溶性固形物含量达到最低值;温度过高或过低时,都会抑制酵母菌的代谢活动,不利于发酵的进行,产生的酒精度比较低。综上所述,红甜菜酒发酵的较适合温度为27℃。
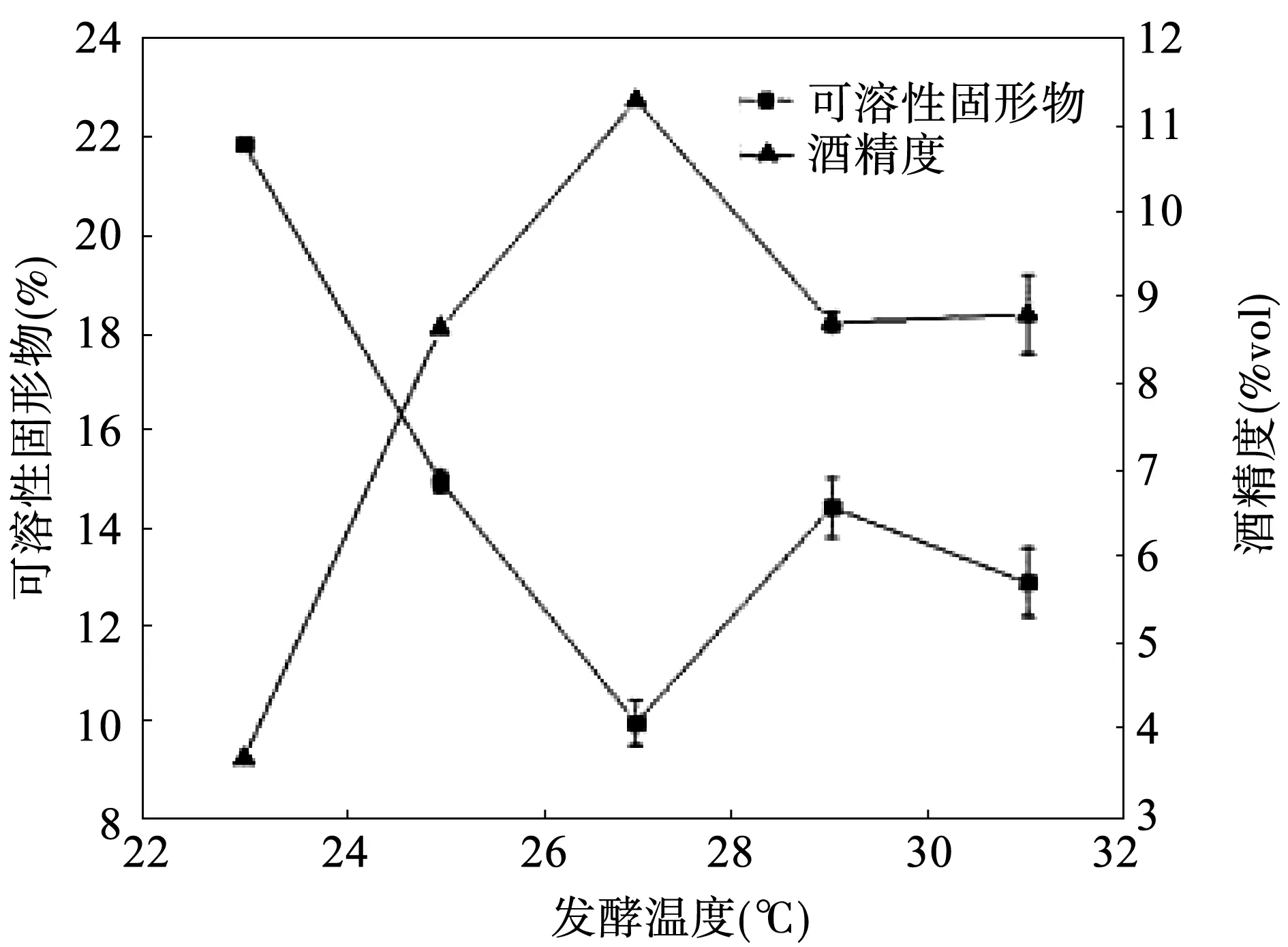
图4 发酵温度对食用红甜菜酒发酵的影响Fig.4 Effect of fermentation temperature on fermentation results of red beet wine
3.3 食用红甜菜酒发酵的响应面试验
根据单因素试验结果,选择初始糖度(A)、酵母添加量(B)、发酵时间(C)、发酵温度(D)作为考察因素,根据Box-Behnken试验原理,设计响应面分析试验。表2为因素水平表。
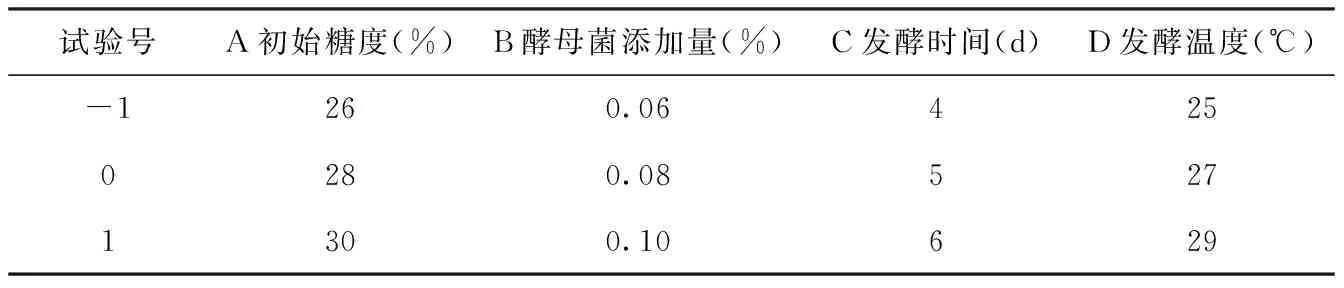
表2 响应面因素水平表Tab.2 Response surface factor level table
3.3.1 响应面优化模型的建立与分析
应用Box-Behnken对红甜菜酒发酵条件进行响应面优化分析试验。在酒精发酵过程中,糖分消耗得越多,酒精度会越高,根据单因素试验分析,当酒精度达到最高水平时,可溶性固形物的含量处于较低水平。因此为了简化优化试验,选用酒精度作为响应面试验指标,酒精度越高,说明发酵条件越好。用Design-Expert.8.0.6软件对响应面试验结果(表3)进行多元回归拟合分析,得到的预测模型为:
酒精度(vol%)=11.28-0.27A+0.11B+0.38C+0.36D+0.025AB-0.020AC+0.050AD+0.075BC-0.025BD+0.050CD-0.68A2-0.43B2-0.61C2-2.33D2。
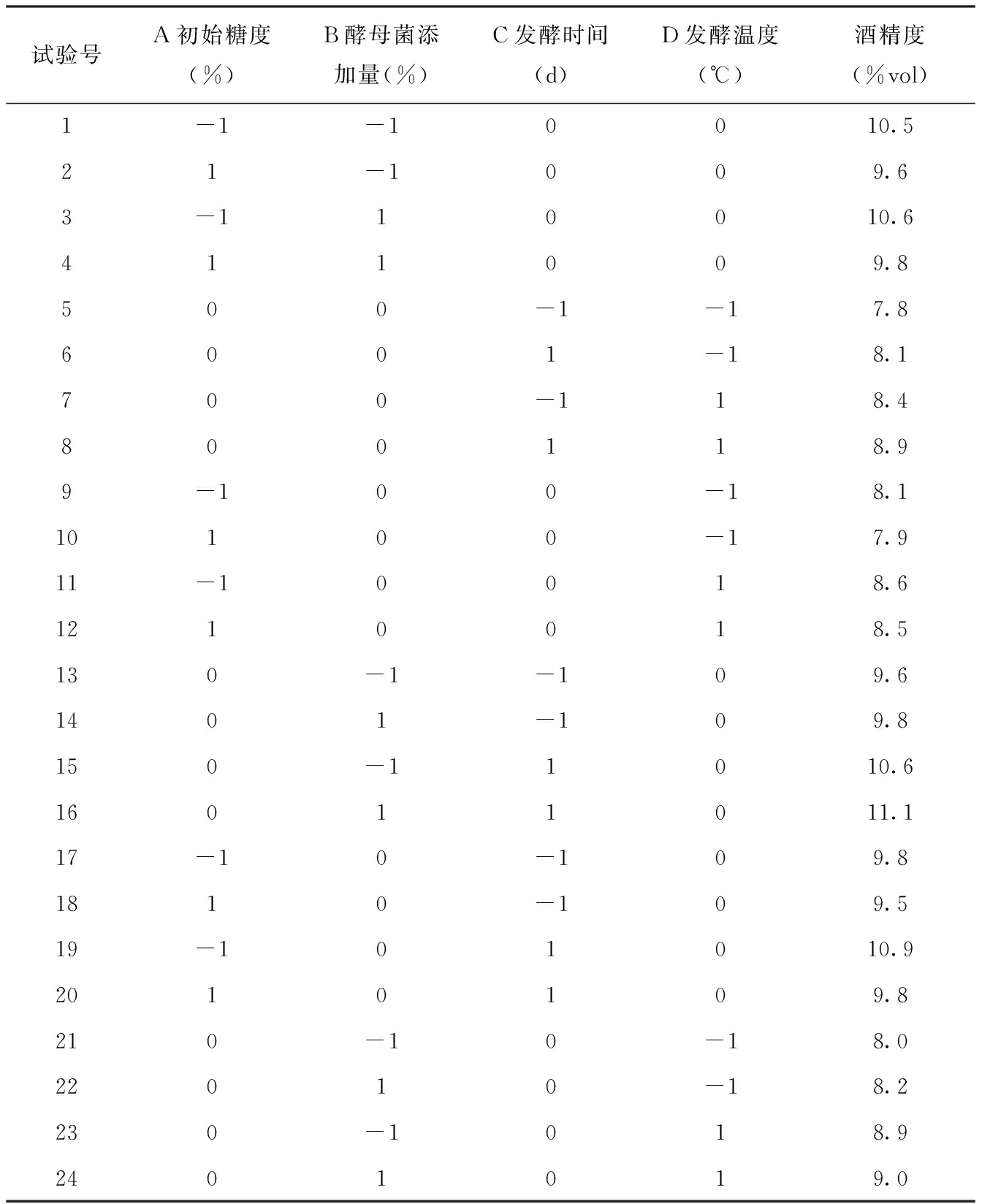
表3 响应面试验设计Tab.3 response surface test design
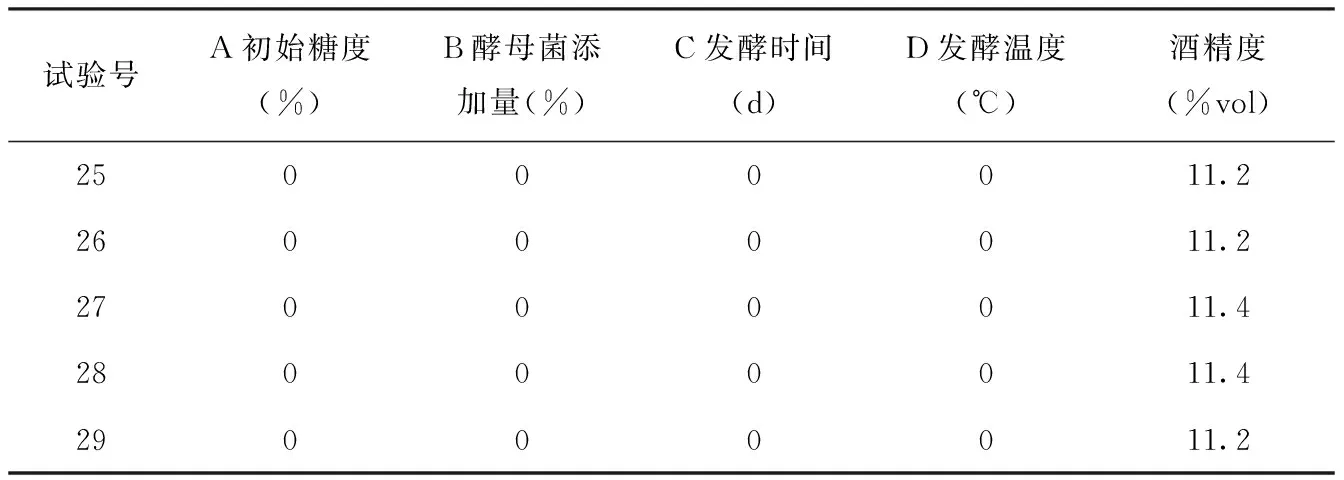
续表
3.3.2 响应面结果分析与优化
根据回归方程所作的响应面图可用于各个因素间交互作用和最佳水平范围,图5-图10为4个因素间两两相互作用的响应面分析图,观察图中拟合形状即可分析酵母接种量、初始糖度、发酵时间及温度对酒精度影响,交互图中的曲线越陡峭,表明两因素的交互作用对酒精度的影响越大。其中初始糖度和发酵时间、发酵时间和发酵温度交互影响酒精度的作用达到了显著水平。
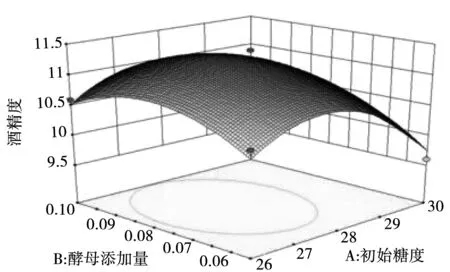
图5 初始糖度和酵母菌添加量交互响应面图Fig.5 Interactive response surface diagram of initial sugar content and yeast addition
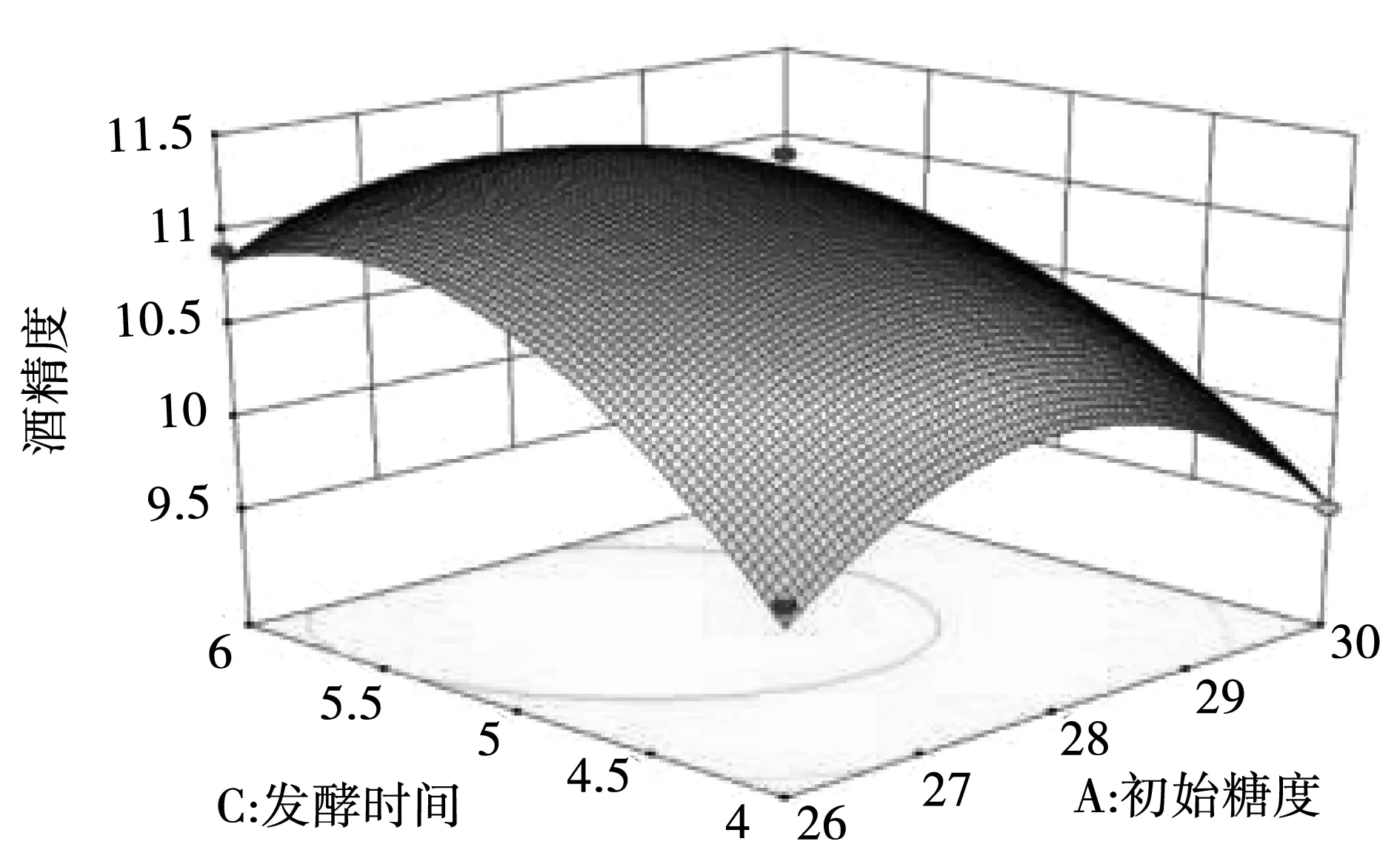
图6 初始糖度和发酵时间交互响应面图Fig.6 Interactive response surface diagram of initial sugar content and fermentation time
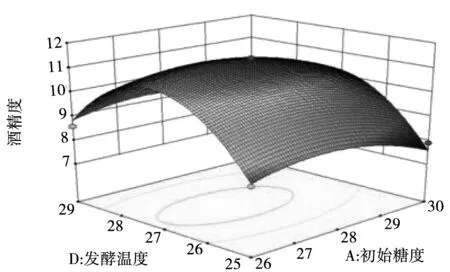
图7 初始糖度和发酵温度交互响应面图Fig.7 Interactive response surface diagram of initial sugar content and fermentation temperature
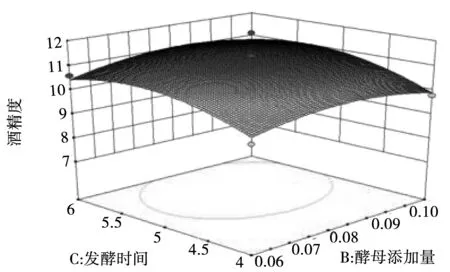
图8 酵母菌添加量和发酵时间交互响应面图Fig.8 Interactive response surface diagram of yeast addition and fermentation time
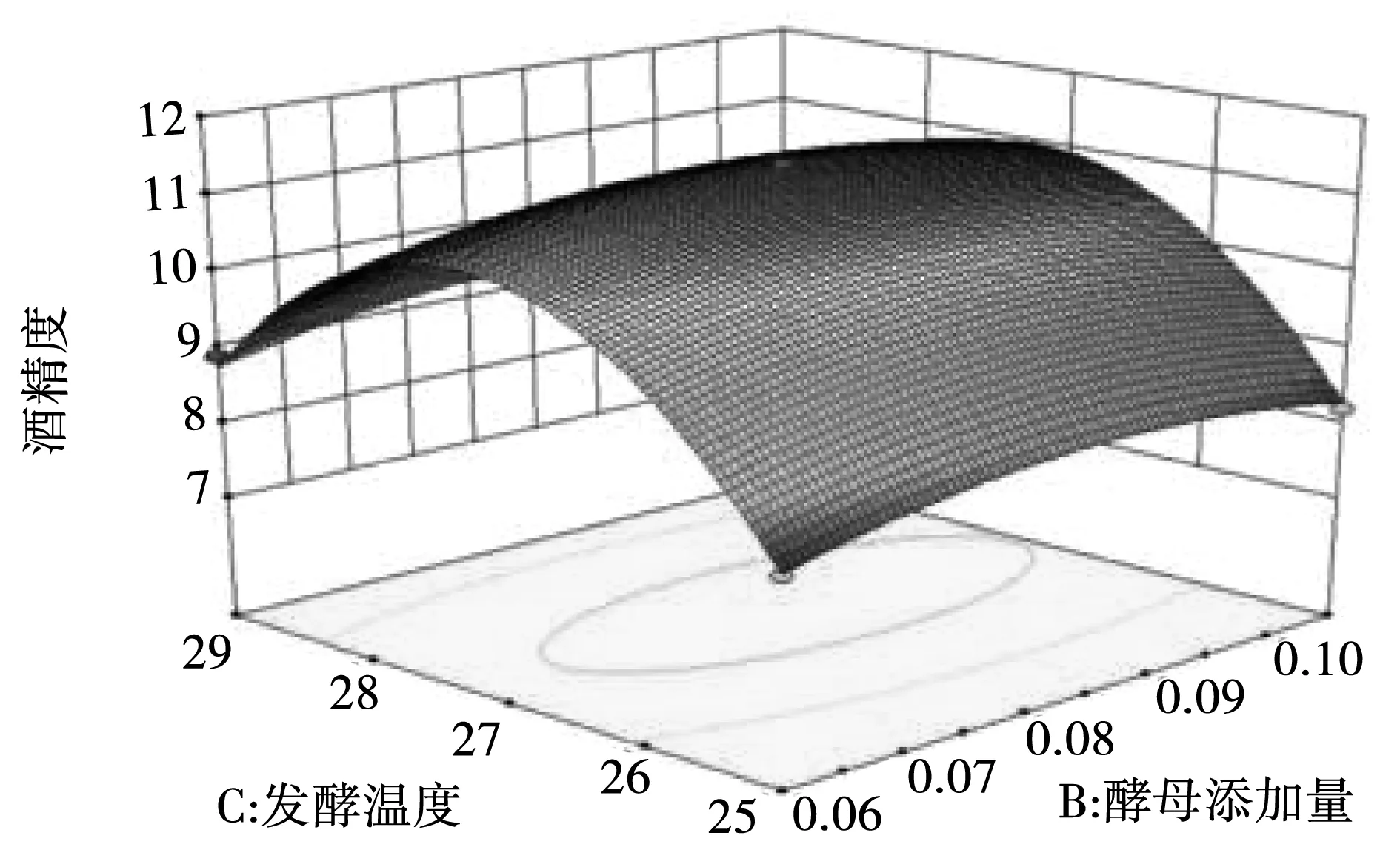
图9 酵母菌添加量和发酵温度交互响应面图Fig.9 Interactive response surface diagram of yeast addition and temperature
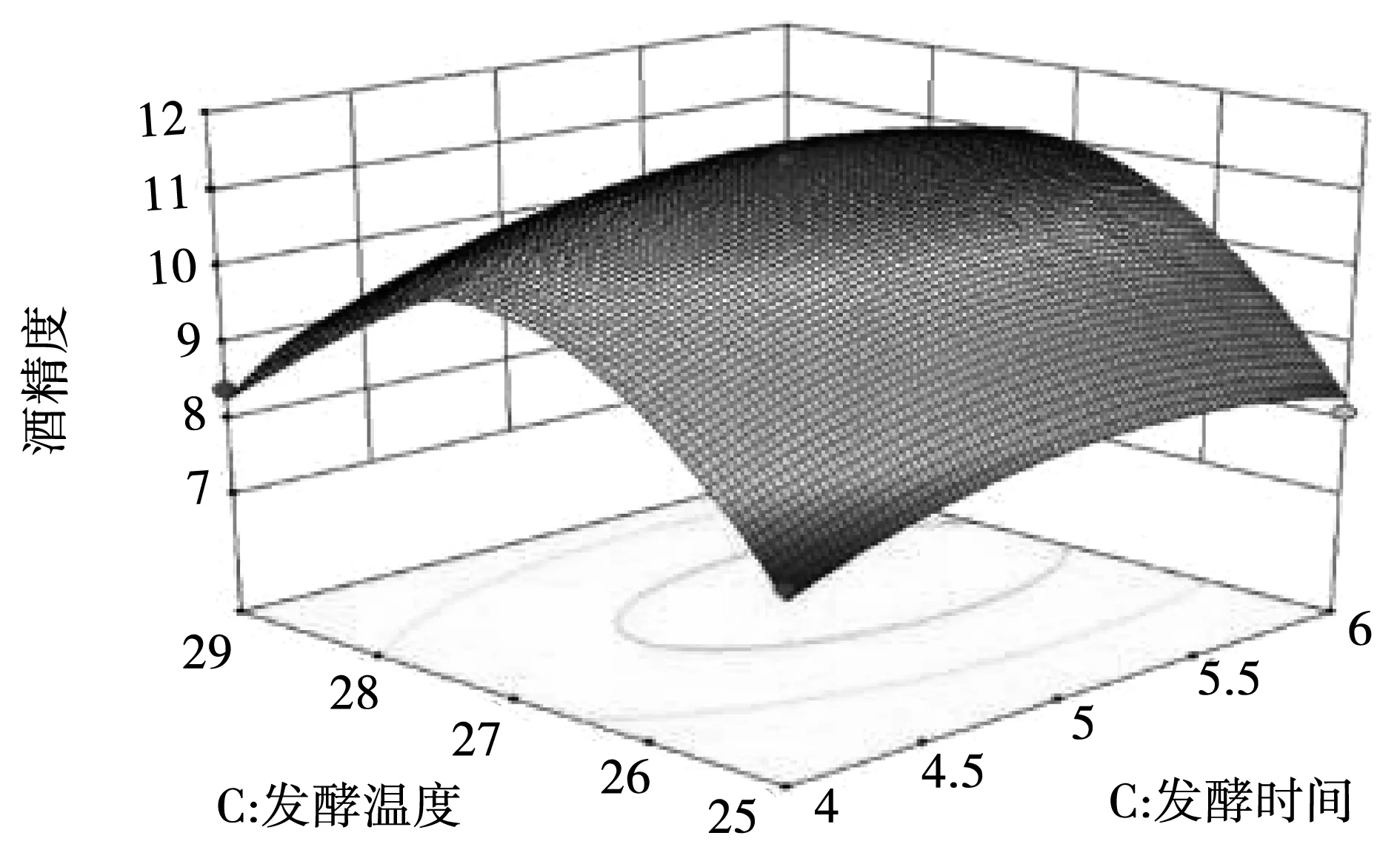
图10 发酵时间和发酵温度交互响应面图Fig.10 Interactive response surface diagram of fermentation time and fermentation temperature
经综合分析,最佳发酵条件为:酵母接种量0.08%,初始糖度27.49%,发酵时间5.37 d,发酵温度为27.15℃,在此工艺条件下,红甜菜酒酒精度理论值为11.53%vol,为了检验模型的准确性及实用性,用以下发酵条件:酵母接种量0.08%,初始糖度27.5%vol,发酵时间5.5 d,发酵温度27℃进行果酒发酵验证试验,最终结果为11.4%,与最优条件下的理论值基本接近,说明采用响应面优化红甜菜果酒发酵工艺条件是准确可行的,有一定的应用价值。
3.4 食用红甜菜酒指标及感官评价结果
对红甜菜酒成品进行部分指标检测,结果表明。酒精度、总糖、总酸、菌落总数、大肠菌群符合《绿色食品 果酒》NY/T 1508-2017中的检测指标项目。红甜菜酒的总糖为121 g/L,属甜果酒。红甜菜酒可溶性固形物为9.6%。酒精度、总酸、大肠菌群的检测结果均符合标准NY/T 1508-2017中要求。
感官评价方面:色泽为深红色、澄清透亮泛有光泽,无明显沉淀,悦目协调;香气为具有红甜菜风味、醇香且香味协调,优雅浓郁;口感柔和纯正,甜、酸、涩协调,回味延绵;具有风格典型且独特等特点。
3.5 食用红甜菜酒体外抗氧化能力测定结果与分析
3.5.1 食用红甜菜酒DPPH自由基清除率测定结果与分析
对样品DPPH自由基清除率进行测定,结果如图11所示。三种样液对 DPPH自由基的清除能力具有较好的作用,当食用红甜菜酒浓度达到450 mg/mL时,DPPH自由基清除率清除率超过 80%,市售葡萄酒浓度达 500 mg/mL时,DPPH自由基清除率才接近 80%,食用红甜菜汁浓度达500 mg/mL时,DPPH自由基清除率才不到70%。随着三种样液浓度的增加,DPPH自由基清除能力明显增强,浓度低于100 mg/mL时,三种样品的 DPPH自由基清除能力相当;当浓度高于150 mg/mL时,食用红甜菜酒和市售葡萄酒的DPPH自由基清除能力相当,食用红甜菜汁的DPPH自由基清除能力均低于食用红甜菜酒和市售葡萄酒。
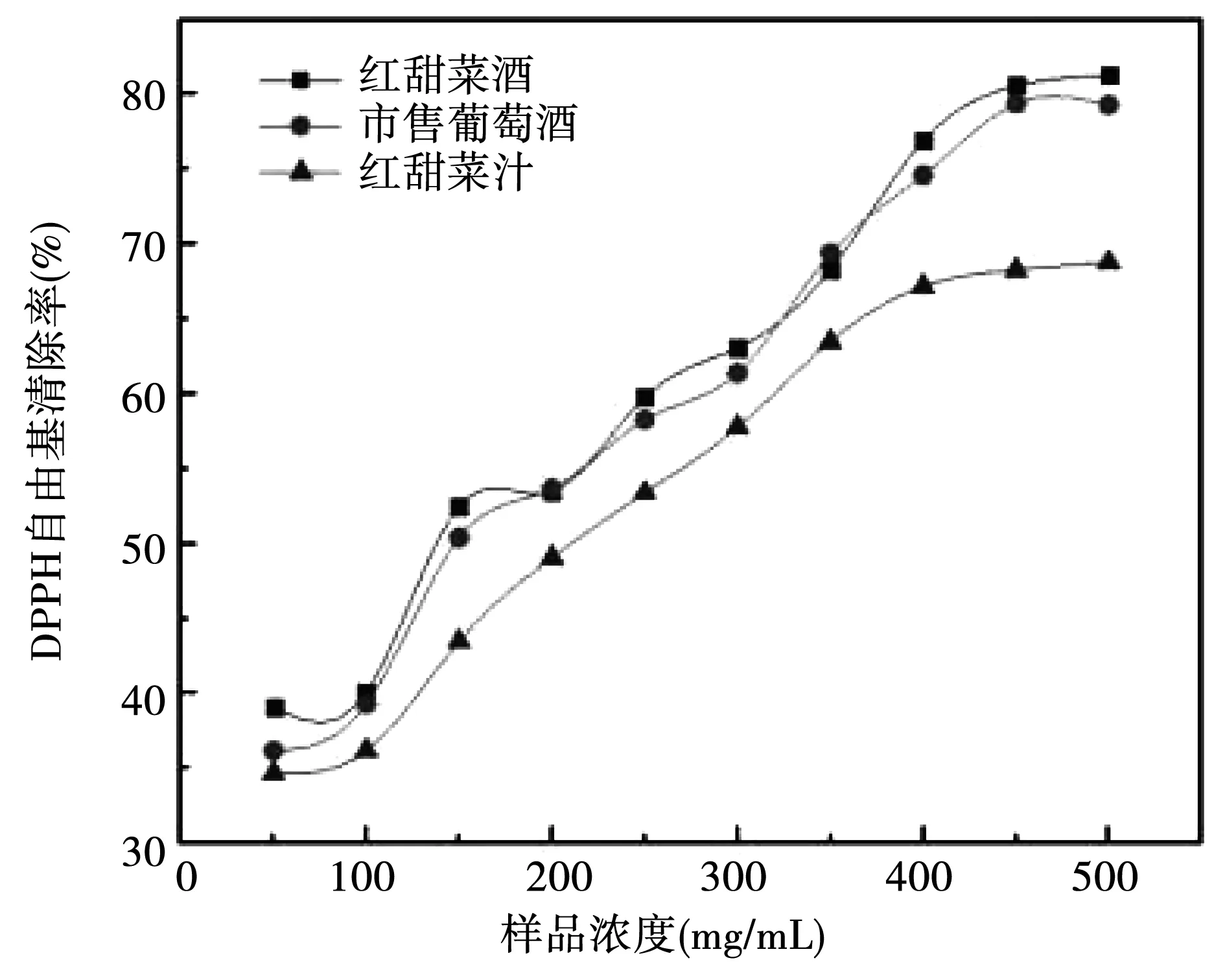
图11 三种样品对DPPH自由基清除率的对比Fig.11 Comparison of scavenging rates of three kinds of samples to DPPH radical
3.5.2 食用红甜菜酒羟自由基清除率测定结果与分析
由图12 可知,在浓度低于350 mg/mL时,三种样液的羟自由基清除能力随着浓度的增大,羟自由基清除率不断提高;当浓度达到350 mg/mL时,市售葡萄汁的羟自由基清除率达到极值56%左右,食用红甜菜酒的羟自由基清除率达到67%左右,当浓度达到400 mg/mL时,食用红甜菜汁羟自由基清除率达到63%左右;当浓度继续增加时,市售葡萄酒的羟自由基清除率趋于稳定,但食用红甜菜酒与食用红甜菜汁的羟自由基清除能力急剧下降,可能是过氧化氢对甜菜红素的活性产生了影响[74],或者是甜菜红素浓度增大时,与显色物质发生了反应[59]。
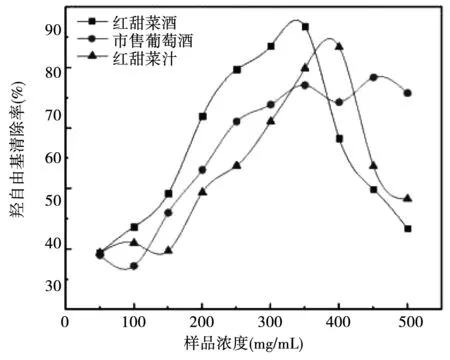
图12 三种样品对羟自由基清除率的对比Fig.12 Comparison of scavenging rates of three kinds of samples to ·OH radical
3.5.3 食用红甜菜酒超氧阴离子清除率测定结果与分析
对样品超氧阴离子清除率进行测定,结果如图13所示。随着浓度的上升,三种样品对超氧阴离子的清除率也上升。当浓度大于300 mg/mL时,食用红甜菜酒与食用红甜菜汁的超氧阴离子清除率开始下降,可能是因为反应体系是碱性环境,而甜菜红素在碱性条件下是不稳定的,会发生降解反应,并且伴随着颜色的消失。另外,甜菜红素与超氧阴离子反应生成过氧化氢,过氧化氢与甜菜红素相互作用,生成一些促进氧化的物质,比如甜菜苷配基醌。这些氧化物会影响甜菜苷配基的稳定性,甚至在加大离子强度的情况下,也会促进甜菜苷配基的降解[11]。因此,在具有较多离子和氧化物的条件下,甜菜红素的稳定性受到影响,造成食用红甜菜酒与食用红甜菜汁清除超氧阴离子的能力下降。
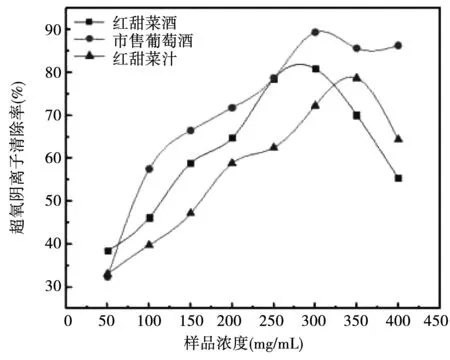
图13 三种样品对超氧阴离子清除率的对比Fig.13 Comparison of scavenging rate of superoxide anion by three kinds of samples
3.5.4 食用红甜菜酒总还原力测定结果与分析
对样品总还原力进行测定,从图 14可以看出样液浓度增大,还原能力也相应的增强,其中食用红甜菜汁的总还原力接近了0.6,高于食用红甜菜酒和市售葡萄酒的0.5左右。造成差异的原因可能是原料不同,原料中不同的活性成分与含量造成了总还原力的差异。
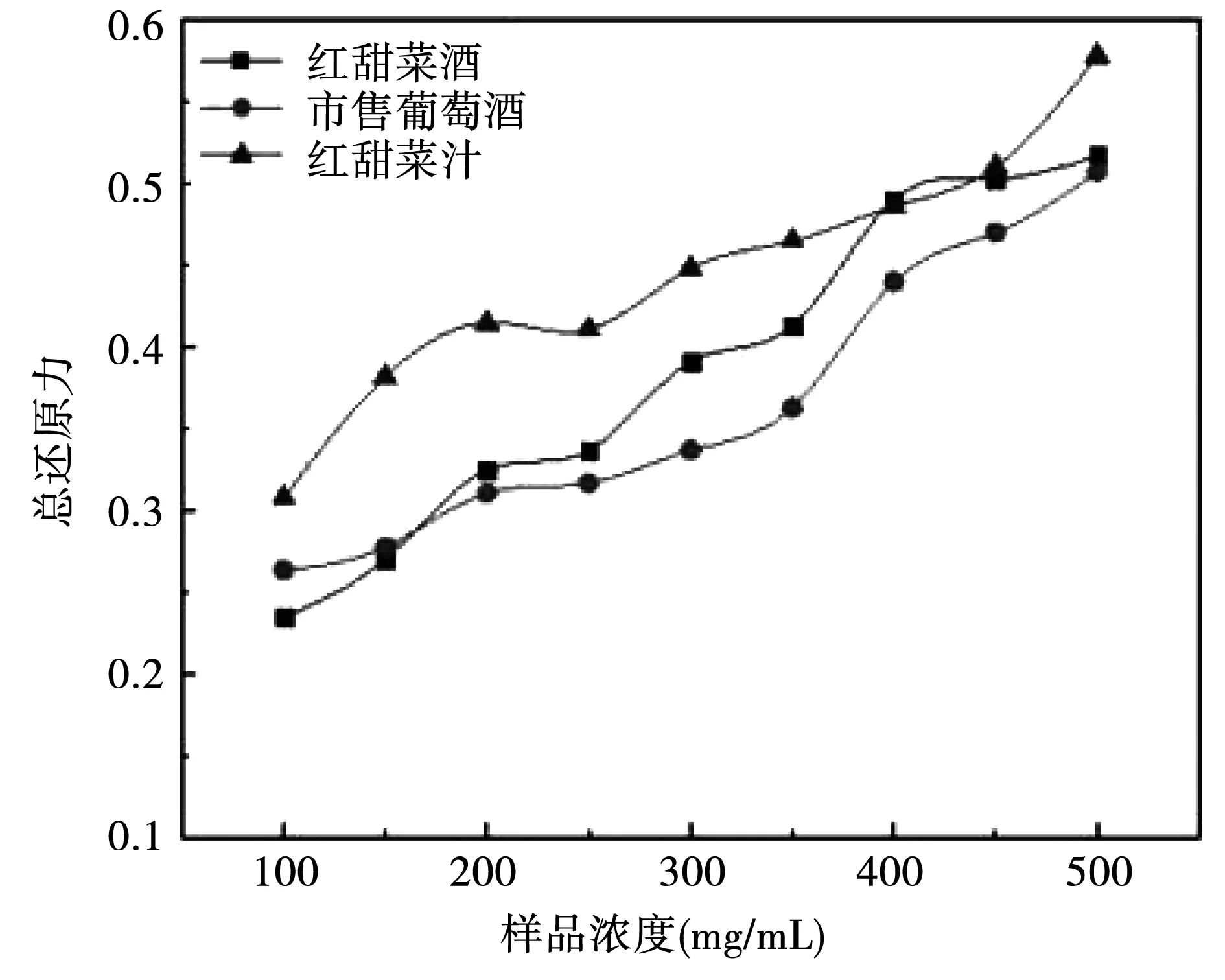
图14 三种样品总还原力的对比Fig.14 Comparison of total reducing power of three kinds of samples
3 讨论
3.1 食用红甜菜作为栽培甜菜的变种,除具有较高的含糖量,还含有多种活性成分,如多酚类化合物、黄酮类化合物、皂苷化合物、类胡萝卜素、甜菜素等,这些化合物对人体健康起着重要作用。其中甜菜红素(betacyanin)作为其特征活性成分更具有抗氧化、抗癌、调节血管稳态等重要功效。通过发酵工艺制备食用红甜菜酒将有利于这些活性成分被人体充分利用。
3.2 通过对食用红甜菜酒的发酵工艺研究表明,以料液比1∶1对食用红甜菜汁进行破碎处理,得到的食用红甜菜汁红色较深,甜菜气味较浓郁;采用单因素试验确定各因素水平对食用红甜菜酒发酵情况的影响,采用响应面分析法优化食用红甜菜酒发酵的最佳工艺条件,得到最佳的发酵工艺为:酵母接种量0.08%,初始糖度27.49%,发酵时间5.37 d,发酵温度为27.15℃,在此工艺条件下,食用红甜菜酒酒精度为11.4%vol,其理化、卫生指标符合国家标准。
3.3 体外抗氧化能力实验表明,食用红甜菜酒具有较好的DPPH自由基清除率、羟自由基清除率、超氧阴离子清除率和总还原力,且存在剂量-效应关系。食用红甜菜中含有的甜菜红素、黄酮类物质、多酚类物质、皂苷类物质、类胡萝卜素等活性成分可能是食用红甜菜酒具有较好的体外抗氧化活性的主要原因。

