不同水分处理对甜菜幼苗生长和生理指标的影响
范国凯,王 堽,刘 钰,何 硕,张广华,耿 贵
(1.黑龙江大学 现代农业与生态环境学院,哈尔滨 150080; 2.黑龙江大学 生命科学学院,哈尔滨 150080)
0 引言
低温、高温、干旱、盐度、重金属和营养缺乏等[1-2]非生物因素,能直接影响植物生长发育。这些逆境影响被统称为非生物胁迫。在非生物胁迫中,对作物生长造成主要伤害的是水分胁迫[3-5]。水分供应不足对于植物细胞生长有显著的抑制作用,使植物生长缓慢[6-7]。同时植物在受到水分胁迫时,细胞内会产生大量自由基,破坏植物体内活性氧代谢平衡,加剧膜过氧化程度,甚至损害膜系统,直至植物细胞死亡[8-10]。因此脯氨酸、丙二醛(MDA)和甜菜碱等透调节物质以及抗氧化酶相关指标经常被用来衡量植物受到胁迫的程度[11-15]。
甜菜(BetavulgarisL.)作为我国重要的糖料作物,在我国农业生产中占有重要的地位[16]。其种植范围主要分布在我国西北、华北、东北地区[17]。由于部分地区年降水量少,季节降雨分布不平衡,并且缺少有效的灌溉措施,导致土壤含水量较低,严重影响甜菜的生长,降低了农产品产质量[18]。因此干旱已经成为制约甜菜产业可持续发展的重要因素[19]。本试验为了解水分变化对甜菜生长的影响,通过观察甜菜幼苗生长,探究其在水分供应不足条件下的表型及生理变化,以期对甜菜水分胁迫的生理响应规律和适应性进行研究。
1 材料与方法
1.1 材料
本实验采用KWS1176甜菜品种。选用12支塑料管(材质为PVC)为一个处理,每支塑料管播三粒种子,浇改良的1/2 Hoagland营养液。将塑料管放入注满水的水槽,使塑料管内土壤充分吸水,种子出苗后进行水分胁迫。甜菜幼苗发芽和生长均在光培室中进行(光照强度480±10 μmol/m2/s,光照时间为7∶00~21∶00,昼夜温度分别为25℃/20℃,湿度为65%)。
1.2 方法
实验设置 5个不同土壤含水量,分别为CK:85±15%、A1:75±15%、A2:65±15%、A3:55±15%、A4:45±15%,共 5个处理,每个处理重复 3 次。培养过程中按照试验处理要求实施水分控制。培养4 周后测定甜菜幼苗各项生理指标。
生长指标测量:从每个盆栽中随机抽取5株幼苗,用游标卡尺测量株高、叶宽。然后,将植株放入105℃的烤箱中杀青0.5小时,70℃烘干至恒重,测定干重。叶片和根系面积使用扫描仪进行扫描并利用Win RHIZO计算分析。
生理指标测定:收获时将甜菜叶片剪碎,0.5g精准称量低温保存备用。按照耿贵等[20-22]的方法进行生理指标的测定,主要包括SOD、POD、APX、CAT、脯氨酸、丙二醛(MDA)可溶性蛋白等,所有指标测定为3次重复。
通过Microsoft office Excel 2016进行数据整理、利用IBM SPSS Statistics 22中的ANOVA进行单因素方差统计分析。
2 结果与分析
2.1 干旱胁迫下甜菜幼苗形态指标的变化
水分是影响甜菜农业生产最重要的组成部分之一,严重影响着甜菜的生长和发育。由图1、表1可知,随着土壤水分含量的降低,甜菜幼苗株高、叶宽、叶面积和根系面积均呈现出下降趋势。甜菜幼苗在A4处理时,这四项指标较其他处理差异明显,其中根系面积差异最为显著,较CK比下降了70.54%。

图1 干旱胁迫下甜菜幼苗的生长状态Fig.1 Growth status of sugar beet seedlings under drought stress
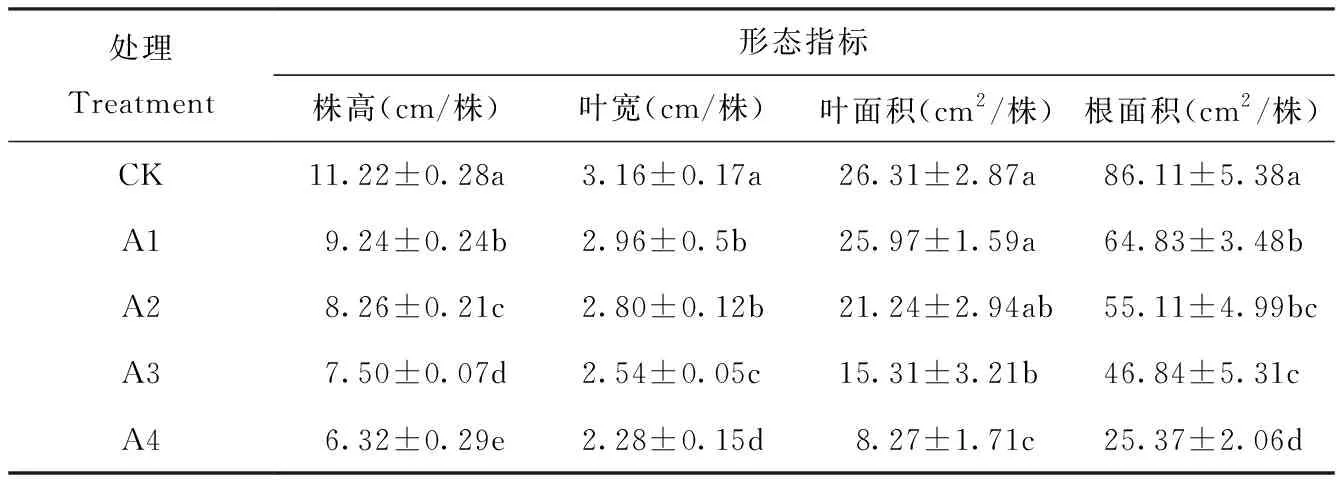
表1 干旱胁迫下甜菜幼苗的株高、叶宽、叶面积、根面积的变化Tab.1 Changes of plant height, leaf width, leaf area and root area of sugar beet seedlings under drought stress
2.2 干旱胁迫下甜菜幼苗生物量的变化
甜菜是对干旱胁迫敏感的作物,干旱胁迫会抑制甜菜幼苗的生长,最终导致生物量的减少。由表2可以看出,干旱条件下,甜菜幼苗的生物量显著降低。随着土壤水分含量的降低,甜菜幼苗茎叶、根系和干鲜重均呈现下降趋势。A4处理下,甜菜幼苗根系和干鲜重较其他处理差异最为显著,其中根系重量在A4处理较CK处理降低了90%。
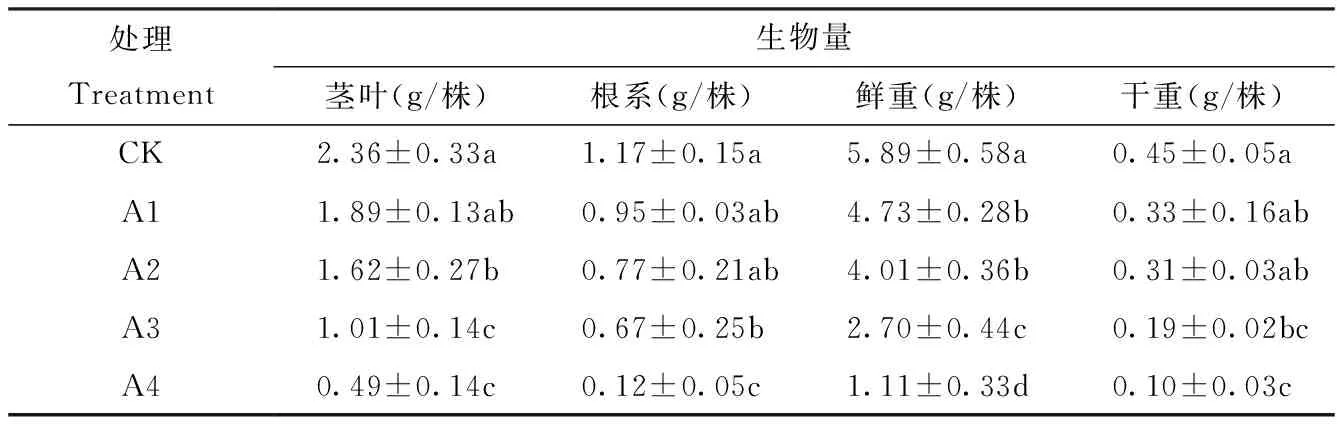
表2 干旱胁迫下甜菜幼苗茎叶、根系重量和干鲜重的变化Tab.2 Changes of stem and leaf, root weight, dry and fresh weight of sugar beet seedlings under drought stress
2.3 干旱胁迫下甜菜幼苗叶片膜透性和根系活力变化
丙二醛含量通常被用来衡量水分胁迫下细胞膜的透性,是在细胞水平上确定非生物胁迫造成的损害程度的一个重要指标。由图2(a)可以看出,随着土壤含水量的下降,甜菜幼苗叶片中MDA含量呈显著上升趋势。MDA含量在A4处理时,达到最大值17.80 mmol·g-1,与CK比较含量增加129.55%。植物根系根对α-萘胺的氧化能力与其呼吸强度有密切联系,可以通过测定溶液中未被氧化的α-萘胺的量测定根系活力。由图2(b)可以看出,随着土壤含水量的下降,甜菜根系活力呈先下降后上升的趋势。在A3处理时,达到最小值2.12 ug·g-1·h-1,较CK比含量降低了42.72%。
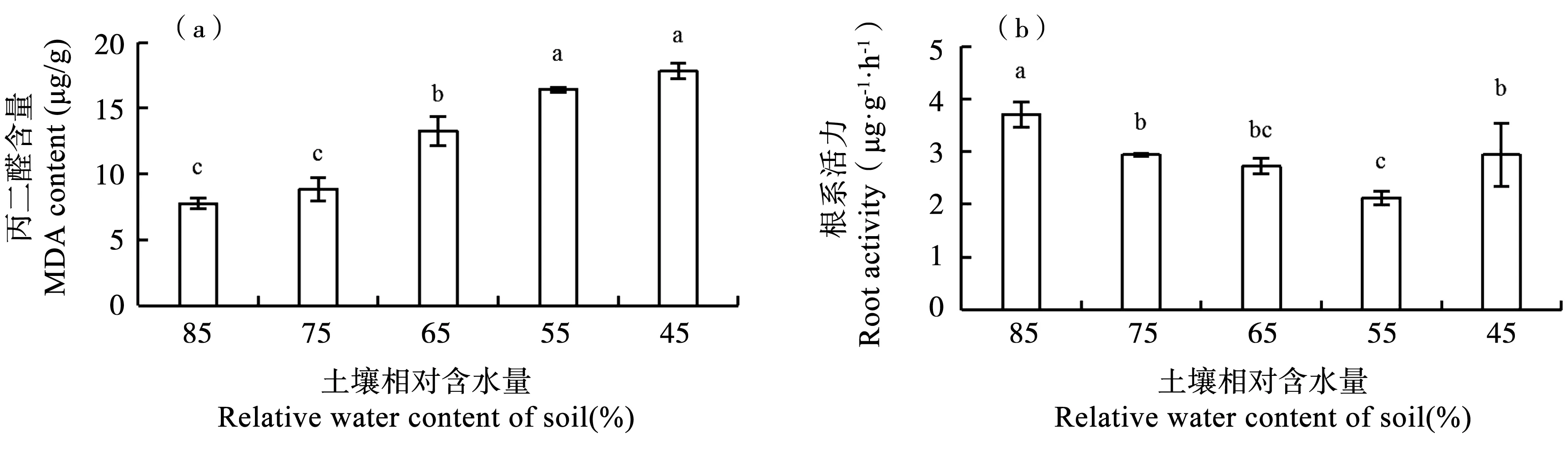
图2 干旱胁迫下甜菜幼苗叶片MDA含量(a)和α-萘胺的生物氧化量(b)的变化Fig.2 Changes of MDA content (a) and (b) of α-naphthylamine in sugar beet seedling leaves under drought stress
2.4 干旱胁迫下甜菜幼苗叶片渗透调节物质含量变化
作为对氧化损伤的反应,植物体内通过积累不同的渗透物质,如脯氨酸、可溶性蛋白等,来维持正常的水分关系应对干旱胁迫。由图3看出,随着土壤含水量的下降,甜菜幼苗叶片中脯氨酸以及可溶性蛋白含量呈显著上升趋势。在A4处理下,脯氨酸含量达到最大值59.73 μg·g-1,与CK比较含量增加459.79%;可溶性蛋白含量在A3处理达到最大值1.51 μg·g-1,与CK相比增加了30.17%。
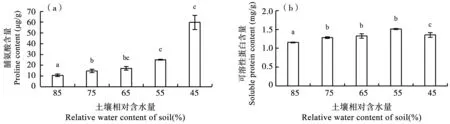
图3 干旱胁迫下甜菜幼苗叶片脯氨酸(a)、可溶性蛋白(b)含量的变化Fig.3 Changes of proline (a) and soluble protein (b) content in sugar beet seedling leaves under drought stress
2.5 干旱胁迫下甜菜幼苗叶片抗氧化酶活性变化
在干旱胁迫下,抗氧化酶活性高的植物被认为具有更好的清除自由基的能力。从图4可知,随着土壤含水量的下降,甜菜幼苗叶片中CAT、POD、APX、SOD活性均显著上升。CAT、POD和APX活性在A4处理时,达到最大值,分别为37.40 U·min-1g-1·FW、28.83 U·min-1g-1·FW和1.05 U·min-1g-1·FW,与CK比较活性分别增加187.69%、68.23%和211.44%;而SOD活性在A3处理达到最大值404.6637.40 U·min-1g-1·FW,与CK比较含量增加20.91%。
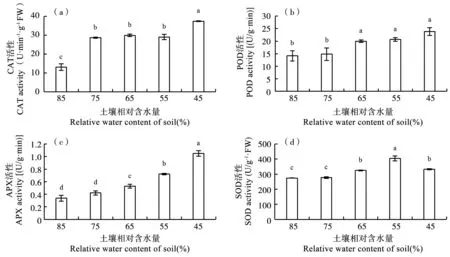
图4 干旱胁迫下甜菜幼苗叶片CAT(a)、POD(b)、APX(c)、SOD(d)活性的变化Fig.4 Changes of CAT (a), POD (b), APX (c) and SOD (d) activities in sugar beet seedling leaves under drought stress
3 讨论
甜菜幼苗株高、叶宽、叶面积、根面积、干鲜重等生长指标随着水分胁迫程度的加深显著降低。且地下部分降低尤为明显,这与杨娟等[23]的研究结果一致。这可能是由于叶片受到水分胁迫,光合作用减弱,产生的同化物和能量减少,不能及时的对甜菜根系进行供给,导致甜菜幼苗根系随着干旱胁迫的程度逐渐变小。研究发现,甜菜幼苗对水分胁迫的响应能力较弱,通常要经过一段时间的适应它才能逐渐恢复。因此在甜菜发苗初期应当保持充足的水分供其正常生长。
有研究表明,干旱胁迫导致MDA水平升高,被认为是脂质过氧化、膜通透性及细胞损伤程度的一个重要指标[24]。李国龙等[25]研究指出,脂质过氧化程度会随着水分胁迫时间的增加而加重。本试验发现,土壤含水量的逐渐减少会引起MDA含量呈现不断增加趋势。说明植物在受到水分胁迫时MDA起到了重要的调节作用,且随着胁迫程度的加剧而呈现正相关。
根系活力是衡量根生长力的一个重要指标。有研究证明,土壤水分含量是植物根系活力的重要影响因子,会随着水分含量的减少而降低[26]。本试验发现,甜菜幼苗根系活力随着水分缺失程度的增加,呈现出先降低后增加的趋势。说明随着水分胁迫的增加,甜菜幼苗根系生长受到抑制。当水分缺失到一定程度时这种抑制会明显降低,从而促进了甜菜幼苗根的生长。因此在甜菜幼苗期适当的干旱有利于根的发育,促进根的汲水生长。然而这种调节能力是有一定限度的,当水分缺失超过抗旱能力会逐渐增强,这与黄海霞等[27]的研究结果一致。
脯氨酸是细胞壁蛋白质的重要组成部分,也是植物重要的渗透调节物质,在调节活性氧、羟自由基方面发挥关键作用[28-29],而可溶性蛋白则可以增加细胞的保水能力,对细胞的生命物质及生物膜起到保护作用,二者都是测定植物对干旱抗性的重要指标。本研究发现,随着干旱胁迫程度的加深,甜菜幼苗中的脯氨酸和可溶性蛋白等渗透调节物质会显著增加,这与彭春雪等[10]的研究结果一致。脯氨酸在A1-A3处理时增加并不明显,可能是甜菜幼苗受到轻度干旱时,脯氨酸相应的基因表达较弱且相应代谢途径也不会有特别明显的变化。可溶性蛋白含量趋势为先升后降,说明其渗透调节作用只是暂时性的,它的调节幅度也是有限制的[30]。
植物受到干旱胁迫,其细胞内会积累大量的活性氧,而抗氧化酶如APX、SOD、CAT和POD的活性提高,才能抑制活性氧的积累。本研究中,干旱处理的甜菜幼苗叶片抗氧化酶活性均有所提升,且明显高于对照处理。李阳阳等[6]发现,干旱胁迫下,植物会通过提高抗氧化酶活性来增加对逆境胁迫的适应能力,与本文结论一致。通过对比四种抗氧化酶活性趋势可知,甜菜幼苗的CAT活性在受到轻度干旱时显著增加,随着干旱程度的加深,POD、APX、SOD活性显著增加,且APX变化趋势最为明显,推测甜菜幼苗在受到干旱胁迫时APX在清除自由基中占据主导地位。这与刘钰等[22]的研究结果一致:在甜菜受到非生物胁迫时,APX是清除植物细胞内自由基的主要抗氧化酶。
4 结论
甜菜幼苗在受到水分胁迫时,其形态指标、生物量、渗透调节物质、抗氧化酶活性、膜透性和根系活力等一系列生理生化指标会发生改变。随着水分胁迫的加深,甜菜幼苗的生长抑制逐渐加重,根系活力下降,叶片中MDA、渗透调节物质含量以及抗氧化酶活性升高。说明甜菜幼苗通过调节叶片中渗透调节物质含量和抗氧化酶活性清除甜菜细胞内的自由基,从而减少水分胁迫对其造成的伤害。
通过对数据分析发现:甜菜幼苗生长前期,严重的气体交换和大部分叶片性状的负面影响虽然是可逆的,但却能显著降低甜菜的产量和质量,甚至会导致植株死亡。因此,在甜菜幼苗期应该保证田间水分充足,并配套相应的水分管理设施,从而提高甜菜幼苗的抗逆能力,提高作物产量。

