托伐普坦与常规利尿剂治疗肝硬化腹水伴低钠血症的疗效及安全性对比分析
雷鸣
腹水是肝硬化终末期常见并发症。在腹水的病因中90%是由肝硬化引起的。肝硬化腹水患者中,15%~20%的腹水患者出现伴低钠血症肝硬化腹水。患者低钠饮食、应用钠利尿剂等传统的治疗方法,对伴低钠血症肝硬化腹水并不理想,可能增加低钠血症的风险[1]。低钠血症可引起脑水肿并严重影响患者的预后。欧美指南中,对伴低钠血症肝硬化腹水的定义是:经过限量食盐(<2 g/d)和利尿剂等标准治疗至少7 d 后,腹水仍不能消退,或得到满意控制的临床状态,或腹腔穿刺大量腹水后,患者腹水不能消退,或患者控制不满意。肝硬化腹水伴低钠血症治疗困难,预后差[2]。目前国外指南推荐治疗伴低钠血症肝硬化腹水,包括低钠饮食、充足的利尿剂和经颈静脉门体分流术,但仍没有有效临床治疗手段。托伐普坦作为血管加压素V2受体拮抗剂,有很强的促进排水作用。临床研究发现,对单纯性肝硬化腹水患者,和低钠血症患者来说,托伐普坦有良好临床治疗作用[3]。然而,对托伐普坦治疗肝硬化腹水伴低钠血症临床效果,国内外尚未见报道。本文对伴低钠血症肝硬化腹水患者进行托伐普坦治疗,比较有效性和安全性,研究如下。
1 资料与方法
1.1 一般资料 选取2019 年9 月~2020 年9 月在大连市第六人民医院肝病科室就诊的70例肝硬化腹水伴低钠血症患者,按照随机数字表法分为对照组和试验组,每组35例。对照组男18例,女17例;年龄49~72 岁,平均年龄(60.00±4.01)岁;其中乙型肝炎肝硬化患者9例,丙型肝炎肝硬化患者10例,酒精性肝硬化患者16例;Child-Pugh B 级18例,C 级17例。试 验 组,男18例,女17例;年龄50~73 岁,平均年龄(60.00±4.34)岁;其中乙型肝炎肝硬化患者10例,丙型肝炎肝硬化患者8例,酒精性肝硬化患者17例;Child-Pugh B 级17例,C 级18例。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。诊断依据2013 年《慢性乙型肝炎防治指南》和《原发性肝癌诊疗规范》。排除心、肺、脑及严重血液系统疾病患者;排除休克、肾毒性药物、肾器质性病变、尿液排除在肾脏超声图像中,蛋白阳性,红细胞>5/HP 和(或)肾脏异常。伴低钠血症肝硬化腹水诊断参照国际腹水协会2009 年制定的肝肾综合征诊断及分型标准,即24 h 内血清肌酐>1.5 mg/dl 或高于基线0.5 mg/dl。
1.2 方法 所有患者均给予低盐饮食。每日有效盐量<2.5 g,控制饮水量和静脉输液量。对肝硬化腹水伴低钠血症患者进行病因治疗,和对症支持治疗。病因学治疗包括临床抗病毒治疗,保肝治疗包括还原型谷胱甘肽治疗、五酯胶囊治疗和血浆治疗。对照组采取常规利尿剂,口服螺内酯400 mg/d;试验组在常规利尿剂基础上采取托伐普坦,口服托尔伐坦片15 mg/d,速尿160 mg/d,疗程10 d。
1.3 观察指标 观察比较两组临床指标、并发症发生情况(下肢水肿、合并肝癌、肝肾综合征)以及血清BUN、Cr、Na+、ALT、TBIL、ALB 水平。临床指标记录主要包括患者治疗24 h 尿量,每日测量患者的体重和腹围。
1.4 统计学方法 采用SPSS21.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 两组患者临床指标比较 试验组24 h 尿量(2950.13±15.14)ml 高于对照组的(1760.12±15.12)ml,体重(62.85±2.14)kg、腹围指标(85.32±4.24)cm 均低于对照组的(66.82±2.14)kg、(89.89±4.04)cm,差异均具有统计学意义(P<0.05)。见表1。
表1 两组患者临床指标比较 (±s)
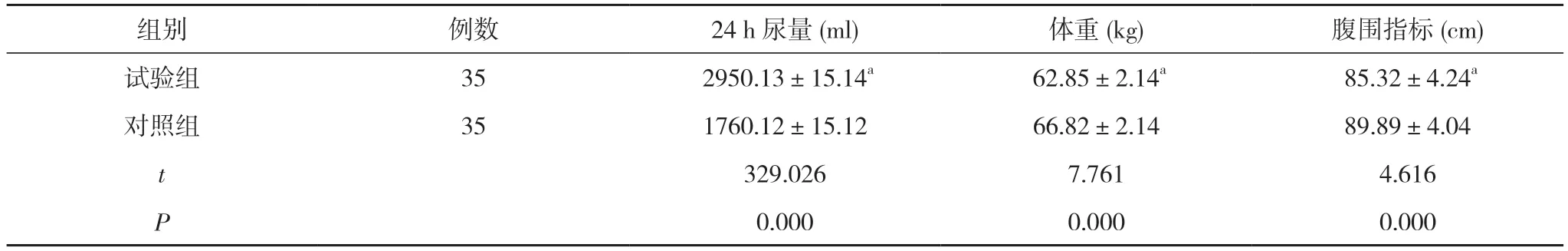
表1 两组患者临床指标比较 (±s)
注:与对照组比较,aP<0.05
2.2 两组患者血清ALT、TBIL 和ALB 水平比较试验组患者血清ALT(88.23±1.04)U/L、TBIL(45.32±1.24)μmol/L、ALB(30.12±1.13)g/L均低于对照组的(89.18±1.02)U/L、(46.89±1.04)μmol/L、(31.12±1.24)g/L,差异均具有统计学意义(P<0.05)。见表2。
表2 两组患者血清ALT、TBIL 和ALB 水平比较 (±s)
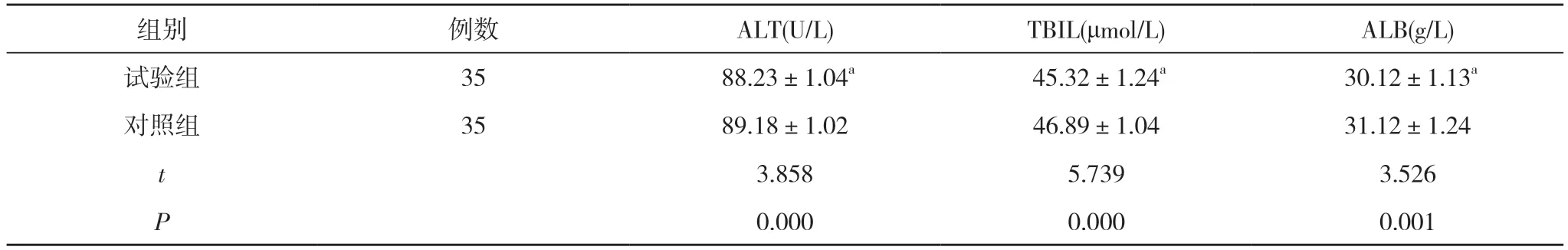
表2 两组患者血清ALT、TBIL 和ALB 水平比较 (±s)
注:与对照组比较,aP<0.05
2.3 两组患者血清BUN、Cr、Na+水平比较 试验组患者血清BUN(5.63±0.04)mmol/L、Cr(86.32±0.80)μmol/L、Na+(133.12±5.13)g/L均高于对照组的(5.51±0.02)mmol/L、(85.89±0.90)μmol/L、(128.12±6.24)g/L,差异有统计学意义(P<0.05)。见表3。
表3 两组患者血清BUN、Cr、Na+水平比较 (±s)
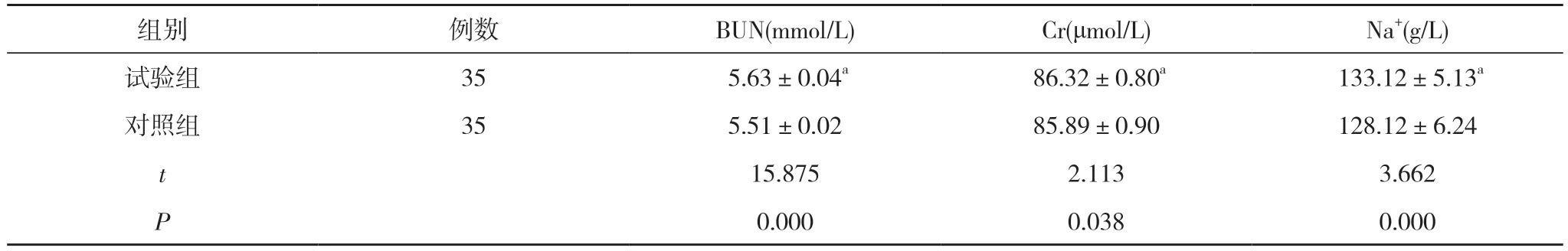
表3 两组患者血清BUN、Cr、Na+水平比较 (±s)
注:与对照组比较,aP<0.05
2.4 两组并发症发生情况比较 试验组并发症发生率8.57%低于对照组的28.57%,差异有统计学意义(P<0.05)。见表4。

表4 两组并发症发生情况比较 [n(%)]
3 讨论
肝硬化腹水的形成,与门脉高压和肾钠潴留两种发病机制有关。随着患者门脉压力增加,门脉血流代偿,可导致门脉高压的形成[4],导致多余体液积聚在患者腹腔。患者门静脉窦压力升高使患者局部内脏血流量加大,导致患者加重门静脉高压及削减中心循环血流量[5]。硬化腹水的形成第二个机制,是与患者门脉升高的肾钠潴留,出现在腹水之前。然而肾水钠潴留的机制仍存在争议:门脉高压是由肝肾反馈或患者肝部血流动力学紊乱,肾素-血管紧张素系统激活,以及患者交感神经失衡导致的,有些人认为,患者早期出现的水和钠潴留不是动脉血容量减少结果。处于失代偿期肝硬化晚期患者的外周血管阻力下降,发生低血压。处于失代偿期肝硬化晚期患者往往通过释放更多的血管收缩剂,增加外周血管阻力,以及增加心输出量,填充扩张的外周血管床来维持血流动力学的稳定。随着处于失代偿期肝硬化晚期患者肝硬化进展,处于失代偿期肝硬化晚期患者外周血管扩张,患者心脏将无法得到代偿。此时,进一步增加患者内源性血管活性元素释放,如交感神经系统、抗利尿激素和加压素是预防动脉性低血压的唯一方法[6]。加压素又称抗利尿激素,由下丘脑视上核,和视旁核神经元分泌血管加压素与远端曲小管,和集合管上皮细胞管周膜上V2受体结合后而增加管腔膜通道,从而增加基底外侧膜和重新吸收水的渗透性,使尿液浓缩,肾小球和肾小管平衡的破坏是肝硬化腹水形成重要机制[7]。低钠血症是失代偿期肝硬化患者一种常见电解质紊乱症状,对预后有不利影响。与正常人相比的失代偿期肝硬化低钠血症的患者死亡率可提高3.2 倍[8]。低钠血症是指处于失代偿期肝硬化晚期患者严重心血管功能障碍,与肝性脑病、肾功能衰竭和胸腔积液密切相关。螺内酯代谢物,能竞争性地抑制醛固酮与远端曲小管和集合管细胞质中特定受体蛋白结合,影响K+-Na+交换,发挥Na+和K+滞留的作用,减少肝硬化腹水患者水钠潴留。然而螺内酯治疗后1~5 d 才出现利尿作用。另一种作用于髓质环上行分支细胞的呋塞米,通过减少Cl-和Na+再吸收来增加肾血流量来利尿。托伐普坦是一种能特异性拮抗精氨酸加压素的选择性血管加压素V2受体拮抗剂,用于治疗心力衰竭和抗利尿激素的异常分泌综合征,高血容量或等容性低钠血症,托伐普坦增加游离水的排泄和减轻高容量低钠血症,改善处于失代偿期肝硬化晚期患者预后[9,10]。25 min 见效,2~3 h达高峰,4~5 h 消失。与上述两种利尿剂相比的托伐普坦是一种高选择性非肽类加压素V2受体拮抗剂,不激活肾素-血管紧张素-醛固酮系统。利尿作用能增加尿量,抑制水再吸收,但对血钾和钾浓度无明显影响,能显著减轻患者水肿,有效纠正低钠血症。有研究表明,托伐普坦15 mg/d 的疗效在治疗5 d 后达到高峰,随后疗效维持或呈下降趋势。目前普遍认为7 mg/d 是一种大多数患者都能耐受的剂量,7~30 mg/d 对常规利尿疗效差的患者可以获得满意的疗效,但药物剂量的增加导致不良反应增加,因此治疗要严格控制剂量。试验组24 h 尿量高于对照组,体重、腹围指标均低于对照组,差异均具有统计学意义(P<0.05)。试验组患者血清ALT、TBIL、ALB 均低于对照组,差异均具有统计学意义(P<0.05)。试验组患者血清BUN、Cr、Na+均高于对照组,差异有统计学意义(P<0.05)。试验组并发症发生率8.57%低于对照组的28.57%,差异有统计学意义(P<0.05)。
综上所述,托伐普坦与常规利尿剂治疗肝硬化腹水伴低钠血症相比,可以明显改善患者的临床症状,以及实验室指标,并且安全性较高,临床上值得推广。

