LINC00052靶向miR-145发挥对TNF-α诱导人关节软骨细胞损伤的保护作用
阿布都艾尼·热吾提,周文正,车立新,徐江波,孙俊刚
(新疆维吾尔自治区人民医院骨科中心创伤病区,新疆 乌鲁木齐 830001)
骨关节炎(osteoarthritis,OA)又称骨关节病,是一类由关节软骨基质的代谢平衡被打破而引发关节产生的退行性病变[1]。OA已经成为全球公共卫生的主要问题之一,随着人类寿命的增加,预计在不久的将来OA的发病率会进一步增加,尤其是在中国等发展中国家[2]。OA好发于活动较频繁的关节或负重关节,繁重的体力活动是造成OA的主要原因。OA病理表现为软骨细胞数量减少、软骨基质破坏及滑膜炎症反应,临床表现包括畸形、关节痛和功能障碍[3]。OA的发病由遗传因素、机体免疫调控失衡和局部物理因素等长期作用所致,其确切的分子机制仍尚不清楚。OA治疗包括药物、外科手术及替代方案等,临床上通常组合使用才能达到最佳效果[4]。
长链非编码RNA(long non-coding RNA,lncRNA)是一类长度超过200个核苷酸并缺乏编码蛋白潜力的RNA[5]。研究表明,lncRNA参与多种生物学过程,例如细胞增殖和凋亡、细胞分化、肿瘤发生和转移[6]。lncRNA的表达改变可导致与OA相关的多种基因及信号通路的异常表达,进而影响OA的进展[7-8]。尽管许多研究已经报道了LINC00052在一些肿瘤形成中的重要功能,但其在OA中的作用仍然未知。本研究通过采用一系列细胞功能实验,分析LINC00052在TNF-α诱导人关节软骨细胞损伤模型中的作用及机制,发现LINC00052靶向miR-145发挥对TNF-α诱导C-20/A4细胞损伤的保护作用。
1 资料与方法
1.1 材料 杜尔贝科改良伊格尔细胞培养基(Dulbecco’s modified eagle medium,DMEM)、胎牛血清、青霉素、链霉素、lipofectamine 2000转染试剂、四唑盐比色法[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]、二甲基亚砜及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)购自美国Thermo Fisher Scientific公司。LINC00052 shRNA、阴性对照(shRNA control)、miR-145抑制物(inhibitors)及抑制物对照(inhibitors control)购自苏州吉玛基因股份有限公司。LINC00052野生型(LINC00052-wt)和突变型报告基因载体(LINC00052-mut)购自上海吉凯基因化学技术有限公司。蛋白提取及定量试剂盒购自上海碧云天生物技术有限公司。一抗半胱氨酸天冬氨酸蛋白酶-3(caspase 3,CASP3)、cleaved CASP3、Bcl-2相关X(Bcl-2 associated X,BAX)蛋白及甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体]和二抗(抗兔和鼠HRP抗体)购自美国Abcam公司。白介素(interleukin,IL)-1β、IL-6和IL-13酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国Proteintech公司。TRIzol、逆转录及实时荧光定量聚合酶链式反应(real time quantitative polymerase chain reaction,RT-qPCR)试剂盒购自日本Takara公司。LINC00052、GAPDH、miR-145及U6引物购自上海生工生物工程有限公司。人C-20/A4关节软骨细胞购自中科院上海细胞库。
1.2 方法
1.2.1 TNF-α诱导建立人C-20/A4关节软骨细胞损伤模型 C-20/A4细胞复苏后,采用DMEM细胞培养基和10%加热灭活的胎牛血清培养,并添加100 μg/mL青霉素和链霉素抑制细菌生长。常规传代与接种,当细胞传至3~5代后,取生长状态良好的C-20/A4细胞接种至6孔板(约5×106个/孔),每组设置3个复孔。培养24 h后,分别将0、10及30 ng/mL TNF-α添加至各组细胞,继续放置培养箱中培养48 h,之后收集细胞并检测炎症因子IL-1β、IL-6和IL-13浓度的变化,确定建模是否成功。
1.2.2 RT-qPCR 收集1×106个C-20/A4细胞,采用TRIzol试剂盒按照操作要求从细胞中提取总RNA,检测RNA浓度,并进行逆转录实验合成cDNA。RT-qPCR反应体系为20 μL,包括cDNA模版1 μL,Premix Mix 10 μL,上下游引物各0.5 μL,无RNA酶去离子水8 μL。LINC00052扩增步骤为:98℃ 10 min,随后98℃ 10 s,60℃ 30 s,72℃ 30 s,共40个循环。人LINC00052上游引物:5’-CCTGAAGTTT CTCCATGAATTGTG-3’;下游引物:5’-GAGGGAGGGAGACTGAGATT-3’;以GAPDH为内参,上游引物:5’-GGTCTCCTCTGACTTCAACA-3’;下游引物:5’-GTGAGGGTCTCTCTCTTCCT-3’。人miR-145扩增步骤为:95℃10 min,随后98℃ 10 s,58℃ 30 s,72℃ 30 s,共40个循环。miR-145上游引物:5’-CAGTGCGTGTCGTGGAGT-3’;下游引物:5’-AGGTCCAGTTTTCCCAGG-3’;以U6为内参,上游引物:5’-GCTTCGGCAGCACATATACTAAAAT-3’;下游引物:5’-CGCTTCACGAATTTGCGTGTCAT-5’。
1.2.3 细胞转染 C-20/A4细胞接种至6孔板(约5×106个/孔),每组设置3个复孔。放置于37℃培养箱中培养过夜,待融合度达到70%~80%时,采用lipofetamine2000转染2.5 μg LINC00052 shRNA和shRNA control或150 pmol miR-145 inhibitors和inhibitors control至C-20/A4细胞。待转染48 h后收集各组细胞,采用RT-qPCR分析各组LINC00052和的miR-145的表达。
1.2.4 蛋白质印迹 收集1×106个C-20/A4细胞,在4℃下提取总蛋白并测定蛋白浓度。105℃下加热2 min使蛋白充分变性。常规配置蛋白分离胶与浓缩胶,采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)分离蛋白并转移到聚偏氟乙烯膜上。之后,将膜用5%脱脂奶粉在37℃下封闭2 h,然后用抗CASP3、cleaved CASP3、BAX及GAPDH抗体孵育并在4℃过夜。用三羟甲基氨基甲烷-Tween缓冲盐水(triethanolamine buffered saline-Tween solution,TBS-T)缓冲液洗涤3次,每次5min,将膜与合适的二抗在37℃下孵育1 h。使用增强化学发光显色试剂盒进行蛋白条带检测,以GAPDH蛋白当作为内参对照。
1.2.5 双荧光素酶报告基因实验 C-20/A4细胞接种至24孔板(约3×104个/孔),每组设置3个复孔,并放置于37℃培养箱中培养过夜。待每孔细胞融合度达70%~80%时,采用lipofetamine2000转染0.5 μg LINC00052-wt和LINC000
52-mut,同时转染20 pmol miR-145 inhibitors和inhibitors control至C-20/A4细胞。6 h后更换新鲜培养基,放置37℃培养箱中继续培养48 h,离心收集各孔细胞。裂解细胞并收集上清液,测定各组萤火虫及海肾荧光值,并计算相对荧光素酶比值(海肾荧光值/萤火虫荧光值)。
1.2.6 MTT C-20/A4细胞接种至96孔板(5×103个/孔),每组设置3个复孔,培养过夜。细胞转染0、24、48和72 h后,向每组中加入12 μL MTT(5mg/mL),培养4 h,再向每组中加入200 μL二甲基亚砜溶解结晶。在室温下用摇床振荡15 min,用酶标仪测量每组样品490 nm处的光密度(optical density,OD)。以培养时间为横坐标,OD为纵坐标绘制细胞增殖曲线。
1.2.7 ELISA 收集1×106个C-20/A4细胞,在4℃下提取总蛋白。采用ELISA试剂盒处理各组蛋白,并添加至96孔板中。用酶标仪测量每组样品在450 nm波长处的OD,绘制标准曲线,并分别计算IL-1β、IL-6和IL-13的浓度。
1.2.8 生物信息学分析 使用Starbase2.0(http://starbase.sysu.edu.cn/starbase2/index.php)和miRcode(http://www.mircode.org/)数据库预测LINC00052的靶基因。
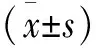
2 结 果
2.1 TNF-α诱导人关节软骨细胞损伤模型中LINC00052与miR-145表达分析 ELISA结果显示,10 ng/mL TNF-α诱导组C-20/A4细胞中IL-1β、IL-6和IL-13的浓度分别是0 ng/mL TNF-α诱导组的(1.79±0.22)、(2.50±0.27)及(1.24±0.13)倍,差异有统计学意义(见图1a,P<0.05)。30 ng/mL TNF-α诱导组C-20/A4细胞中IL-1β、IL-6和IL-13的浓度分别是10 ng/mL TNF-α诱导组的(2.03±0.28)、(3.29±0.41)及(1.80±0.24)倍,差异有统计学意义(见图1b,P<0.05)。RT-qPCR结果显示,0 ng/mL、10 ng/mL及30 ng/mLTNF-α诱导组C-20/A4细胞中LINC00052的相对表达水平分别为(1.0±0.11)、(1.91±0.16)及(4.84±0.35),而miR-145的相对表达水平分别为(1.0±0.14)、(0.86±0.12)及(0.17±0.05),差异有统计学意义(见图1c,P<0.05)。TNF-α诱导人C-20/A4关节软骨细胞损伤模型中,LINC00052与miR-145的表达水平呈负相关(见图1d,P<0.05)。
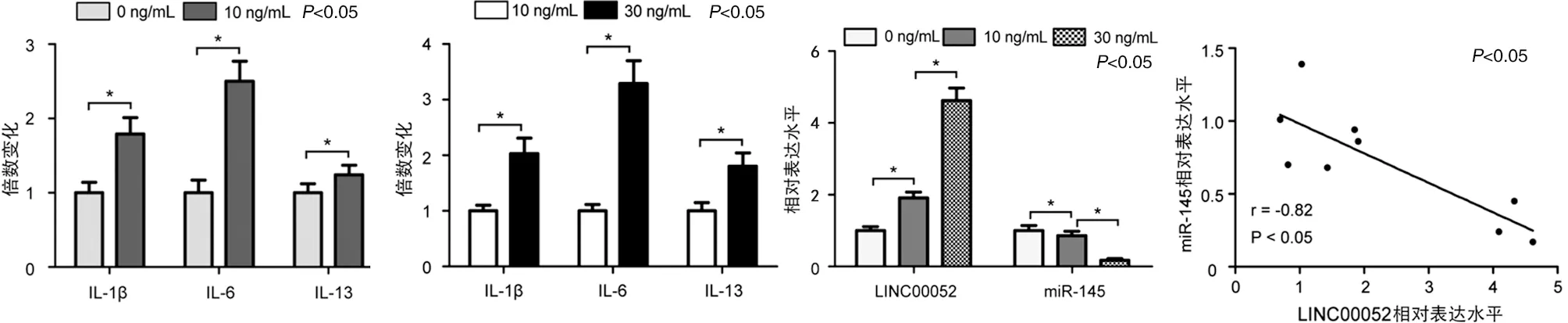
2.2 LINC00052 shRNA和miR-145 mimics转染效率分析 RT-qPCR结果显示,C-20/A4细胞转染shRNA control与LINC00052 shRNA后,LINC00052的相对表达水平分别为(1.0±0.15)与(0.38±0.06),差异有统计学意义(见图2a,P<0.05)。C-20/A4细胞转染inhibitors control与miR-145 inhibitors后,miR-145的相对表达水平分别为(1.0±0.18)与(0.23±0.05),差异有统计学意义(见图2b,P<0.05)。
a 炎症因子浓度在0与10ng/mL TNF-α诱导组比较 b 炎症因子浓度在10与30ng/mL TNF-α诱导组比较 c LINC00052与miR-145相对表达水平分析 d LINC00052与miR-145表达相关性分析
a LINC00052相对表达水平分析 b miR-145相对表达水平分析
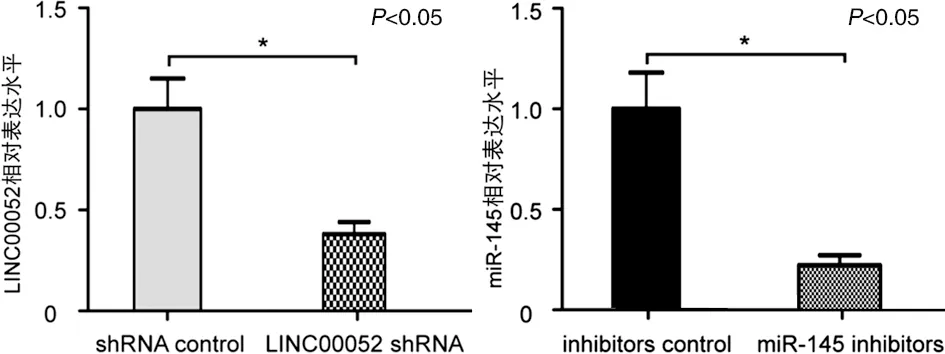
2.3 干扰LINC00052对TNF-α诱导人关节软骨细胞损伤模型中细胞增殖、凋亡及炎症反应的影响 MTT结果显示,shRNA control组C-20/A4细胞中24、48及72 h OD分别为(0.27±0.02)、(0.52±0.04)及(0.92±0.05),而LINC00052 shRNA组中24、48及72 h OD分别为(0.20±0.03)、(0.38±0.03)及(0.59±0.04),差异有统计学意义(见图3a,P<0.05)。蛋白质印迹结果显示,LINC00052 shRNA组C-20/A4细胞中CASP3、cleaved CASP3及BAX蛋白的相对表达水平分别是shRNA control组的(1.88±0.24)、(2.42±0.26)及(3.91±0.33)倍,差异有统计学意义(见图3b,P<0.05)。ELISA结果显示,LINC00052 shRNA组C-20/A4细胞中IL-1β、IL-6和IL-13浓度分别是shRNA control组的(3.05±0.46)、(2.77±0.34)及(2.45±0.20)倍,差异有统计学意义(见图3c,P<0.05)。
2.4 LINC00052直接负性调控miR-145的表达 生物信息学分析显示,LINC00052中5’-AACUGGA-3’序列可与miR-145中3’-UUGACCU-5’序列特异性结合(见图4a)。双荧光素酶报告基因实验结果显示,C-20/A4细胞转染LINC00052-wt后inhibitors control与miR-145 inhibitors组中相对荧光素酶比值分别为(1.0±0.29)与(5.17±0.46),差异有统计学意义(P<0.05);而转染LINC00052-mut后inhibitors control与miR-145 inhibitors组中相对荧光素酶比值分别为(1.0±0.18)与(1.03±0.22),差异无统计学意义(见图4b)。RT-qPCR结果显示,C-20/A4细胞转染shRNA control与LINC00052 shRNA后,miR-145的相对表达水平分别为(1.0±0.16)与(2.62±0.24),差异有统计学意义(见图4c,P<0.05)。C-20/A4细胞转染LINC00052 shRNA后,inhibitors control与miR-145 inhibitors组中miR-145的相对表达水平分别为(1.0±0.14)与(0.84±0.10),差异有统计学意义(见图4d,P<0.05)。
2.5 干扰miR-145部分逆转LINC00052抑制对TNF-α诱导C-20/A4细胞增殖、凋亡及炎症反应的影响 MTT结果显示,C-20/A4细胞转染LINC00052 shRNA后inhibitors control组24、48及72 h OD值分别为(0.22±0.02)、(0.35±0.03)及(0.67±0.05),而miR-145 inhibitors组中24、48及72 h OD值分别为(0.28±0.03)、(0.44±0.04)及(0.80±0.06),差异有统计学意义(见图5a,P<0.05)。蛋白质印迹结果显示,miR-145 inhibitors组C-20/A4细胞中CASP3、cleaved CASP3及BAX蛋白的相对表达水平分别是inhibitors control组的(0.90±0.15)、(0.12±0.06)及(0.31±0.10)倍,差异有统计学意义(见图5b,P<0.05)。ELISA结果显示,miR-145 inhibitors组C-20/A4细胞中IL-1β、IL-6和IL-13浓度分别是inhibitors control组的(0.62±0.10)、(0.37±0.08)及(0.71±0.15)倍,差异有统计学意义(见图5c,P<0.05)。
3 讨 论
越来越多的研究表明,大量lncRNA在OA软骨细胞中呈差异表达[9-10]。目前已经发现,一些lncRNA在OA中参与多种病理过程,包括细胞外基质降解、炎症反应、细胞增殖与凋亡和血管生成[11-13]。例如,分化拮抗非蛋白质编码RNA(differentiation antagonizing non-protein coding RNA,DANCR)在OA软骨细胞中表达上调,干扰DANCR表达抑制细胞增殖并诱导凋亡[14]。叉头蛋白D2相邻相反链RNA1(forkhead box D2 adjacent opposite strand RNA 1,FOXD2-AS1)在OA软骨细胞中表达上调,过表达FOXD2-AS1促进细胞增殖,而抑制FOXD2-AS1诱导细胞周期G0/G1期阻滞,并且促进细胞凋亡[15]。软骨损伤的相关RNA(cartilage injury-related RNA,CIR)在OA软骨细胞中高表达并通过调节自噬促进关节软骨退化[16]。此外,浆细胞瘤变异易位1(plasmacytoma variant translocation 1,PVT1)在OA软骨细胞中表达上调并在IL-1β诱导OA软骨细胞中引起代谢功能障碍和炎症反应改变[17]。软骨细胞是与软骨结构和功能相关的特殊细胞。软骨细胞增殖与凋亡的异常和炎症反应改变可能是导致OA软骨降解的主要原因之一[18]。TNF-α被认为是与OA发病相关的关键促炎因子,TNF-α可在体外诱导软骨细胞炎性损伤[19]。因此,开发抑制TNF-α诱导的软骨细胞损伤的新型靶向药物可能有助于改善OA。

a 细胞增值曲线 b CASP3、cleaved CASP3及BAX蛋白表达水平分析 c IL-1β、IL-6和IL-13浓度分析
a 细胞增值曲线 b CASP3、cleaved CASP3及BAX蛋白表达水平分析 c IL-1β、IL-6和IL-13浓度分析
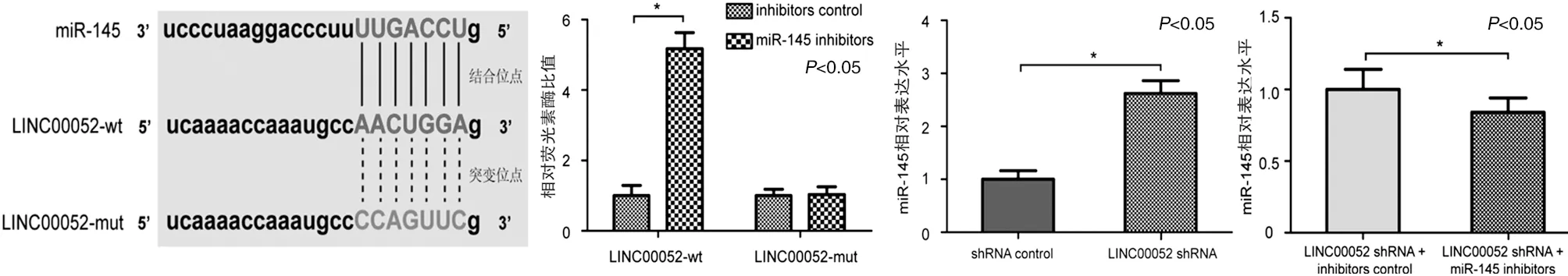
a LINC00052与miR-145结合位点预测图 b 双荧光素酶报告基因实验 c 干扰LINC00052对miR-145表达的影响 d 同时干扰LINC00052与miR-145对miR-145表达的影响
LINC00052定位于人第15号染色体长臂2区5带3亚带,包含3个外显子,由1 786个核苷酸组成。LINC00052是一种新发现的与癌症发展有关的lncRNA。LINC00052激活人表皮生长因子受体3(hairy-related 3,HER3)和Wnt/β-Catenin信号通路分别促进乳腺癌和胃癌进展[20-21]。然而,在胰腺癌和结直肠癌中,LINC00052被证明具有抑癌作用[22-23]。目前,关于LINC00052在OA中的生物学功能缺乏相关的报道。本研究通过TNF-α诱导成功建立人C-20/A4关节软骨细胞损伤模型来模拟OA的病理过程,发现LINC00052在0 ng/mL、10 ng/mL及30 ng/mL TNF-α诱导C-20/A4细胞中的表达水平呈上调趋势。鉴于LINC00052在肿瘤中的关键作用,因此我们推测表达上调的LINC00052在OA中亦具有重要作用。进一步采用细胞功能实验发现,干扰LINC00052降低TNF-α诱导C-20/A4细胞增殖能力,增加CASP3、cleaved CASP3及BAX的蛋白表达水平,并提高IL-1β、IL-6及IL-13的浓度。该结果表明,LINC00052对TNF-α诱导人关节软骨细胞损伤具有保护作用。
众所周知,lncRNA通过修饰DNA结构,RNA转录和蛋白质翻译来调控生物学过程[24]。竞争性内源RNA(competing endogenous RNA,ceRNA)机制是近年来发现的一种新的lncRNA调控机制。在这个机制中,lncRNA直接与靶标微小RNA(microRNA,miRNA)结合抑制其表达水平,从而影响疾病进展[25]。据报道,在肿瘤中LINC00052可通过ceRNA机制负调控多种miRNA,包括miR-574-5p、miR-452-5p、miR-330-3p及miR-608[22-23,26-27]。最近的研究证实,miR-145在调节炎症反应中起着至关重要的作用[28]。此外,研究者还发现肿瘤中miR-145的下调会促进细胞增殖并抑制凋亡[29]。我们的研究表明,miR-145在0 ng/mL、10 ng/mL及30 ng/mL TNF-α诱导C-20/A4细胞中的表达水平呈下调趋势,并与LINC00052表达呈负相关。双荧光素酶报告基因实验发现,miR-145是LINC00052的直接靶基因,干扰LINC00052上调C-20/A4细胞中miR-145的表达水平。与以前的研究一致,干扰miR-145部分逆转LINC00052抑制对TNF-α诱导C-20/A4细胞增殖、凋亡及炎症反应的影响。该结果表明,LINC00052靶向miR-145发挥对TNF-α诱导人关节软骨细胞损伤的保护作用。
总之,LINC00052在TNF-α诱导人关节软骨细胞损伤模型中表达下调。LINC00052直接负性调控miR-145的表达。LINC00052靶向miR-145发挥对TNF-α诱导人关节软骨细胞损伤的保护作用,其机制可能与促进增殖并抑制凋亡与炎症反应有关。

