Orbitrap Fusion Lumos三合一质谱技术分析鳜鱼、金鲳鱼和鲟鱼肌动蛋白肽指纹图谱的差异性
徐明芳,郑春丽,王洋洋,白卫滨*,叶 蕾,崔 静
(1.暨南大学生命科学技术学院,广东 广州 510632;2.暨南大学理工学院,广东 广州 510632)
鱼类肌肉蛋白质是多种蛋白的复合体,质量分数高达18%~22%以上,根据溶解性的不同,鱼肉中的蛋白质可以分为3 大类:高盐溶解蛋白如肌原纤维蛋白(55%~60%)、低盐溶解的肌浆蛋白(25%~35%)和不溶性基质蛋白(10%~15%)。其中,肌原纤维蛋白约占鱼类总蛋白含量的55%~60%,是鱼肌肉中含量最高的蛋白质,主要包括肌球蛋白(50%~55%)、肌动蛋白(20%~25%)、原肌球蛋白(5%~10%)和肌钙蛋白(5%~10%)4 个主要蛋白组分[1-2]。肌动蛋白存在于所有真核细胞中,肌动蛋白在真核细胞进化过程中相当保守[3-4],低等真核生物(例如酵母)只含有一种肌动蛋白,而多细胞生物通常含有多种肌动蛋白亚型,在哺乳动物和鸟类细胞中至少有6 种肌动蛋白异构体由不同的基因编码,已分离到6 种肌动蛋白[5],4 种称为α-肌动蛋白,分别为横纹肌(含骨骼肌)、心肌、血管平滑肌和肠道平滑肌所特有,另2 种为β-肌动蛋白和γ-肌动蛋白,见于所有肌肉细胞和非肌肉细胞质中[6]。
如图1[7]所示,肌动蛋白是一种高度丰富的细胞内蛋白,存在于每个真核细胞中,以单体G-肌动蛋白和多聚体F-肌动蛋白2 种形式存在,是细胞骨架的关键组成部分[8]。肌动蛋白的多聚体构成右螺旋的四级结构即纤维状[9-10],主要功能是聚合成细丝的能力,细丝在细胞黏附、机械收缩、定向迁移、肌肉收缩、细胞分裂和细胞内运输等基本过程中发挥重要作用[7]。在非肌细胞中,肌动蛋白G-肌动蛋白和F-肌动蛋白形式之间的动态转换调节多种细胞过程,包括细胞分裂[11]、黏附、运动和物质运输,除细胞骨架功能外,肌动蛋白可通过核输入直接结合在许多基因的启动子区域,调节基因转录[12];肌动蛋白也与某些疾病的发生密切相关,例如阿尔茨海默病[13-14]及心肌病[15-16],此外肌动蛋白还与衰老相关[17],对维持心血管系统、神经系统、免疫系统和生殖系统的正常功能具有重要作用[18-20]。肌动蛋白的研究最早可追溯到19世纪,自肌动蛋白被发现以来,对肌动蛋白的研究主要以兔[21]、牛[22]、小鼠[23]等哺乳动物为主,在进化过程中,肌动蛋白在蛋白质水平上高度保守,各种生物间氨基酸序列的同源性高达70%以上,但鱼类肌动蛋白的研究文献鲜有报道,鱼类肌动蛋白是否具有更高同源性及氨基酸序列的差异性值得深入研究。
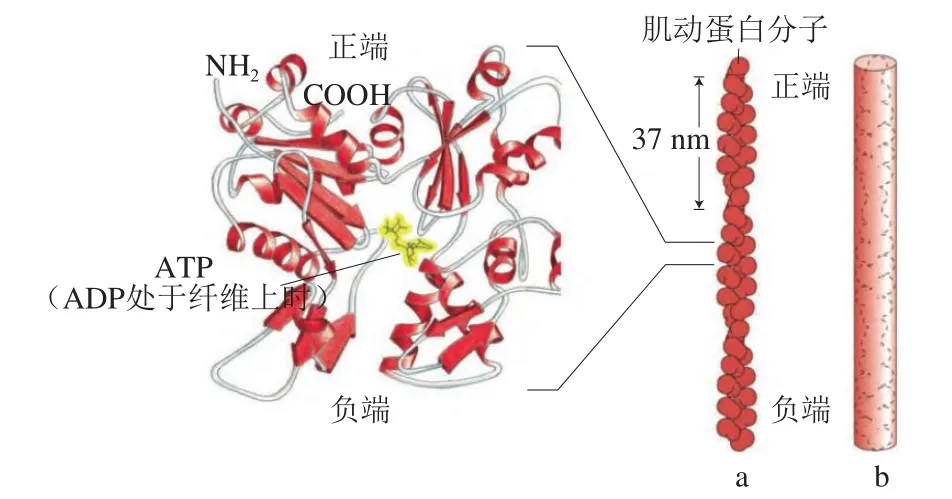
图1 G-肌动蛋白(a)和F-肌动蛋白(b)的结构[7]Fig.1 Structures of G-actin (a) and F-actin (b)
肽质量指纹谱分析,简称肽质指纹图谱,是目前蛋白质组学中鉴定蛋白真实性的高通量分析方法。在蛋白质肽质指纹图谱研究中,基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption/ionizationtime of flight mass spectrometry,MALDI-TOF-MS)是常用的分析工具。质量分析器是质谱仪分析鉴定的关键核心部件,目前最常用的质量分析器有四极杆、TOF、离子阱、静电场轨道阱(Orbitrap)等,不同类型的质量分析器组合会构成不同功能的质谱仪,近年发展二维线性离子阱组合型傅里叶转换质谱(linear trap quadropole orbitrap mass spectrometry,LTQ Orbitrap MS),因其高分辨能力,在特征肽段、未知蛋白的鉴定和差异蛋白质组的研究中具有独特优势。Orbitrap质谱仪器最高分辨率可达100 000,检测到亚10-6级,而TOF质谱仪分辨率小于3 000[24]。徐明芳等[25-26]利用LTQ Orbitrap MS质谱技术分析鉴定不同奶牛品种乳源如南方水牛奶、荷斯坦牛奶和山羊奶乳清蛋白的特征肽段与精细结构,研究了南方水牛奶酪蛋白和大豆蛋白主要组分肽质指纹图谱及氨基酸序列差异性,为乳源蛋白真实性检验技术的发展提供依据。Feng Jixing等[27]利用MALDI-TOF-MS分析南美白对虾45 kDa蛋白的酶解肽段,鉴定为45 kDa蛋白属于β-肌动蛋白,氨基酸序列覆盖率为28%。近年质谱仪在仪器灵敏度,质量分辨率和扫描速度方面又有新的突破,Orbitrap Fusion Lumos三合一高分辨质谱仪是目前最新型质谱仪,如图2所示。

图2 Orbitrap Fusion Lumos三合一质谱仪Fig.2 Structure of Orbitrap Fusion Lumos mass spectrometer
三合一质谱仪整合了四极杆质量过滤器、超高静电场轨道阱质量分析器与线性离子阱质量分析器三位一体同时运行,极大提高了离子采集精度与速度,与上一代LTQ Orbitrap MS相比对低至2 ng的蛋白质组样品的肽段鉴定率增加了3 倍[28],非常适合蛋白质组学中复杂体系的高通量蛋白检测。Sathe等[29]采用Orbitrap Fusion Lumos三合一质谱仪对脑脊液样品鉴定了111 个磷酸酪氨酸肽段及对应66 个蛋白,三合一质谱仪因其高灵敏度、高质量精确度、超高分辨率和扫描速度的优势倍受关注,但该技术用于鱼类肌动蛋白的研究鲜见报道。
本研究将采用Orbitrap FusionTMMS四极杆质量过滤器-静电场轨道阱-线性离子阱三合一高分辨质谱技术对鳜鱼、金鲳鱼和鲟鱼名贵鱼类肌动蛋白进行鉴定,通过对其特征肽段与氨基酸序列差异性进行分析,建立肌动蛋白肽质量指纹图谱,以期为鱼类蛋白真实性及品质属性鉴定提供技术方法,为开拓肌动蛋白在疾病与健康领域的应用研究及鱼类蛋白功能食品研发提供基础。
1 材料与方法
1.1 材料与试剂
鲜活鳜鱼(866±111)g、金鲳鱼(700±28)g和鲟鱼(1 486±98)g购自暨南大学菜市场。
碳酸氢铵、乙腈、三氟乙酸、二硫苏糖醇、吲哚-3-乙酸、胰蛋白酶均为分析纯。
1.2 仪器与设备
Orbitrap Fusion Lumos三合一质谱仪、Pico17型微型合成离心机 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 待测样品冻干粉的制备
肌原纤维蛋白的制备参照Lv Mingchun等[30]的方法,有所修改。取鱼肌肉组织50 g破碎,加入5 倍体积缓冲液A,10 000 r/min离心5 min,弃上清液,重复3~4 次,洗去水溶性蛋白质。取沉淀,沉淀加入10 倍体积缓冲液B,搅拌混匀,于4 ℃静置1 h,10 000 r/min离心10 min,得到的上清液即肌原纤维蛋白溶液。
双水相法制备鱼肌动蛋白冻干粉参照王洋洋等[31]的方法,在异丙醇质量分数26%、硫酸铵质量分数11%,pH 9.0条件下,制备5 L双水相体系萃取分离体系,肌原纤维蛋白加入量为体系总质量的30%,室温静置3 h后分离出上相经过35 ℃真空旋转蒸发20 min,4 ℃静置过夜,离心收集沉淀,蒸馏水透析去盐,真空冷冻干燥得到肌动蛋白冻干粉存4 ℃保存。
1.3.2 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳
各称取1.0 mg冻干粉于1.5 mL离心管中,加入1 mL样品缓冲液,充分溶解后,沸水浴加热5 min,冷却后加样。参照Laemmli[32]的电泳方法,分离胶10%,浓缩胶5%,电极缓冲液含0.05 mol/L三羟甲基氨基甲烷,0.384 mol/L甘氨酸,0.1%十二烷基硫酸钠。上样量为15 μL;开始电泳时浓缩胶电压为80 V,待样品进入分离胶后电压改为120 V。电泳结束后,取出胶片用考马斯亮蓝染色,用无水乙醇/冰醋酸脱色至背景清晰。
1.3.3 蛋白胶内酶解
将获得的鳜鱼、金鲳鱼和鲟鱼十二烷基硫酸钠-聚丙烯酰胺凝胶电泳胶酶解,酶解方法与实施步骤见参考文献[33]。
1.3.4 试剂配制方法
10 mL 100 mmol/L碳酸氢铵溶液:79.06 mg碳酸氢铵溶于超纯水中,定容到10 mL。1 mL脱色液:0.5 mL 100%乙腈,0.25 mL 100 mmol/L碳酸氢铵溶液,0.25 mL ddH2O。4 mL还原剂:6.2 mg二硫苏糖醇,1 mL 100 mmol/L碳酸氢铵溶液,3 mL dd H2O。4 mL烷基化试剂:40.69 mg吲哚-3-乙酸,1 mL 100 mmol/L碳酸氢铵溶液,3 mL ddH2O。2 mL覆盖液:0.5 mL 100 mmol/L碳酸氢铵溶液,0.2 mL 100%乙腈,1.3 mL ddH2O。酶液储液:1 mg/mL胰蛋白酶用覆盖液稀释至0.02 μg/μL。3 mL萃取液:0.075 mL三氟乙酸,2.01 mL 100%乙腈,0.915 mL dd H2O。1 mL样品溶解液:0.001 mL甲酸,0.02 mL 100%乙腈,0.979 mL dd H2O。
1.3.5 质谱检测
冻干的样品脱盐后,加入12 μL样品溶解液,充分振荡涡旋,离心,取10 μL上清液用Orbitrap Fusion Lumos三合一质谱分析。样品经C18反相柱(100 mm×75 μm,3 μm)分离,肽段在反相柱上洗脱梯度为5%~100%乙腈(含0.1%甲酸)洗脱30 min,流速为600 nL/min。
质谱条件:一级质谱的Orbitrap分辨率为60 000,质量扫描范围m/z350~1 500,最大注入时间为50 ms;二级质谱检测器类型Orbitrap,分辨率15 000,使用HCD模式碰撞裂解,碰撞能量31%,最大注入时间为100 ms。
1.3.6 质谱数据库检索与分析方法
根据样品物种来源从UniProt下载对应物种的蛋白质组数据库,数据分析使用Xcalibur、MaxQuant等软件。基于软件中自带算法与图片可视化功能,根据设定参数将液质联用技术得到的数据与数据库中数据进行匹配,通过肽段的一级和二级碎片的质量在数据库中找到匹配的蛋白质,实现样品中的蛋白质鉴定。
质谱得到原始数据为Raw格式,下载MSFileReader_x86_x64-_3.exe读数软件,打开Xcalibur软件与MaxQuant 1.6.0.16软件起始界面,用搜库软件进行数据库搜索,分别在鳜鱼、金鲳鱼和鲟鱼的蛋白质数据库(2019年11月15日下载自NCBI Protein数据库,以Siniperca chuatsi、Trachinotus ovatus和Acipenser sinensis为名,搜索结果分别包含5 186、5 893 条和235 条序列中搜索MS/MS质谱。
以鳜鱼为例,鳜鱼质谱原始数据(Raw文件)通过读数软件MSFileReader_x86_x64-_3.exe后导入MaxQuant 1.6.0.16软件或Xcalibur软件中,组特定参数(groupspecific parameters)Digestion设置为Trypsin,全局参数(global parameters)设置S.chuatsisequence.fasta数据库,执行搜库功能,通过样品质谱中每个m/z信号与数据库肽质量列表进行匹配并对整个肽段列表进行排序,在质量容差范围内的所有匹配项将用于计算分数和鉴定相应的蛋白质。
搜索参数设置:数据库为NCBInr,酶为胰蛋白酶,允许最大漏切位点为1,固定修饰为Carbamidomethyl(C),可变修饰为Oxidation(M),MS tolerance(容差)为0.15 Da,MS/MS tolerance为0.25 Da,其他参数均为软件默认值。在Xcalibur4.0软件平台或MaxQuant软件的可视化窗口下(Viewer)处理一级质谱和二级质谱图。搜库结果以combined-txt文件夹形式保存,combined-txt文件夹包含所有鉴定和定量的全部结果。
2 结果与分析
2.1 肌动蛋白的一级质谱与二级质谱


鳜鱼、金鲳鱼和鲟鱼肌动蛋白经胰蛋白酶酶解的多肽混合物分别经Orbitrap Fusion Lumos三合一质谱检测,采用Xcalibur软件与MaxQuant软件在可视化窗口下运行,获得蛋白质样品的一级和二级质谱图,如图3所示。软件分析得到鳜鱼二级质谱肽段数量249 个,金鲳鱼二级质谱肽段数量164 个,鲟鱼二级质谱肽段数量141 个,共计554 个肽段,基于篇幅,无法一一展示所有肽段,每种鱼类仅选取2 个特征肽段二级质谱如图4所示,由二级质谱离子峰匹配出相应氨基酸序列。
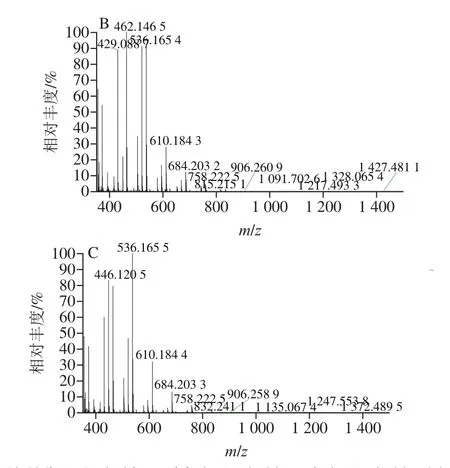
图3 3 种鱼肌动蛋白一级质谱图Fig.3 Primary mass spectra of actin from three fish species

图4 3 种鱼肌动蛋白特征肽段二级质谱图Fig.4 Secondary mass spectra of signature actin peptides from three fish species
2.2 鳜鱼、金鲳鱼和鲟鱼肌动蛋白质谱差异性
鳜鱼、金鲳鱼和鲟鱼肌动蛋白的多肽混合物分别经Orbitrap Fusion Lumos三合一质谱分析。质谱得到肽段信息用MaxQuant 1.6.0.16搜库软件分别在鳜鱼、鲟鱼和金鲳鱼的蛋白质数据库中进行检索,根据得分、匹配的肽段数、特征肽段数和覆盖率等综合评判鉴定出肽段氨基酸序列、肽段来源及所属蛋白的氨基酸全序列。蛋白鉴定结果见表1。

表1 鳜鱼、金鲳鱼和鲟鱼肌动蛋白质谱差异性Table 1 Differences in actin mass spectra among S.chuatsi,T.ovatus and A.sinensis
MS/MS产生的碎片信息搜库后会鉴定出氨基酸序列和所属的蛋白种类,并且肽段对于所属蛋白来说是否为特征肽段,质谱鉴定结果会直接告知。仅根据每种鱼类的特征肽段不足以鉴定蛋白,而是通过二级质谱产生的所有肽段搜索数据库,根据质谱鉴定到蛋白的肽段覆盖率、得分、匹配的肽段数、特征肽段数等参数综合评判来鉴定蛋白的类型,这些参数的值越大,蛋白质鉴定的准确性越高。
如表1所示,鳜鱼骨骼肌α-肌动蛋白肽段覆盖率为59.2%、金鲳鱼肽段覆盖率为54.1%、鲟鱼β-肌动蛋白为42.7%,鳜鱼有10 个特征肽段,金鲳鱼有24 个特征肽段,鲟鱼有12 个特征肽段。鉴定结果显示,鳜鱼、金鲳鱼和鲟鱼肌动蛋白的蛋白分子质量和主链氨基酸数量均有差异。鳜鱼骨骼肌α-肌动蛋白全序列氨基酸数量为377,分子质量为41 944 Da,金鲳鱼β-肌动蛋白全序列氨基酸数量为375,分子质量为41 766 Da,蛋白分子质量和全序列氨基酸数量均大于鲟鱼β-肌动蛋白(部分序列氨基酸数量为248,分子质量为27 921 Da)。鲟鱼蛋白质数据库中没有完整的肌动蛋白氨基酸全序列,只有2 个部分序列,因此鲟鱼肌动蛋白酶解后质谱鉴定匹配到的肽段数、蛋白分子质量和主链氨基酸数量均小于鳜鱼和金鲳鱼肌动蛋白。
2.3 鳜鱼、金鲳鱼和鲟鱼肌动蛋白肽指纹图谱的建立
鳜鱼、金鲳鱼和鲟鱼肌动蛋白经胰蛋白酶酶解得到的片段经Orbitrap Fusion Lumos三合一质谱分析,可鉴定出全部的肽段。得到的肽段经数据库检索分析可鉴定出肽段的来源,如TTGIVLDAGDGVTHNVPVYEGYALPHAIMR、EDEIAALVVDNGSGMCK、LCYVALDFEQEMATAASSSSLEK分别属于鳜鱼骨骼肌α-肌动蛋白、金鲳鱼β-肌动蛋白和鲟鱼β-肌动蛋白的酶解肽段。鳜鱼骨骼肌α-肌动蛋白、金鲳鱼β-肌动蛋白和鲟鱼β-肌动蛋白经质谱鉴定得到的全部肽段序列信息分别见表2~4,差异肽段见表5,同时,通过搜索蛋白质数据库获得肌动蛋白的氨基酸全序列(表6),结果中没有搜索到鲟鱼β-肌动蛋白的完整氨基酸序列,仅有2 个部分序列。

表2 鳜鱼骨骼肌α-肌动蛋白肽段氨基酸序列信息Table 2 Information about peptide sequence of α-actin in S.chuatsi skeletal muscle

表3 金鲳鱼β-肌动蛋白肽段氨基酸序列信息Table 3 Information about peptide sequence of T.ovatus β-actin

续表3

表4 鲟鱼β-肌动蛋白肽段氨基酸序列信息Table 4 Information about peptide sequence of A.sinensis β-actin

表6 鳜鱼、金鲳鱼和鲟鱼肌动蛋白氨基酸序列对比Table 6 Comparison of amino acid sequences of S.chuatsi, T.ovatus and A.sinensis actin
由表2~4可知,不同来源的肌动蛋白经胰蛋白酶酶解后质谱检测得到的肽段数量有差异。肽段数量最多的为鳜鱼肌动蛋白,酶解后可检测到29 个肽段,金鲳鱼共检测到24 个肽段,全为特征肽段,而鲟鱼最多检出13 个肽段。3 种鱼类肌动蛋白酶解得到的所有肽段中有多个相同的肽段。
由表5可知,鳜鱼骨骼肌α-肌动蛋白、金鲳鱼β-肌动蛋白和鲟鱼β-肌动蛋白的指纹谱中均有不同数量的差异肽段。与另外2 种鱼类肌动蛋白的指纹谱相比,鳜鱼骨骼肌α-肌动蛋白有10 个差异肽段,金鲳鱼β-肌动蛋白有5 个差异肽段,鲟鱼β-肌动蛋白酶解后鉴定到的肽段数量最少,仅有3 个差异肽段,因鲟鱼蛋白数据库不完善,搜库中无法匹配到鲟鱼肌动蛋白氨基酸全序列,这3 个肽段在蛋白氨基酸全序列位置无法确认,随着鲟鱼蛋白基因转录组学深入研究,有望得到进一步相关论证。

表5 鳜鱼、金鲳鱼和鲟鱼肌动蛋白肽指纹谱的差异性Table 5 Difference in fingerprints of actin peptides in S.chuatsi,T.ovatus and A.sinensis
由表6可知,鳜鱼骨骼肌α-肌动蛋白和金鲳鱼β-肌动蛋白由于蛋白类型不同,它们的一级结构在氨基酸数量和排列方面存在明显差异:鳜鱼骨骼肌α-肌动蛋白序列有377 个氨基酸,金鲳鱼β-肌动蛋白序列有375 个氨基酸;2 个氨基酸序列从相似序列开始发生了21 处氨基酸变异(鳜鱼骨骼肌α-肌动蛋白从第12个氨基酸开始,金鲳鱼β-肌动蛋白从第10个氨基酸开始,2 个序列为相似的氨基酸序列。氨基酸变异位置用括号标出)。鳜鱼骨骼肌α-肌动蛋白和部分鲟鱼β-肌动蛋白氨基酸序列从相似序列开始发生了17 处氨基酸的变异(从鳜鱼骨骼肌α-肌动蛋白第74位氨基酸开始,2 个序列为相似的氨基酸序列。氨基酸变异位置用下划线标出);部分鲟鱼β-肌动蛋白的氨基酸序列与金鲳鱼β-肌动蛋白的序列同源性较高,仅有3 个氨基酸存在变异,分别在第160、228、279位氨基酸处。
3 结 论
采用Orbitrap Fusion Lumos三合一质谱技术分析3 种鱼类肌动蛋白肽质指纹谱,肽段序列和蛋白氨基酸全序列比对结果表明,鳜鱼肌动蛋白全序列氨基酸数量和蛋白分子质量均高于金鲳鱼和鲟鱼。鳜鱼肌动蛋白全序列氨基酸数量为377,分子质量为41 944 Da;金鲳鱼全序列氨基酸数量为375,分子质量为41 766 Da;鲟鱼部分序列氨基酸数量为248,分子质量为27 921 Da。鳜鱼肌动蛋白的酶解肽段质谱检测到29 个肽段,鉴定为骨骼肌α-肌动蛋白;金鲳鱼检测到24 个肽段,鲟鱼则检出13 个肽段,均鉴定为β-肌动蛋白;与另外2 种鱼类肌动蛋白的肽质指纹谱相比,鳜鱼骨骼肌α-肌动蛋白有10 个差异肽段,金鲳鱼β-肌动蛋白有5 个差异肽段,鲟鱼β-肌动蛋白有3 个差异肽段,从氨基酸全序列的排列方式来看,鳜鱼骨骼肌α-肌动蛋白与金鲳鱼β-肌动蛋白从相似序列开始共有21 处氨基酸变异,与鲟鱼β-肌动蛋白从相似序列开始共有17 处氨基酸变异,鲟鱼部分β-肌动蛋白氨基酸序列与金鲳鱼β-肌动蛋白的序列同源性较高,仅在金鲳鱼β-肌动蛋白第160、228、279位氨基酸处存在变异。开展鱼肌动蛋白肽质指纹谱研究将为名贵鱼类质量品质属性的鉴定、鱼类肌动蛋白标准品的研制及鱼蛋白高通量芯片检测技术的发展提供新思路与参考依据,具有重要现实意义与广泛的应用前景。

